在藥劑學發展史上,藥物遞送載體是一些不具有生物活性的成分。近年來,納米藥物遞送載體蓬勃發展,常見的納米載體包括聚乳酸-羥基乙酸共聚物 [poly(lactic-co-glycolic acid),PLGA]、陽離子聚合物、金屬元素等。然而,一些納米載體在體內的安全性存在爭議。研究發現,高濃度金納米粒子可能與血液成分相互作用,並在體內特定組織中蓄積,從而產生細胞毒性[1]。因此,如何設計化石相容性高、可生物降解的納米載體仍是提高藥物有效性和安全性亟需解決的問題。
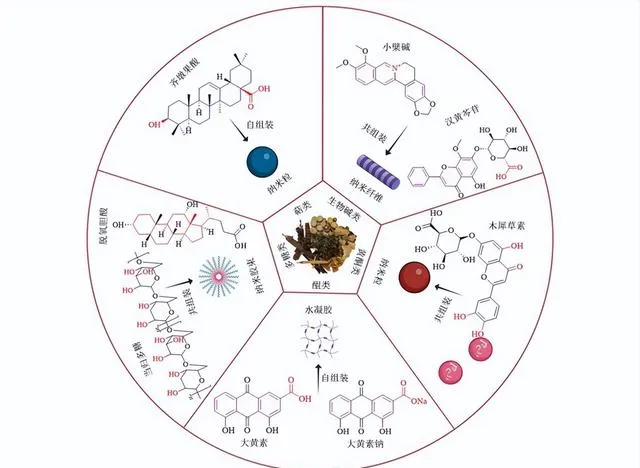
中藥含有多種活性成分,已被廣泛用於預防和治療疾病。其不僅表現出顯著的生物活性,而且具有良好的生物降解性和化石相容性。近年來,大量研究發現一些中藥活性成分如萜類、生物堿、黃酮類、蒽醌類、多醣類,具備自組裝或共組裝形成藥物遞送載體的能力(圖1)。相較於目前正在使用的一些藥物遞送載體,中藥活性成分作為納米載體具有較高的化石相容性、毒性和不良反應較小,且這些成分本身就具有藥理活性,與被包載的藥物能夠協同作用,發揮「藥輔合一」的效應。因此,許多中藥活性成分有望成為新一代藥物遞送載體,發揮更強的藥物遞送和疾病治療功能。
本文重點介紹了基於不同種類的中藥活性成分作為藥物遞送載體的最新進展,總結了載體形成的理化機制,並概述了其在疾病治療中的套用。透過深入剖析這些納米載體的形成機制,為中藥活性成分作為藥物遞送載體的研究提供理論基礎,並為中藥制劑現代化提供新的研究思路。
1 基於萜類化合物及其苷的載體
萜類化合物以異戊二烯為基本結構單元,是最豐富的中藥活性成分之一。常見的萜類化合物為四環三萜和五環三萜。萜類化合物缺乏柔性的甾體側鏈,其獨特的剛性框架使其更容易透過弱分子間力在溶液中形成自組裝納米聚集體。
1.1 齊墩果酸
齊墩果酸是一種五環三萜類化合物,以遊離酸的形式存在於馬纓丹的根皮中,具有抗腫瘤等藥理作用。Bag等[2]報道了齊墩果酸在苯、甲苯、5-三甲基苯、溴苯、硝基苯等25種溶劑中的自組裝特性。研究發現其在苯、甲苯、氯苯、丙醇、異丙醇等溶劑中均表現出優異的自組裝特性,並在19種液體中產生了強凝膠。
並且,在不同的溶劑中,齊墩果酸自組裝形成的載體大小不盡相同。如在氯苯中,齊墩果酸形成的球形自組裝體平均直徑為(99.8±9.0)nm;而在異丙醇和水性二甲基亞碸介質中,齊墩果酸均形成2.5~5.0 μm的球形自組裝體。同時,這些自組裝體均呈現雙層囊泡結構。研究者進一步研究了形成自組裝體的主要作用力,發現除了非極性三萜類主鏈的分散相互作用外,羥基和羧基間的氫鍵是主要驅動力。最後,將這種球形自組裝體用於包封化療藥阿黴素,發現其可以高效地包封阿黴素[3],提示齊墩果酸自組裝體可以成為一種潛在的藥物遞送載體。
1.2 甘草酸和甘草次酸
甘草酸和甘草次酸是甘草的主要活性成分。甘草酸是一種五環三萜酸,水解脫去糖酸鏈即得到甘草次酸,二者都具有廣泛的藥理活性,如抗癌、抗炎等。甘草酸的分子結構由親水性二葡萄糖醛酸單元和疏水性三萜苷元部份(即甘草次酸)組成。由於C-18空間構型的存在,天然甘草酸以2種差向異構體18α-甘草酸和18β-甘草酸存在,後者具有更強的生物活性和表面活性,在研究和實際套用中更常見。由於兩親結構和手性,甘草酸分子在水中表現出分級自組裝行為[4-5]。且大量研究表明甘草酸的這種自組裝行為可用於增加難溶性藥物的溶解度,如黃芩素[6]、紫杉醇[7]、小檗堿[8]、鬼臼毒素[9]等。
此外,基於甘草酸的多種衍生物也被用於開發多功能軟材料。如含醛甘草酸與羧甲基殼聚糖間可以透過希夫堿反應形成混成水凝膠,這種水凝膠表現出獨特而顯著的抗炎作用和抗菌能力。體內實驗表明,混成水凝膠透過增強肉芽組織的形成、促進膠原沈積、減少細菌感染和下調炎癥反應,促進未感染的和金黃色葡萄球菌感染的皮膚傷口愈合,有望成為生物醫學套用中一種有前途的傷口愈合敷料[10]。
盡管甘草次酸缺少親水性二葡萄糖醛酸單元,研究發現甘草次酸能在多種溶劑中自組裝,並能夠形成納米尺寸的球形花狀物體[11]。掃描電鏡結果顯示,花狀物體由33~88 nm厚度的2D片組成,而2D片由30~40 nm橫截面的交織纖維組成。此外,有研究發現甘草次酸和齊墩果酸也可以透過氫鍵和疏水作用自組裝形成納米載體。這種自組裝載體不僅提高了齊墩果酸和甘草次酸的生物溶解度和穩定性,並且其發揮的抗腫瘤作用遠大於遊離的齊墩果酸和甘草次酸。此外,使用其作為藥物載體來遞送紫杉醇,可以增強抗腫瘤活性並最大限度地減少紫杉醇引起的肝損傷,可見具有相似藥理活性組分的共組裝可以提高藥物載體的藥理功效[12]。
1.3 熊果酸
熊果酸是一種存在於夏枯草等植物中的五環三萜類化合物,具有抗氧化、抗炎、抗菌、抗腫瘤等活性[13]。基於靜電和疏水相互作用,熊果酸可以自組裝形成納米顆粒,其直徑約為150 nm。與遊離的熊果酸相比,熊果酸納米顆粒表現出更高的抗增殖活性,並且可以顯著增加CD4+ T細胞的活化,表明熊果酸納米顆粒具有免疫治療的潛力[14]。後續,熊果酸自組裝體被用於遞送多種藥物,包括紫杉醇[15]、阿黴素[16]、阿司匹林[17]、造影劑吲哚菁綠[18]等。
同時,包載的藥物性質也會影響自組裝體的結構與形態。如熊果酸與紫杉醇自組裝體呈現一種特殊的雙層囊泡結構。這是由於熊果酸與紫杉醇結構中的苯環形成很強的疏水相互作用,進而使紫杉醇結構中與醯胺鍵相連的2個苯環接近熊果酸結構中的2個甲基。借助於雙層囊泡結構,熊果酸和紫杉醇能直接透過被動擴散穿透細胞膜進入細胞,發揮強效的體內外抗腫瘤效應。
1.4 樺木酸及其衍生物
樺木酸是一種單羥基6-6-6-5五環三萜酸,分布於大棗、連翹等中藥中。具有抗腫瘤、抗炎、抗菌、抗病毒和抗糖尿病作用[19-20]。樺木酸可在多種有機溶劑和醇水混合物中自組裝形成凝膠或部份凝膠,提示其可作為藥物遞送載體[21]。樺木酸除了可以自組裝,還可以與其他分子透過共組裝的形式實作藥物遞送。
如Cheng等[22]將樺木酸與殼聚糖透過分子內和分子間氫鍵共組裝形成兩親性前藥分子。該制劑能與光敏劑Ce6透過π-π堆積結合,形成具有空心殼網絡結構的無載體光化療納米粒。這種納米粒具有化石相容性好、可生物降解、低毒高效的特點,可協同抗細胞程式性死亡-配體1單抗,從而發揮抗腫瘤化療/光動力療法/免疫治療效應。樺木酮酸是樺木酸的衍生物,具有相似的藥理作用。同樣,樺木酮酸也能透過分子間π-π堆積相互作用和疏水相互作用與Ce6共組裝,形成球狀納米藥物,進而增加Ce6在水中的溶解度,在體內外表現出化學/光動力的協同抗腫瘤效應[23]。
1.5 人參皂苷
人參皂苷是人參的主要活性成分,按其皂苷元結構分為齊墩果酸型五環三萜皂苷和達瑪烷型四環三萜皂苷。其中達瑪烷型人參皂苷包括二醇型人參皂苷(PPD)和三醇型人參皂苷(PPT)。PPD型皂苷的糖鏈位於苷元碳骨架的C-3和/或C-20位,包括人參皂苷Rb1、Rd、Rg3、Rp等;PPT皂苷的糖鏈位於苷元碳骨架的C-3、C-6和/或C-20位,包括人參皂苷Re、Rg1、Rg2、Rp等。人參皂苷具有調節免疫、抗疲勞、調節代謝和抗氧化等多種活性[24]。近年來,大量研究報道了基於人參皂苷的多種藥物遞送系統[25]。
人參皂苷骨架中的四環三萜呈現疏水性,而糖基又呈現親水性。這種兩親性使人參皂苷在水溶液中表現出自組裝傾向,形成膠束結構。膠束的形成不僅能包載藥物,提高藥物在水中的溶解度,也改變其在溶液中的理化性質。如自組裝的人參皂苷Rb1膠束可以負載雙氯芬酸,得到膠束型滴眼液。與市售雙氯芬酸滴眼液相比,膠束型滴眼液可顯著改善藥物的角膜滲透性及抗炎功效[26]。
除了自組裝外,人參皂苷還可與其他藥物分子共組裝形成膠束,起到協同治療的作用。Li等[27]將雷公藤紅素和人參皂苷Rp共價結合到聚乙二醇片段的2端,從而構建了雙親性聚合物。這種具有「疏水-親水-疏水」結構的聚合物材料可將雷公藤紅素封裝在膠束的疏水內核中,改善雷公藤紅素的生物利用度,從而提高抗腫瘤效應。此外,將人參皂苷Rg3引入到泊洛沙姆/磷脂酰膽堿/膽固醇聚合物膠束中,可以增強膠束對人結腸癌Caco-2細胞的藥物滲透,增加口服給藥的腸道吸收水平。
有趣的是,不同的人參皂苷與同一種藥物分子形成的載體形式也不盡相同。Guo等[28]考察了多種人參皂苷與柴胡皂苷形成自組裝體的能力。發現人參皂苷Ro和柴胡皂苷主要形成納米囊泡,人參皂苷Rg1和柴胡皂苷可形成球形納米膠束,而人參皂苷Rb1和柴胡皂苷可形成蠕蟲形納米膠束[29]。表明影響自組裝體行為的主要因素是人參皂苷含有的糖基鏈大小和種類。
脂質體是一種在藥物遞送領域套用非常廣泛的載體。其主要由磷脂雙分子層、膽固醇組成,其中膽固醇主要發揮穩定磷脂雙層膜的作用。人參皂苷的四環三萜骨架與膽固醇的結構類似[30],那麽其是否可以作為膽固醇的替代物用於制備脂質體?透過考察了多種人參皂苷與磷脂形成雙分子層的能力。發現人參皂苷Rg3、Rg5和Rp可代替膽固醇制備多功能脂質體,不僅能增強脂質體的穩定性,而且具有控制藥物緩釋、增強藥物治療效果、延長脂質體血液迴圈時間的特點[31-33]。
此外,不同結構的人參皂苷也能賦予載體不一樣的特性。研究顯示,人參皂苷Rg5能與腫瘤細胞膜上的葡萄糖轉運蛋白高效結合,因此人參皂苷Rg5脂質體具有腫瘤主動靶向效應[34]。而且,人參皂苷Rg5脂質體在體內遞送時還具備隱形效應。其能透過皂苷二糖基團的第3骨架減少脂質體表面調理素的吸附,增載入脂蛋白E的吸附,從而延緩巨噬細胞對脂質體的清除。將人參皂苷Rg5脂質體用於包載紫杉醇(G-紫杉醇)可以實作比市售紫杉醇制劑(Abraxane®、力撲素)更顯著的抗腫瘤效應,並阻止耐藥性的產生。進一步的研究證實,G-紫杉醇透過抑制P-糖蛋白外排功能和調節腫瘤細胞的自噬,逆轉了已存在的耐藥性並阻止了獲得性耐藥的發展。
1.6 其他萜類
有研究發現來自於茯苓的三環、四環類三萜化合物及來自於楓香的五環類三萜化合物都可以自組裝成可註射凝膠[35-36]。這些凝膠劑具有優良的緩釋性、生物降解力、化石相容性,在腫瘤等治療領域可發揮協同作用。
2 基於生物堿的藥物載體
生物堿在許多中藥中廣泛存在,大多數有復雜的環狀結構,且含有N元素,呈現堿的性質。生物堿是植物在應對環境脅迫時產生的次生代謝產物,往往具有一定的毒性。在藥理方面,其表現為抗病毒、抗菌的活性。生物堿可以與多種中藥活性成分共組裝,以其自身作為藥物和載體作為藥物和載體,從而發揮更強的藥效。
2.1 小檗堿
小檗堿是從黃連中分離得到的一種異喹啉類生物堿,是黃連的主要抗菌成分。研究發現小檗堿的季銨離子和苯環結構可以與黃酮苷類化合物自組裝形成具有合適粒徑的納米載體。小檗堿能與黃芩中主要活性成分黃芩苷和漢黃芩苷分別形成自組裝體(表1),並且具有截然不同的納米級形態。掃描電鏡分析發現黃芩苷和小檗堿自組裝形成納米粒,而漢黃芩苷和小檗堿則自組裝形成納米纖維[37]。
有趣的是,這2種納米載體在抗菌效能上也截然不同:黃芩苷和小檗堿自組裝形成納米粒具有比遊離的小檗堿更強的抗菌作用,而漢黃芩苷-小檗堿納米纖維的抗菌作用則比遊離的小檗堿要弱。可能是由於2種自組裝體表面性質不同引起的。黃芩苷和小檗堿自組裝形成納米粒具有的親水性表面使其更容易附著在細菌上,並持續釋放出小檗堿,導致局部藥物濃度較高,有利於殺死細菌;漢黃芩苷-小檗堿納米纖維具有的疏水性表面使其很難附著在細菌上,因此抗菌效果較差。

除了黃酮類化合物,小檗堿還能與有機酸成分自組裝。如小檗堿和肉桂酸自組裝形成的納米粒,在這個過程中無需任何特殊處理。該納米粒在抑制多重耐藥金黃色葡萄球菌方面遠優於一線藥物諾氟沙星、安默西林、四環素等[38]。
除了協同發揮藥效,小檗堿可以透過與毒性較大的藥物自組裝來對抗其毒性。馬兜鈴酸是細辛和馬兜鈴等傳統中藥的成分之一,其具有顯著的腎毒性和肝毒性。近年來研究發現,含馬兜鈴酸的中草藥與小檗堿原產藥黃連合用可顯著降低馬兜鈴酸的溶出。Wang等[39]發現小檗堿和馬兜鈴酸能透過靜電吸引、π-π堆積和疏水相互作用共組裝形成線性異質超分子,從而降低馬兜鈴酸在湯劑中的濃度。為理解傳統中醫使用不同藥性的中藥來減輕毒性提供了一種新思路。由於其強大的共組裝能力和抗菌潛力,小檗堿已成為中藥活性成分作為遞送載體研究最多的成分之一,目前已經有報道的共組裝體見表1。
2.2 喜樹堿及其衍生物
喜樹堿是一種天然植物生物堿,可以靶向細胞內DNA拓撲異構酶,表現出有效的抗腫瘤活性[44]。喜樹堿本身的水溶性較低,因此生物利用度較低。近年來研究發現喜樹堿可以自組裝成螺旋狀納米帶。和遊離的喜樹堿相比,喜樹堿自組裝體具有更強的腫瘤抑制效應。此外,喜樹堿衍生物(羥喜樹堿、伊立替康等)也可以自聚整合扁平糊圓柱形納米帶。目前,喜樹堿和其衍生物形成的自組裝納米帶已被報道用於遞送阿黴素[45]、類姜黃素[46]等多種其他化療藥物,以實作腫瘤的協同治療。
2.3 血根堿
博落回的萃取物血根堿具有抗炎、抗氧化、抗微生物、改善腸道健康、抗癌癥等生物學活性。Wang等[47]發現血根堿能與黃芩苷透過靜電吸引、π-π堆積、氫鍵等非共價鍵自組裝形成無載體二元小分子水凝膠。這種小分子凝膠具有可塑性和可註射性,並且具有顯著的抗菌效應和化石相容性,可作為促進傷口愈合的敷料。
3 基於黃酮類化合物及其苷的載體
黃酮類化合物是2個苯環透過3個碳原子相互連線而成的一系列化合物的總稱。常見的藥理活性包括抗腫瘤、抗菌、抗突變活性、心血管保護作用及抗氧化能力[48-49]。其中的多種兒茶酚類黃酮,如木犀草素、槲皮素、山柰酚、黃芩素和兒茶素,可以與包括鐵離子(Fe3+)在內的金屬離子結合進行配位自組裝。與金屬離子的配位自組裝不僅會影響黃酮類化合物本身的穩定性,也可以表現出更強甚至全新的藥理活性。
3.1 木犀草素
木犀草素是一種天然黃酮類化合物,存在於多種中藥中,如金銀花、紫蘇等,具有消炎、抗過敏、降尿酸、抗腫瘤、抗菌、抗病毒等藥理活性[50]。木犀草素中含有1個羰基和4個酚羥基,易與金屬離子配位,並自組裝形成納米粒[51]。與木犀草素相比,納米粒表現出高溶解度,並且表現出顯著增強的抗氧化作用。重要的是,Fe3+配位納米粒表現出超分子光熱效應,使其發揮光熱劑的作用。體外抗腫瘤實驗表明,納米粒可以更有效地殺死癌細胞。可見,配位自組裝在中藥現代化方面具有廣泛的用途和前景,並且可能對推進癌癥治療具有重要意義。
3.2 槲皮素
槲皮素是一種廣泛存在於柴胡、桑葉等中藥的類黃酮化合物。其結構中包含許多具有氧化還原活性的酚羥基,表現出抗氧化、抗缺血、神經保護等藥理作用[52]。類似於木犀草素,研究表明其也可與多種金屬離子形成絡合物[53]。且該配合物的活性顯著高於槲皮素本身。如槲皮素-鈷復合物和槲皮素-鉻(III)復合物比槲皮素具有更高的1,1-二苯基-2-三硝基苯肼自由基清除活性,並且槲皮素與多種金屬離子形成的絡合物都比槲皮素具有更強的抗腫瘤效應[54-56]。此外,槲皮素-銅絡合物具有顯著的DNA切割效應,提示其有望在抗腫瘤、抗菌等方面發揮潛在作用[53]。此外,作為一種疏水性分子,槲皮素與親水性分子如殼聚糖、透明質酸等綴合後可以自組裝形成膠束,用於遞送治療性藥物(如紫杉醇)和生物成像試劑(如銀納米粒)等[57-59]。
3.3 黃芩苷
黃芩苷是黃芩的活性成分,具有抗炎、抗菌的作用[60]。其結構中的2個酚羥基、3個羥基、1個羰基和1個羧基,可以透過配位鍵和氫鍵與金屬離子如Al3+自組裝形成納米粒。基於此,Jia等[61]開發了一種口服胰島素遞送載體,可以保護胰島素在胃部強酸性條件下不被降解,而在腸道堿性條件下釋放胰島素並延長其保留時間。同時,黃芩苷可透過細胞旁路途徑改善胰島素的吸收水平,產生顯著的降血糖效應。此外,黃芩苷本身作為一種兩親性化合物,能夠與小檗堿形成共組裝,並提高小檗堿的溶解度。
3.4 葛根素
葛根素是一種來自葛根的天然生物活性異黃酮類化合物,具有擴張腦血管和冠狀動脈的功能,可以改善心腦血管的血液供應。其無需任何結構修飾即可自組裝形成pH敏感的水凝膠。Pang等[62]對葛根素成膠的機制進行研究。發現在過飽和濃度下,凝膠化過程是由成核引發的,然後纖維從成核中心迅速生長。隨著過飽和度的增加,纖維生長類別從「線性」轉變為「非線性」,導致結構更致密,碎形維數更高,力學效能更強。由於可生物降解性且無毒性,這種自組裝葛根素水凝膠可以作為聚合物凝膠的替代品。
4 基於多糖的載體
中藥多糖具有生物降解力、高安全性和化石相容性等特點,表現出免疫調節、抗炎、抗氧化、抗腫瘤等生物活性。從結構上看,中藥多糖由不同長度的糖鏈及其支鏈組成,糖鏈中含有大量的羥基、羧基、醛基等親水基團,因此可以透過將疏水基團綴合到多糖分子上,合成兩親性聚合物,從而使其自發聚整合膠束。此外,多糖也可以透過化學或物理交聯形成水凝膠[63]。不同於均一性分子形成的水凝膠,多糖形成的水凝膠具有不同尺度的有序結構,因此具有優異的效能,在材料科學中具有廣闊的套用前景。
4.1 靈芝多糖
靈芝多糖是靈芝的主要活性成分之一,具有抗腫瘤、免疫調節、抗氧化、降血糖等藥理作用。靈芝多糖由葡萄糖、甘露糖、半乳糖、木糖、巖藻糖和阿拉伯糖等組成,但只有β-葡聚糖(純葡萄糖聚合物)被認為是靈芝多糖中的活性成分之一[64]。
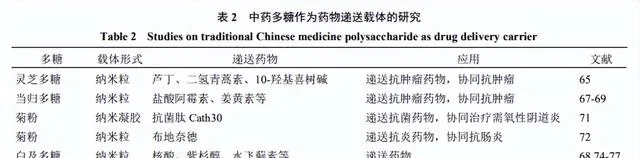
將親水的靈芝多糖與疏水的藥物分子綴合,可以自組裝形成納米粒。如Zheng等[65]將疏水的蘆丁和二氫青蒿素(DHA)分別透過硼酸酯和二硫鍵連線到靈芝多糖上,並用於包載10-羥基喜樹堿(HCPT),形成蘆丁-羧基苯基硼酸-靈芝多糖-二硫代二丙酸-DHA/HCPT聚合物納米顆粒。在微酸性腫瘤微環境中,硼酸酯鍵首先斷裂,蘆丁被釋放。然後,在腫瘤細胞高濃度的谷胱甘肽作用下,二硫鍵斷裂,DHA和HCPT被釋放到細胞內。體內外實驗表明,基於靈芝多糖的pH和谷胱甘肽雙響應納米顆粒可以有效殺死腫瘤細胞,抑制腫瘤生長,並且不良反應較小。
4.2 當歸多糖
當歸多糖是當歸的主要有效成分,具有較強的免疫調節、抗氧化、抗腫瘤和保護肝臟活性[66]。近年來,當歸多糖作為藥物載體的研究受到廣泛關註。由於其具有高密度的半乳糖和支鏈結構,當歸多糖對肝臟中分布廣泛的脫唾液酸糖蛋白受體具有高親和力,因此基於當歸多糖開發的藥物方面具有潛在的套用前景。透過將親水的當歸多糖與疏水性分子如去氧膽酸等進行嵌合,得到兩親性分子。這種分子進一步自組裝能形成納米粒,用於包載親水性藥物(如鹽酸阿黴素)[67]或疏水性藥物(如姜黃素)[68-69]。研究表明,當歸多糖不僅具有藥物載體的作用,而且還起到改善腫瘤微環境、增強免疫功能的作用,與化療藥物產生協同抗腫瘤效應。
4.3 菊粉
菊粉是一種常見的中藥,是菊科植物野菊的幹燥頭狀花粉,主要由果糖和葡萄糖組成。菊粉是一種益生元,透過在體內產生短鏈脂肪酸(乙酸、丙酸、丁酸)來改善腸道微環境,降低pH值,促進雙歧桿菌和乳酸菌的生長[70]。因此,菊粉具有恢復酸性微環境和促進益生菌增殖的能力。
Wang等[71]報道菊粉能夠和明膠共組裝成核心納米顆粒,後續透過化學交聯作用可將其穩定化為核殼納米凝膠(CSNGs)。該研究透過靜電作用將抗菌肽Catp0包載到CSNGs中,用於需氧性陰道炎治療。在致病菌分泌的明膠酶作用下,納米凝膠能夠緩慢將Catp0和菊粉釋放,從而發揮雙重治療效應。
研究顯示,菊粉在上消化道不能被代謝,在結腸區域微生物作用下才能被代謝。因此,其可以作為一種結腸靶向給藥的遞送載體。Sun等[72]在菊粉上透過二硫鍵修飾了一種疏水基團4-胺基苯硫酚,得到兩親性菊粉衍生物。這種衍生物可以進行自組裝形成納米粒,並用來包載疏水性藥物如布地奈德。在炎癥性腸病的氧化應激環境下,二硫鍵發生還原性裂解,釋放出藥物和菊粉分子,產生協同抗炎作用。
4.4 白及多糖
白及多糖是從白及中分離得到的主要活性成分,其具有收斂止血、促進傷口愈合的作用[73]。白及多糖富含甘露糖,而甘露糖可以與巨噬細胞表面高表達的甘露糖受體結合,從而被介導內吞進入巨噬細胞。那麽是否可以將白及多糖作為載體,將藥物靶向遞送至巨噬細胞呢?Dong等[74]在白及多糖上修飾了含氮基團乙二胺,使其具有大量陽離子。這種陽離子化的白及多糖與呈現負電的核酸自組裝形成納米粒,並將核酸靶向遞送至巨噬細胞。
用疏水基團(烷基、芳烷基和脂肪酸)修飾親水性多糖,可產生兩親性多糖衍生物,從而提高捕獲疏水性抗癌藥物如多西紫杉醇(DTX)、阿黴素的能力[68,75-76]。疏水基團的取代度值會影響自聚集納米粒子的效能。如隨著硬脂酸部份取代度的增加,白及多糖-硬脂酸納米顆粒中DTX的累積釋放百分比、臨界聚集濃度和平均粒徑均下降,而包封率和負載量增加[77]。同時,膠束殼和負載的藥物之間存在一些化學鍵,這些化學鍵可以響應某些刺激而斷裂[78]。此外,由於中藥多糖巨大的比表面積和豐富的活性基團,白及多糖本身也可以與靶向配體如葉酸、生長因子、抗體和肽等相連,以實作對特異性組織的靶向,提高給藥效率[76]。
中藥多糖作為藥物遞送載體的研究見表2。
5 基於其他中藥成分的載體
5.1 醌類
醌類化合物是一類含有醌結構的有機化合物,具有良好的化石相容性、氧化還原特性和可修飾性。醌類化合物因其獨特的化學性質和多重功能,可作為藥物遞送載體,透過調控其結構和性質,實作對藥物的高效遞送、控制釋放及提高藥物的生物利用度。大黃酸是一種來源於大黃的醌類化合物,是大黃中的主要活性成分之一,具有刺激腸道蠕動、抗炎、抗氧化、抗菌活性。研究報道大黃酸在pH 8.0~9.4時可以自組裝成基於納米纖維網絡的水凝膠[81]。
這種水凝膠可以使大黃酸緩慢釋放,從而實作更強和更持久的抗炎效應。該研究透過紫外光譜、圓二色譜、X射線繞射分析和理論計算,提出了一種可能的大黃酸水凝膠自組裝過程:在弱堿性條件下,部份大黃酸分子去質子化形成大黃酸鈉鹽。大黃酸單體和大黃酸鈉鹽透過π-π堆積形成二聚體。由於羧酸離子間的靜電排斥,2個分子傾向於以相反的方向排列。隨後,二聚體進一步組裝成三聚體、四聚體和更高階的聚集體,最終交聯形成3D網絡。
5.2 酚醚類
和厚樸酚是主要來源於厚樸的一種酚醚化合物,具有抗炎[82]、抗癌[83]、抗氧化[84]等藥理功效。盡管和厚樸酚表現出多種顯著的藥理功效,其溶解度低、生物利用度低、代謝快等缺點,限制了其在臨床上的廣泛使用。Ji等[85]透過分子間氫鍵和疏水相互作用將和厚樸酚自組裝成納米粒子。這種納米粒子本身可以作為載體,同時又是藥物,增加了和厚樸酚的溶解度和穩定性。此外,該納米粒子在腫瘤區域具有高滲透長滯留效應而表現出優異的腫瘤靶向能力。
5.3 二酮類
二酮類化合物姜黃素是姜黃中的主要活性成分,具有抗氧化、抗炎、抗腫瘤、免疫調節等多種藥理活性[86]。姜黃素可以與金屬元素釓(Gd)進行配位作用,形成姜黃素-Gd納米粒。姜黃素與Gd3+配位組裝的納米粒子顯著提高了姜黃素的生物利用度和載藥量。Wen等[87]將姜黃素-Gd納米粒包封光敏劑吲哚菁綠,顯著提高了腫瘤化療聯合光動力治療的治療效應。
5.4 蛋白質類
最近有報道稱,傳統中藥湯劑中形成的膠體與其療效密切相關[88]。這種膠體聚集體可穿透單層Caco-2細胞,這種現象已在60種中成藥制劑和24種草藥的煎劑中觀察到[89]。考慮到水幾乎是中藥煎煮的唯一溶劑,且許多生物活性化合物都是疏水性的,推測煎煮過程(通常認為是長時間的煮沸)會誘導兩親性生物大分子(如蛋白質和多糖)和疏水性生物活性成分自發形成復合物,兩親性物質可以作為疏水性物質的載體來提高它們的包封率。
受此啟發,Weng等[90]探索了太子參蛋白作為藥物遞送載體的潛在套用。太子參蛋白來源於太子參,具有顯著抗氧化的功效。研究透過熱處理模擬中藥煎煮的過程,將太子參蛋白與疏水性藥物姜黃素自組裝形成了納米復合物[91]。這種納米復合物不僅提高了姜黃素的生物利用度,還可以協同發揮藥效,具有更強的抗氧化效應。
5.5 揮發油類
揮發油是從植物的葉、花、皮、芽、種子、莖、根、皮和豆莢等不同部位分離出來的次生代謝物[92]。是極性和非極性化合物的復雜混合物。從藥用植物中提取的揮發油具有抗糖尿病作用、抗真菌作用、抗痙攣作用及抗炎和抗氧化活性[93]。
丁香酚是一種酚類芳香族化合物,主要從丁香的揮發油中獲得。這種簡單的苯酚具有多種藥理特性,如抗氧化、抗炎和抗癌活性等[94]。研究證明,丁香酚透過改變膜脂肪酸、破壞細胞質膜完整性或抑制酶活性等多種作用機制,顯著抑制細菌和真菌的生長和繁殖[95-97]。但丁香酚的水溶性和穩定性差,限制了其作為抗菌劑的廣泛套用。Fan等[98]在不添加任何助表面活性劑的情況下,由槐脂和丁香酚作為原料自組裝制成穩定的納米乳劑,平均粒徑小於200 nm。與丁香酚相比,這種納米乳劑對革蘭陽性和革蘭陰性食源性細菌的抗菌活性都有顯著提高,為開發抑制致病性汙染或細菌感染的抑菌劑提供了一種綠色有效的方法。
歐芹揮發油是一種從廣泛分布於地中海地區的植物歐芹中提取的揮發油,在傳統醫學中用於治療胃酸和消化問題,及預防呼吸道感染等[99]。Miranda等[100]將歐芹揮發油作為納米顆粒制劑的一種納米結構劑,制備了具有高捕獲效率和良好穩定性的納米脂質體,然後將這種膠體系統結合到水凝膠中。歐芹揮發油具有納米顆粒的活性成分和納米結構的雙重關鍵功能,同時該凝膠具有持續釋放行為和儲庫效果,適用於長期局部遞送。
已有研究表明,多種中藥揮發油可作為脂質體原料。除了歐芹揮發油,Carbone等[101]將迷叠香、薰衣草和牛至屬揮發油作為納米脂質載體,這種脂質載體具有增強化石相容性並降低純油的細胞毒性的作用,可用於聯合給藥氯黴素,具有協同效應。實驗結果表明,將這些揮發油作為固有油性成分制備納米脂質體,不僅具有潛在的抗菌活性,還延長了抗生素的體外釋放時間,是一種有望提高局部念珠菌病藥物有效性的策略。
6 結語與展望
本文總結了近年來中藥活性成分作為載體材料在藥物遞送系統中的套用,分析了這些化合物形成藥物遞送載體的機制,並展望了中藥活性成分作為載體材料在藥物遞送系統領域的發展潛力。這些發現有助於更深入地認識中藥活性成分的結構特征及其形成遞送載體的機制,同時也為構建更有效的藥物遞送系統提供了新的啟示,為中藥活性成分實作「藥輔合一」開辟了新的研究方向和可能性。
不同類別的中藥活性化合物形成藥物遞送載體的機制與其結構特征密切相關。四環三萜和五環三萜等萜類化合物具有剛性甾體骨架,這種結構間的疏水相互作用可使其在溶液中具有自組裝特性。萜類化合物往往含有羧基,可以與其自身或其他化合物的羥基形成氫鍵,從而形成自組裝或共組裝體[102]。生物堿是一類含氮雜環化合物,這類荷正電的化合物可以透過靜電作用與含有羧基等荷負電的化合物組裝構建藥物遞送體系。此外,生物堿中的芳香環結構也容易與自身或其他含有芳香環的化合物透過π-π堆積進行組裝[103]。
黃酮類化合物具有苯環結構,π-π堆積是其最常見的組裝機制。特別的是,諸如木犀草素[51]、槲皮素[104]等黃酮是一類具有多羥基結構的化合物,這些空間上接近的2個羥基,或4-位羰基與其在空間上接近的羥基,可以與金屬離子透過配位作用形成螯合組裝體系。醌類化合物通常具有平面結構,其中包含的芳香環形成了平行的π電子體系,這種平面結構有助於醌類化合物之間π-π電子體系的相互作用而構成組裝體系[81]。中藥多糖裏含有大量的羥基、羧基、醛基等親水基團,往往可以與疏水性基團共價結合形成兩親性聚合物,從而組裝形成膠束、納米粒等藥物遞送系統。
相比於傳統藥物遞送系統,將中藥活性成分開發為藥物遞送納米載體具有顯著的優勢。
(1)一些中藥活性成分具備透過自組裝形成「自遞藥系統」的能力,可以充分利用其自身性質形成遞送系統,實作「藥輔合一」。如和厚樸酚透過分子間氫鍵和疏水相互作用自組裝成納米粒子,這種納米粒子本身可以作為載體,同時又是藥物,可明顯提高載藥量[85]。
(2)傳統制劑在靶向方面需要復雜設計,而一些中藥活性成分具有天然的靶向性。如在當歸多糖上嵌合去氧膽酸,賦予了當歸多糖兩親性,進而自組裝形成納米粒[67]。由於當歸多糖具有高密度的半乳糖和支鏈結構,對肝臟中分布廣泛的脫唾液酸糖蛋白受體具有高親和力,使當歸多糖納米粒具有肝臟靶向性。
(3)將中藥活性成分透過配位作用與金屬離子絡合,可增強化合物本身的穩定性。如將槲皮素與鈷或鉻配位形成的復合物,槲皮素的穩定性增強[56]。
(4)相比於化學合成的藥物遞送載體,中藥活性成分作為遞送納米載體還具有化石相容性高、毒性小的特點。由於這種系統可以透過自組裝或共組裝的形式構建得到,其制備工藝較為簡單,易於工業化生產,並且具有綠色環保的特性。
然而,目前關於中藥活性成分作為遞送納米載體的研究還有一定的局限性。後續研究者利用中藥活性物質開發新型藥物遞送系統時,可重點考慮以下幾個方面:
(1)不同類別的中藥活性成碎形成藥物遞送系統的機制不同,在設計時可以根據成分的類別和結構特性設計適宜的體系,以提高系統的穩定性、載藥和釋藥效能;
(2)目前以中藥活性成分作為藥物遞送系統主要集中在抗腫瘤藥物遞送和創面藥物遞送領域,而中藥活性成分的藥理作用廣泛,其作為遞送系統在抗炎、抗氧化、抗菌、抗病毒等領域中可進一步拓展;
(3)雖然人參皂苷脂質體已進入臨床試驗階段,未來有上市的可能性,但生物堿、黃酮類、醌類、多醣類等活性成分作為藥物遞送系統目前尚未有進行臨床試驗的報道;
(4)雖然中藥的化石相容性較好,但是提取出來的活性成分作為納米遞藥載體是否會在體內滯留、蓄積,並產生毒副作用並不完全清楚。因此,中藥活性成分作為藥物遞送系統的安全性與成藥性還需進一步考察。
中藥活性物質各個成分間復雜的相互作用是其發揮整體藥效的基礎。以中藥活性成分作為新一代載體在藥物遞送領域逐漸嶄露頭角,為實作中藥「藥輔合一」開辟新的研究方向,為中藥創新制劑的開發提供新的發展機遇。
來 源:韓 靜,包純潔,段嘉倫.中藥活性成分作為藥物遞送納米載體的研究進展 [J]. 中草藥, 2024, 55(16): 5678-5692.











