*僅供醫學專業人士閱讀參考
讓腫瘤微環境裏一些走上邪路的細胞「浪子回頭」,從抑制抗腫瘤免疫應答變為助力免疫應答,應該算是許多科研工作者的夙願了,而常被提到的挽救物件之一就是腫瘤相關巨噬細胞(TAMs),不過讓它們改邪歸正的難度確實不小,奇異點糕也經常在想,要是有某個通路或分子能像開關一樣,只要輕輕一撥把它啟用,就能讓TAMs們迷途知返呢?
別說,這樣的開關或許真的有。國慶假日期間,Science Advances期刊發表了一項來自復旦大學基礎醫學院張思團隊與復旦大學附屬中山醫院董玲、薛如意團隊的最新研究成果,研究揭示在肝細胞癌(HCC)中,啟用TAMs表面的NOD樣受體(NLRs)家族成員NOD1,就可以讓TAMs切換為助力抗腫瘤免疫應答的正向形態。
NOD1在HCC腫瘤微環境裏的TAMs中廣泛存在,且與患者對免疫治療的應答和預後正相關。從作用機制來說,啟用NOD1可有效下調TAMs內脂滴相關蛋白perilipin 5,阻礙TAMs的脂肪酸氧化作用、使遊離脂肪酸在細胞內堆積,而這些代謝改變會促進共刺激分子OX40L的膜定位,使TAMs啟用CD8+T細胞的能力顯著增強,也就上調了免疫應答[1]。

論文首頁截圖
人體內具有抗原呈遞功能的細胞,例如巨噬細胞和樹狀細胞都存在NLRs高表達,不過此前學界圍繞NLRs展開的研究,大多與它們在抗感染過程中啟用固有免疫通路相關[2],直到近些年焦點才向癌癥傾斜,開展本次研究的復旦團隊也在2021年發表論文,初步揭示了NOD2促HCC發生的潛在機制[3],但研究發現的也是NOD2對癌細胞行為的影響。
那換個角度來看,在腫瘤微環境中的巨噬細胞是否會高表達NLRs,NLRs又有怎樣的影響呢?研究者們透過分析HCC單細胞測序結果,發現HCC微環境內大量存在的抑癌性M1型TAMs,會特征性高表達NOD1等關鍵基因,且NOD1+TAMs對T細胞啟用的調控作用明顯較NOD1-TAMs更強,這在初步篩選的關鍵基因中是獨一份。
自然而然地,NOD1就成為了後續研究的重點,流式細胞術和多重熒光免疫染色(mIF)分析顯示,存在較多NOD1+TAMs的HCC內,啟用狀態CD8+T細胞的占比也明顯更高,且在NK細胞、調節性T細胞等其它免疫細胞組分占比未發生明顯改變的狀況下,NOD1+TAMs水平就與患者生存預後(OS/RFS)呈顯著的正相關性。

HCC微環境內的NOD1+TAMs水平,與CD8+T細胞啟用狀態及患者生存預後均呈正相關
體外細胞實驗顯示,啟用NOD1可使TAMs轉變為免疫刺激表型,它們啟用CD8+T細胞增殖和細胞毒性功能的效果顯著增強,放到荷瘤小鼠身上就能轉化為CD8+T細胞依賴性的抑癌效應,顯然是值得利用的正向調節,那就得闡明啟用NOD1具體的起效機制了。
基因集富集分析(GSEA)很快提示,NOD1啟用與TAMs內的脂肪酸氧化(FAO)相關通路呈顯著負相關性,其中受影響最明顯、作用也最關鍵的就是perilipin 5,NOD1對它的調控可能是經由啟用p38訊號通路,下調PPARα來影響其編碼基因的轉錄;而FAO則是影響TAMs功能的「命門」[4],其減弱也會使TAMs內的遊離脂肪酸(FFAs)顯著增多。
而在增多的FFAs中,對NOD1啟用調控CD8+T細胞最重要的是棕櫚酸,它是表觀遺傳修飾中「棕櫚酰化修飾」的主角,受影響的蛋白質之一就是共刺激分子OX40L: 在被棕櫚酰化修飾增強疏水性後,OX40L就更易出現在TAMs的膜表面 ,這正是TAMs轉變為免疫刺激表型、更好地啟用CD8+T細胞的底層機制。
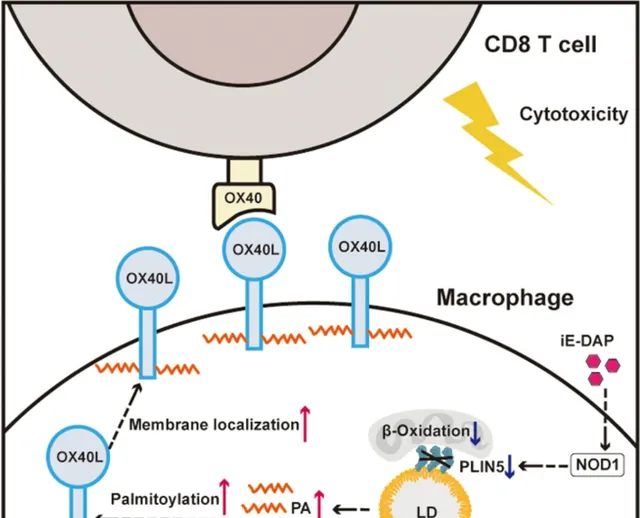
NOD1啟用下調FAO,轉變TAMs功能表型的具體機制
因此顯而易見,啟用NOD1能夠在小鼠實驗中與PD-1抑制劑治療實作協同增效,微環境記憶體在更多NOD1+TAMs也是HCC患者接受免疫應答的利好訊息,但要把這次研究的發現成功向臨床轉化,科研工作者們就得找到只精準開啟TAMs表面NOD1開關的辦法,加油努力吧~

參考文獻:[1]Zhang F, Jiang Q, Cai J, et al. Activation of NOD1 on tumor-associated macrophages augments CD8+ T cell–mediated antitumor immunity in hepatocellular carcinoma[J]. Science Advances, 10(40): eadp8266.
[2] Chen G, Shaw M H, Kim Y G, et al. NOD-like receptors: role in innate immunity and inflammatory disease[J]. Annual Review of Pathology: Mechanisms of Disease, 2009, 4(1): 365-398.
[3] Zhou Y, Hu L, Tang W, et al. Hepatic NOD2 promotes hepatocarcinogenesis via a RIP2-mediated proinflammatory response and a novel nuclear autophagy-mediated DNA damage mechanism[J]. Journal of Hematology & Oncology, 2021, 14: 9.
[4] Su P, Wang Q, Bi E, et al. Enhanced lipid accumulation and metabolism are required for the differentiation and activation of tumor-associated macrophages[J]. Cancer Research, 2020, 80(7): 1438-1450.

本文作者丨譚碩











