*僅供醫學專業人士閱讀參考


腦脊液對清除大腦廢物、保護大腦結構至關重要,腦脊液由側腦室脈絡叢產生,分泌到腦室和蛛網膜下腔,在大腦和脊髓內部、周圍迴圈,每天3-5次[1]。在衰老過程中,腦脊液的分泌和/或清除減少可能與艾爾茨海默病等神經退行性疾病有關[2-4]。
腦脊液從蛛網膜下腔排出的已知途徑主要包括篩狀板中的淋巴管,篩狀板位於鼻腔頂部,分隔大腦和鼻腔,充滿小孔,硬腦膜中的淋巴管也可作為腦脊液的排出途徑。
早在1875年,一項裏程碑研究利用示蹤劑,在鼻腔和腭黏膜的淋巴管中發現了從蛛網膜下腔註射的液體,為腦脊液從蛛網膜下腔排出至鼻咽提供了證據[5]。此後的大量研究也透過MRI等不同的方式驗證了這一途徑[6]。
盡管如此,由於顱底和頸部區域的淋巴管結構非常復雜,在正常情況下和衰老過程中,淋巴管與腦脊液排出有關的連線和功能特征還不是很清楚。
在今天的【自然】雜誌上,美國密蘇裏大學和南韓基礎科學研究所的研究人員聯合發表了一項新的研究[7],他們利用可以產生淋巴報告基因的基因改造小鼠和顯微外科手術技術,揭示了 鼻咽部獨特的淋巴叢,是腦脊液從篩狀板淋巴管排出至頸深淋巴結的主要樞紐。
在衰老過程中,這簇鼻咽淋巴叢也會發生萎縮,出現功能障礙,但頸深淋巴管則沒有相應的變化。透過藥物啟用頸深淋巴轉運能夠增加腦脊液排出,為神經退行性疾病等年齡相關神經系統疾病提供一種增強腦脊液清除的潛在治療方法。

研究人員給小鼠轉入了prospero相關同源盒1-綠色熒光蛋白( Prox1-GFP )基因,對麻醉後的小鼠進行手術,暴露出鼻咽部和其他頸部淋巴管,再對腦脊液排出進行熒光顯微成像。
透過這種方式,研究人員發現, 小鼠鼻咽粘膜中的淋巴管形成獨特的鼻咽淋巴叢(NPLP) ,與後鼻淋巴從相連,二者覆蓋了除顱底外的所有後鼻腔和鼻咽附近表面組織。NPLP有45-65個不規則的線形瓣膜,沒有明顯的平滑肌覆蓋,NPLP的三維形狀與倒置的馬鞍相似。 在食蟹猴的鼻咽部也發現了類似的淋巴叢 ,不過它們的瓣膜呈典型的半月形。
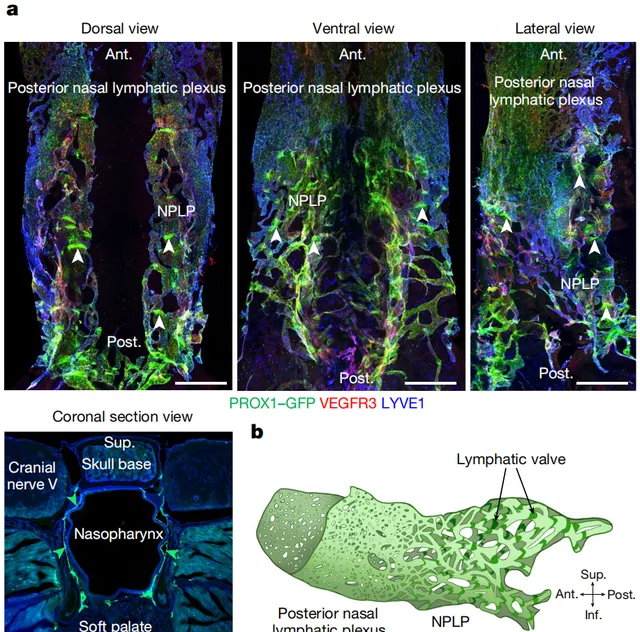
不同視角的NPLP(a)和NPLP的三維重建形狀(b)
研究人員在小鼠蛛網膜下腔中輸註液體,使用熒光立體顯微鏡進行追蹤,輸註後30分鐘, 依次在鼻咽淋巴管、頸深淋巴管和頸深淋巴結中檢測到了熒光 ,而在口咽和軟腭淋巴管中沒有檢測到,直觀展示了 腦脊液進入鼻咽淋巴管,透過頸深淋巴管,流入頸深淋巴結的排出途徑,這種流向主要集中在頸內側淋巴管,而非外側。
隨著年齡的增長,血管和淋巴管都可能發生改變。與8-12周齡的年輕小鼠相比, 73-102周齡的年老小鼠的NPLP和排出的腦脊液明顯減少,內皮細胞呈現多種異常特征,磷酸化tau和雕亡細胞的數量都高出好幾倍,但是淋巴瓣膜、平滑肌細胞覆蓋率、頸內側淋巴管的長度和直徑都沒有顯著變化。
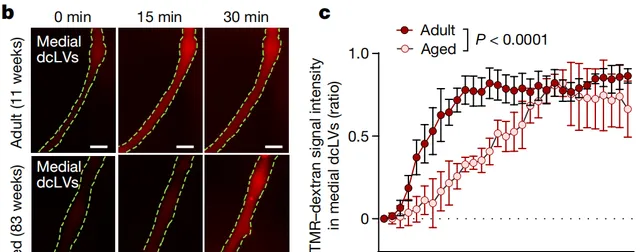
年輕(紅)和年老(粉)小鼠的腦脊液排出情況
轉錄組分析顯示, 年老小鼠的NPLP內皮細胞中與炎癥和I型幹擾素(IFN-1)反應、白血球雕亡和趨化性調節有關的基因富集,抗雕亡基因減少。
研究人員嘗試透過抗體阻斷幹擾素受體訊號傳導,持續6周後,盡管鼻咽組織中幹擾素刺激基因的表達顯著降低,但NPLP和腦脊液排出沒有發生顯著變化,可能還需要更長時間的幹預才能發揮效果。
不過,研究人員換了個思路,他們選擇了兩種藥物,苯腎上腺素(促進平滑肌收縮)和硝普鈉(誘導肌肉松弛和血管擴張)刺激頸深淋巴管,高濃度的苯腎上腺素(5mM)可以使淋巴管收縮,頸深淋巴結中的熒光減少44%,硝普鈉(3μM)則可以使淋巴管擴張,熒光增加33%,然而,低濃度的苯腎上腺素(10nM)使頸深淋巴結中的熒光增加了51%,甚至超過了硝普鈉。雖然劑量還需要探索,但總的來說, 針對頸深淋巴管平滑肌的藥物幹預可以有效增加腦脊液的排出。
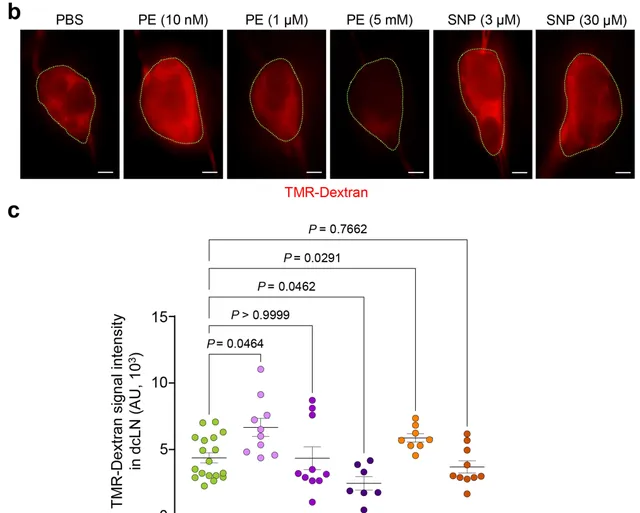
註射不同濃度的苯腎上腺素和硝普鈉後,頸深淋巴結中的熒光
基於這些發現,研究人員確認了腦脊液排出所經的鼻咽淋巴管的身份,對它們的形態、特征進行了表征,並且揭示了它們隨衰老發生的變化,給出了促進腦脊液排出的可行方法。
研究人員計劃未來在猴和人類中驗證他們的發現,希望能夠建立可靠的動物模型,研究是否能夠使用藥物或機械方式刺激頸部淋巴管,透過改善腦脊液清除,阻止艾爾茨海默病的進展[8]。
參考文獻:
[1] Wichmann T O, Damkier H H, Pedersen M. A brief overview of the cerebrospinal fluid system and its implications for brain and spinal cord diseases[J]. Frontiers in Human Neuroscience, 2022, 15: 737217.
[2] Tarasoff-Conway J M, Carare R O, Osorio R S, et al. Clearance systems in the brain—implications for Alzheimer disease[J]. Nature reviews neurology, 2015, 11(8): 457-470.
[3] Da Mesquita S, Louveau A, Vaccari A, et al. Functional aspects of meningeal lymphatics in ageing and Alzheimer’s disease[J]. Nature, 2018, 560(7717): 185-191.
[4] Louveau A, Herz J, Alme M N, et al. CNS lymphatic drainage and neuroinflammation are regulated by meningeal lymphatic vasculature[J]. Nature neuroscience, 2018, 21(10): 1380-1391.
[5] Key A. Studien in der Anatomie des Nervensystems und des Bindegewebes: 1. Hälfte[M]. Samson & Wallin, 1875.
[6] Decker Y, Krämer J, Xin L, et al. Magnetic resonance imaging of cerebrospinal fluid outflow after low-rate lateral ventricle infusion in mice[J]. JCI Insight, 2022, 7(3).
[7] Yoon, JH., Jin, H., Kim, H.J. et al. Nasopharyngeal lymphatic plexus is a hub for cerebrospinal fluid drainage. Nature (2024). https://doi.org/10.1038/s41586-023-06899-4
[8] https://www.nature.com/articles/d41586-023-03839-0
本文作者丨應雨妍











