
馬克思·普朗克煤炭研究所Benjamin List教授和北海道大學Nobuya Tsuji教授等在Science上報道題為「Catalytic asymmetric fragmentation of cyclopropanes」的文章。
作者介紹

德國馬克斯普朗克煤炭研究所所長 本傑明·李斯特(Benjamin List) 教授與美國科學家麥克米倫一起榮獲了2021年諾貝爾化學獎。本傑明·李斯特,1968年1月出生於德國法蘭克福一個富裕的家庭。科學研究的基因或許早就植根於這個家庭中。李斯特的曾曾祖父雅各布·福爾哈德(1834-1910) 是著名的化學家,發現了Volhard–Erdmann環化反應。曾祖父法蘭斯·沃爾哈德以腎病學家的身份而聞名。
本傑明·李斯特教授的研究興趣集中於有機催化與合成,他是不對稱有機催化領域的開創者之一,發展了一種新型不對稱催化模式:手性抗衡陰離子導向的不對稱催化(ACDC)。這意味著在無金屬小分子的幫助下加速化學反應的過程,並將它們選擇性地引導到某些方向。這種方法近年來迅速發展,已經發揮著重要作用,例如使藥物的制造更加環保。而以這種方式獲得的知識也提供了關於某些對生命起源很重要的分子最初是如何形成的線索。
烷烴的立體選擇性轉化一直是化學領域的關鍵挑戰。雖然目前金屬酶催化劑能夠對烷烴的氧化具有優異的表現和選擇性,但是烷烴的化學轉化方法一直局限於過渡金屬催化C-H鍵官能團化。在強Brønsted酸作用下,烷烴能夠質子化生成5配位的碳正離子,隨後分解為更小的烷烴化合物。但是如何控制這個過程進行的立體選擇性仍然沒有方法。有鑒於此, Benjamin List教授和Nobuya Tsuji教授 報道發現限域的強酸能夠以立體選擇性的方式將許多環丙烷化合物切斷,轉化為烯烴化合物。這個方法拓展了烷烴活化的領域,透過理論計算說明這個反應過程有可能包括環丙基陽離子(一種非典型結構碳正離子)。
反應設計和發展
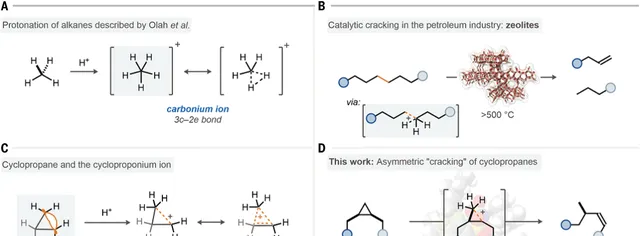
圖1. 反應的研究背景
首先研究雙環[3,1,0]己烷( 1a )的3-取代反應。作者設計分子不對稱加氫的反應進行去對稱化,隨後脫質子和異構反應生成烯烴。當使用比較弱的Brønsted酸作為催化劑(磷酸、IDP(亞胺二磷酸鹽,imidodiphosphoric acid)、iIDP(空間限域亞胺二膦酸鹽)),只能得到非常差的環丙烷反應活性。但是,亞胺基二磷酰亞胺酯IPDi(imidodiphosphorimidates) 7a 具有良好的反應性,能夠生成 2a - 6a 烯烴混合物。其中主要的產物是三個取代基修飾的烯烴 2a 和 3a ,產物主要為消旋形式,另外含有少量其他產物( 4a, 5a, 6a )。
催化劑的設計與最佳化。作者發現除了立體位阻作用,增強催化劑和反應物之間的非共價相互作用對控制反應的位點選擇性和立體選擇性非常重要。作者提出BINOL(1,1′-雙-2-萘醇)的3,3′位點取代基能夠形成催化微環境,氮原子上的取代基決定了陰離子的堿性,實作了控制與反應物之間的靜電相互作用。因此,IDPi催化劑 7b,(BINOL取代基-叔丁基結構,增強立體位阻和靜電相互作用),對生成2a-5a 具有更高的區域選擇性和立體選擇性。透過將催化位點的三氟甲磺酰基替換為芳基磺酰基,增強催化位點的堿性,並且透過π-π堆疊作用提高構象的剛性,催化劑IDPi 7c 得到更好的位點選擇性和立體選擇性。
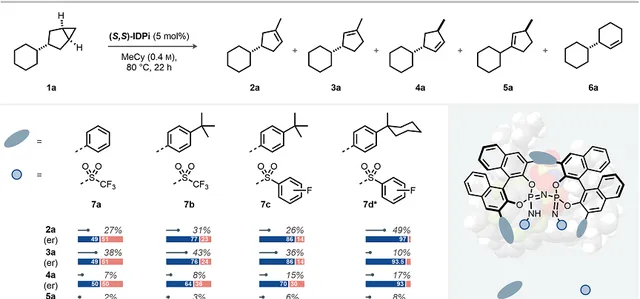
圖2. 催化劑和反應條件最佳化
反應效果。之後再次對催化劑和反應條件進行最佳化,發現IDPi 7d 具有最好的催化反應效果,得到令人滿意的產率和立體選擇性,最佳化了反應溫度和反應時間之後,能夠以40 %的產率和97:3的立體選擇性生成環戊烯產物 2a 。另外還有少量 3a , 4a , 5a 生成,產率分別為6%,13%,7%,而且都具有優異的立體選擇性。此外發現適中的立體選擇性生成少量 6a 。
反應相容
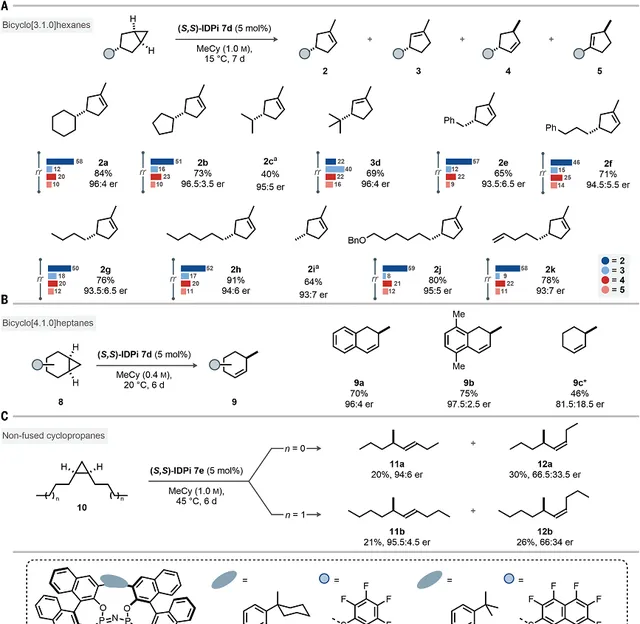
圖3. 反應物相容
研究反應的相容性。
二級烷基取代基。反應對環烷( 2a 和 2b )和非環烷( 2c )二級烷基取代基相容,另外對立體擁擠的三級取代基相容,能夠以優異產率和立體選擇性生成 3d 。
一級烷基取代基。反應對一系列一級烷基取代基修飾的反應物,包括芐基( 2e )、3-苯基丙基( 2f )、丁基( 2g )、己基( 2h )都能夠相容並且獲得優異的立體選擇性。生成的烯烴 3e 能夠透過氧化反應生成醛。令人意外的是,對於較小的甲基取代基,反應仍能夠以64%的收率和93:7的立體選擇性生成對應的 2i 產物。 這個結果說明IDPi催化劑對於控制尺寸較小的簡單結構烷烴的優異效果。 反應對於芐氧基( 2j )或者端基烯烴( 2k )取代基的烷烴同樣得到優異的產率和立體選擇性,說明該反應的優異官能團耐受性。生成的產物能夠透過加氫、Ritter反應、傅-克烷基化反應、甲基化-加氫反應生成其他功能型化合物。這些轉化過程不會消耗分子的立體選擇性。這個反應能夠用於雙環[4,1,0]庚烷( 8 )的轉化。由於催化劑對芐基碳正離子具有穩定作用,因此對於芐氧基環己烯( 9a 和 9b )能夠獲得高產率和優異的立體選擇性。對於結構特別簡單的雙環[4,1,0]庚烷,能夠以有價值的產率和立體選擇性生成環己烯 9c 。
該反應甚至能夠對非稠環化的環丙烷化合物( 10 )進行立體選擇性轉化,該反應化合物具有的柔性是導致其轉化面臨挑戰性的原因。這個反應方法能夠在更高的溫度下進行1,2-雙丙烷-環丙烷( 10a )的轉化,以適中的產量生成雙官能團取代的手性烯烴分子( 11a , 12a )。該反應同樣相容1,2-雙丁基環丙烷( 10b )。
機理研究
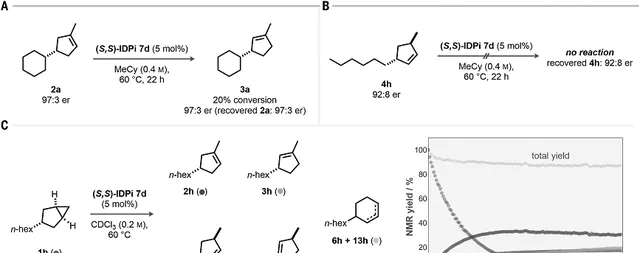
圖4. 反應機理研究
控制實驗。反應機理的一個問題是反應立體選擇性產生的原因來自「不對稱質子化」還是「產物的動力學拆分」。對 2a 在60℃使用催化劑 7d 處理,發現20%的 2a 異構化生成 3a,但是2a 和 3a 的立體結構比例並沒有改變。而且,反應生成的 3a 的對映體比例低於 2a ,說明 2a 的異構不可能是生成 3a 的主要步驟。透過烯烴4h的反應情況同樣驗證催化反應不是異構化過程。透過時間分辨 1 H NMR研究,發現在60℃進行反應,1天內產物 4h , 5h , 6h , 13h 達到最大值並且不再增加,但是 3h 烯烴仍不斷增加, 2h 不斷消耗。
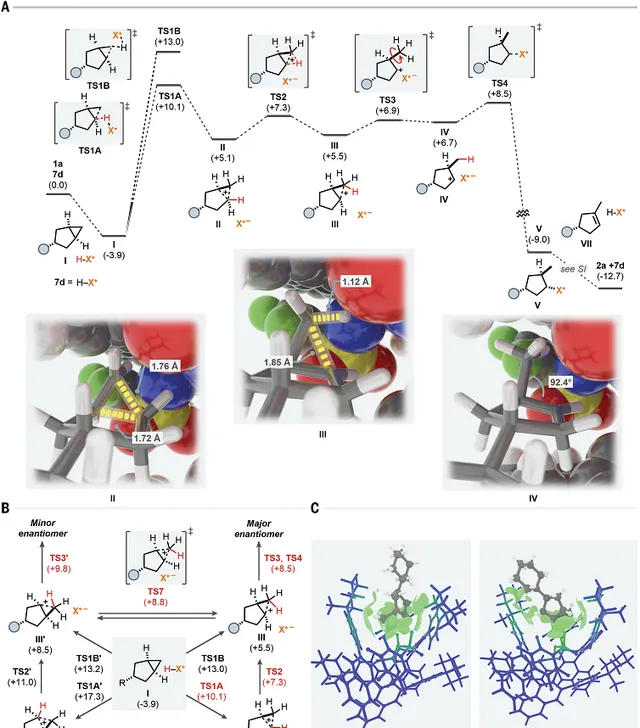
圖5. 理論電腦理研究
DFT理論計算。透過DFT理論計算研究 7d 催化劑和 1a 的反應路線和反應機理。首先,反應物進入IDPi催化劑的內部,形成 I 復合物。隨後IDPi催化劑對催化劑內的反應物質子化。質子化生成碳正離子 II 或者非典型的碳正離子 III ,透過立體選擇性的質子化,分別還可能生成 II′ 或 III′ 。而且中間體 II 或 II′ 能夠透過1,3-H原子轉移生成 III 或 III′ 。但是步驟具有不同的能壘。生成 III 中間體之後,甲基旋轉( TS3 )導致產生二級碳正離子 IV ,隨後環翻轉與IDPi催化劑自發形成共價鍵的加合物 V ;生成 III′ 中間體後,甲基旋轉,隨後透過 TS3′ 生成加合物 V′ ,生成次要立體結構的產物。能量計算發現 TS4 和 TS3′ 之間的能量差為1.3kcal/mol,這個計算的結果與實驗結果符合(1.7kcal/mol, 298.15K)。反應中生成的其他產物可能透過中間體的重排和脫質子化過程生成。
非共價相互作用的作用。透過IGMH方法研究非共價相互作用對立體選擇性的作用(Multiwfn軟件,一款國產軟件)。發現反應物能夠很好的穩定在 7d 催化劑的 TS4 過渡態,同時取代基在口袋外部。但是, TS3′ 過渡態導致口袋被反應物撐開。計算結果明確展示了反應物和BINOL之間的強vdW相互作用。對質子化步驟 TS1A 、 TS1B 、 TS1A′ 、 TS1B′ 進行計算,發現催化劑的變形和相互作用對於控制反應選擇性非常重要。
參考文獻及原文連結
Ravindra Krushnaji Raut, Satoshi Matsutani, Fuxing Shi, Shuta Kataoka, Margareta Poje, Benjamin Mitschke, Satoshi Maeda, Nobuya Tsuji*, Benjamin List*, Catalytic asymmetric fragmentation of cyclopropanes, Science 386, 225–230 (2024)
DOI: 10.1126/science.adp9061
https://www.science.org/doi/10.1126/science.adp9061











