癌癥新型靶點:WRN
WRN是一種具有多種酶活性的多功能的DNA解螺旋酶。WRN表現有DNA依賴的ATP酶活性,ATP依賴的3’→5’DNA解螺旋酶活性,單鏈DNA退火活性,核酸外切酶活性。
01
Rec Q解螺旋酶概述
解螺旋酶是自然界中一類開啟核酸鏈之間氫鍵的酶,在生物體中發揮多種重要的功能。RecQ解螺旋酶是自然界的第二大類解螺旋酶,廣泛分布在從細菌到人類等眾多生物之中,其在生物體DNA代謝、維持基因組穩定過程中發揮著重要的作用。Werner症候群蛋白是RecQ解螺旋酶的一種。在人體中有5種RecQ解螺旋酶,分別是RecQ1、BLM(RecQ2)、WRN(RecQ3)、RecQ4、RecQ5。
RecQ解旋酶屬於SF2家族解旋酶,前進演化過程中從原核到真核生物都是高度保守的,在基因組穩定性的維持中發揮重要功能。
RecQ解旋酶包含三個保守的結構域:如圖1所示,RecQ解旋酶獨有的Helicase結構域和RecQ羧基末端結構域(RQC),以及解旋酶和核糖核酸DC-末端結構域(HRDC),這個結構域也存在於其他DNA結合蛋白中。除了人類的三個RecQ解旋酶RecQ1、RecQ4和RecQ5,大腸桿菌RecQ三個結構域在其他物種的RecQ同源物中也是保守的。Helicase結構域和RQC結構域形成大腸桿菌RecQ 59kDa的催化核心,在體外該片段可以催化單鏈DNA(ssDNA)結合並具有3'→5'解旋酶活性,與全長大腸桿菌RecQ的解旋活性基本相同。
其中BLM、WRN、RecQ4功能缺失分別會導致常染色體隱性遺傳病布魯姆症候群(Bloom syndrome,BS),沃納症候群症候群(Werner syndrome,WS)以及羅斯蒙德-湯姆森症候群(Rothmund-Thomson syndrome,RTS)。這個核心片段的晶體具有四個不同子體的單體:Helicase結構域由兩個N末端RecA樣亞結構域組成,其中ATP和ssDNA結合位點夾在它們之間,並行揮解旋酶的「馬達」功能。解旋酶活性對於體內RecQ解旋酶功能至關重要,並且該結構域中的點突變導致釀酒酵母,小鼠和人類的解旋酶活性鈍化。對RQC作用巨大的C端結構域催化核心由Zn2+結合亞結構域和β-發夾螺旋-螺旋(WH)亞結構域組成,它們一起構成dsDNA結合結構域。
在大腸桿菌RecQ中取代Zn2+配位的半胱胺酸殘基揭示了Zn2+結合域對穩定DNA結合和蛋白質穩定性是必需的。在BLM和RecQ5中Zn2+配位半胱胺酸的突變產生類似的結果,這表明該功能在前進演化上是保守的。
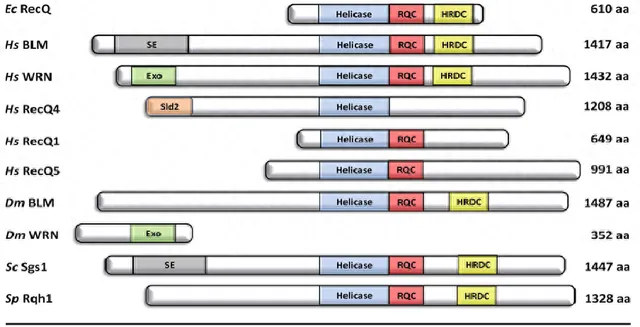
圖1 Rec Q解旋酶家族的結構特點
02
Werner症候群
Werner症候群由德國的Werner博士1904年首先報道,又名成人早老癥。是一種由於染色體8p11-12發生退行性突變而導致的常染色體隱性遺傳性疾病,多見於近親結婚的子代,以堂兄妹間結婚者的子代居多。
臨床表現為包括早衰和各種與早衰相關的繼發性癥狀,包括雙眼白內障,皮膚萎縮,身材矮小,頭發灰白稀疏。此外患者常會發生II型糖尿病,骨質疏松,動脈粥樣硬化和腫瘤。WS患者平均死亡年齡在46-54周歲,其中最主要的死因是惡性腫瘤和心肌梗死。
Werner症候群無治愈方法,主要以對癥治療為主。手術治療白內障,預防皮膚潰瘍,使用降糖藥物治療糖尿病,補充性激素等。
03
WRN基因序列
WRN基因定位在8號染色體8p12,WRN基因基因序列如下:
MSEKKLETTAQQRKCPEWMNVQNKRCAVEERKACVRKSVFEDDLPFLEFTGSIVYSYDASDCSFLSEDISMSLSDGDVVGFDMEWPPLYNRGKLGKVALIQLCVSESKCYLFHVSSMSVFPQGLKMLLENKAVKKAGVGIEGDQWKLLRDFDIKLKNFVELTDVANKKLKCTETWSLNSLVKHLLGKQLLKDKSIRCSNWSKFPLTEDQKLYAATDAYAGFIIYRNLEILDDTVQRFAINKEEEILLSDMNKQLTSISEEVMDLAKHLPHAFSKLENPRRVSILLKDISENLYSLRRMIIGSTNIETELRPSNNLNLLSFEDSTTGGVQQKQIREHEVLIHVEDETWDPTLDHLAKHDGEDVLGNKVERKEDGFEDGVEDNKLKENMERACLMSLDITEHELQILEQQSQEEYLSDIAYKSTEHLSPNDNENDTSYVIESDEDLEMEMLKHLSPNDNENDTSYVIESDEDLEMEMLKSLENLNSGTVEPTHSKCLKMERNLGLPTKEEEEDDENEANEGEEDDDKDFLWPAPNEEQVTCLKMYFGHSSFKPVQWKVIHSVLEERRDNVAVMATGYGKSLCFQYPPVYVGKIGLVISPLISLMEDQVLQLKMSNIPACFLGSAQSENVLTDIKLGKYRIVYVTPEYCSGNMGLLQQLEADIGITLIAVDEAHCISEWGHDFRDSFRKLGSLKTALPMVPIVALTATASSSIREDIVRCLNLRNPQITCTGFDRPNLYLEVRRKTGNILQDLQPFLVKTSSHWEFEGPTIIYCPSRKMTQQVTGELRKLNLSCGTYHAGMSFSTRKDIHHRFVRDEIQCVIATIAFGMGINKADIRQVIHYGAPKDMESYYQEIGRAGRDGLQSSCHVLWAPADINLNRHLLTEIRNEKFRLYKLKMMAKMEKYLHSSRCRRQIILSHFEDKQVQKASLGIMGTEKCCDNCRSRLDHCYSMDDSEDTSWDFGPQAFKLLSAVDILGEKFGIGLPILFLRGSNSQRLADQYRRHSLFGTGKDQTESWWKAFSRQLITEGFLVEVSRYNKFMKICALTKKGRNWLHKANTESQSLILQANEELCPKKLLLPSSKTVSSGTKEHCYNQVPVELSTEKKSNLEKLYSYKPCDKISSGSNISKKSIMVQSPEKAYSSSQPVISAQEQETQIVLYGKLVEARQKHANKMDVPPAILATNKILVDMAKMRPTTVENVKRIDGVSEGKAAMLAPLLEVIKHFCQTNSVQTDLFSSTKPQEEQKTSLVAKNKICTLSQSMAITYSLFQEKKMPLKSIAESRILPLMTIGMHLSQAVKAGCPLDLERAGLTPEVQKIIADVIRNPPVNSDMSKISLIRMLVPENIDTYLIHMAIEILKHGPDSGLQPSCDVNKRRCFPGSEEICSSSKRSKEEVGINTETSSAERKRRLPVWFAKGSDTSKKLMDKTKRGGLFS
04
WRN基因結構
WRN基因跨度超過250 kb,35個外顯子,其中34個為編碼外顯子。編碼由1432個胺基酸殘基組成、分子質素為160 kD的WRN蛋白(WRNp)。從N端到C端主要分成5部份:核酸外切酶結構域、解螺旋酶(或ATP酶)結構域、RecQ碳末端(RecQ C-terminal,RQC)結構域、解螺旋酶核糖核酸酶D碳末端(helicase-and-ribonucleaseD/Cterminal,HRDC)結構域、核定位訊號(nuclear localization signal,NLS)。其中,ATPase結構域和RQC結構域是WRN發揮解旋酶功能的核心。
另外,WRN是其家族成員中唯一擁有核酸外切酶結構域的RecQ蛋白,具有核酸外切酶活性。WRN解旋酶和核酸外切酶結構域既獨立又相互協同,以分解多種DNA受質,例如雙鏈DNA、D環、復制叉和氣泡結構、G-四鏈體、Holliday連線、DNA flaps等。

圖2 人WRN結構圖
05
WRN生物學功能
WRN是一種既可以和DNA結合又可以和其他蛋白質結合的多功能的DNA解螺旋酶,在生物體中發揮多種生物學功能。WRN在DNA復制、DNA重組、DNA損傷修復、基因轉錄、維持端粒穩定、維持異染色質穩定等生物學過程中發揮重要的作用。
常見的DNA損傷有堿基受到氧化、脫胺基、甲基化等化學修飾而發生改變導致的堿基替換、錯配、跨鏈連線和DNA斷裂等。WRN與polδ、polβ、APE1、PARP1等多個參與BER的蛋白在功能上具有相互作用。WRN解旋酶活效能夠刺激polβ介導的DNA鏈置換合成,WRN核酸外切酶和解旋酶活性則可以與polβ協同作用處理3錯配。
在DNA雙鏈斷裂(double-strand break,DSB)修復中,WRN透過經典的非同源末端連(canonic
non-homologous end-joining,c-NHEJ)修復和HRR發揮作用。c-NHEJ介導的DSB修復在細胞周期中占主導地位。KU70/80異二聚體和DNA-PK形成穩定的復合物,並啟動DSB修復;KU70/80異二聚體的直接相互作用可刺激WRN的核酸外切酶活性,有助於處理DSB末端。
當KU70/80缺陷時,DSB修復從c-NHEJ切換為替代型NHEJ(alternative NHEJ,alt-NHEJ)。在alt-NHEJ修復中,DSB末端被PARP和MRE11辨識,隨後MRE11/RAD50/NBS1(MRN)復合物和CtIP透過切除處理斷裂末端。值得註意的是,當WRN被招募到DSB時,它會抑制MRE11和CtIP的招募,並保護斷裂的DNA免受5端切除,抑制alt-NHEJ。
HRR由MRN復合物透過MRE11的核酸內切酶和3–5核酸外切酶活性與CtIP啟動。細胞週期素依賴性激酶1可磷酸化WRN的絲胺酸1133位點,調節DSB處的MRE11募集來切換HRR和NHEJ。WRN可與DNA復制解旋酶/核酸酶2發生相互作用,促進RPA依賴的DNA末端加工和切除。另外,BRCA1還直接與WRN相互作用並刺激WRN的解旋酶和核酸外切酶活性,促進DNA末端切除。
R環(R-loop)是轉錄相關基因組不穩定性的主要來源。R環會破壞S期的復制叉行程,導致DNA復制叉的破壞、發生DSB或進入有絲分裂前的不完整復制。研究表明,WRN在限制R環相關基因組不穩定性中發揮了重要作用。ATR激酶是參與辨識和穩定停滯復制叉的主要激酶WRN和ATR通路之間存在相互作用;在復制壓力下,ATR依賴的WRN磷酸化,充當CHK1啟用的介質,促進復制的恢復和防止在停滯的分叉處形成DSB。同時,WRN解旋酶活性對於保護DNA脆弱位點免於斷裂至關重要。

圖3 WRN蛋白結構域和生物學功能
a−WRN解旋酶的蛋白結構域;b−WRN解旋酶在堿基切除修復長修補程式修復途徑中的調節作用,WRN辨識polβ-DNA復合物並刺激polβ-DNA鏈置換合成;c−WRN解旋酶在雙鏈斷裂修復途徑—NHEJ修復中的作用,c-NHEJ是主要的雙鏈斷裂修復通路,用粗箭頭表示,WRN透過抑制MRE11和CtIP 的募集來促進c-NHEJ並抑制alt-NHEJ;d−WRN解旋酶在雙鏈斷裂修復途徑—HRR中的作用,WRN與 DNA2、BRCA1發生相互作用,促進DNA末端加工和切除;e−WRN解旋酶在限制R環相關基因組不穩定性中的作用,ATR依賴的WRN磷酸化,可充當CHK1啟用的介質,確保R環及時解決,從而確保基因組穩定性。
06
WRN作為癌癥靶點
微衛星不穩定性(microsatellite instability,MSI)是一種腫瘤細胞中由錯配修復受損或缺陷導致而出現新的微衛星等位基因的現象。MSI可以導致腫瘤細胞基因組進一步紊亂和突變,從而促進惡性腫瘤的發生發展,是公認的重要致癌途徑之一。
DNA MMR缺陷的MSI腫瘤細胞在敲除WRN基因或耗盡WRN蛋白後,會發生合成致死效應,導致細胞死亡。MMR缺陷的合成致死相互作用與其他RECQL解旋酶無關,僅與WRN解旋酶活性相關。當WRN解旋酶活性喪失時,MSI的合成致死作用才被啟用。
隨著WRN可能是MSI惡性腫瘤的合成致死新靶點的發現,基於靶向MSI惡性腫瘤的WRN抑制劑的研究也引起了科研人員和藥物研發人員的興趣。

表1 WRN抑制劑情況
目前處於臨床階段的是Novartis Pharmaceuticals Corp的小分子化藥,HRO761, 用於治療微衛星高度不穩定性結直腸癌,目前處於臨床1期。
END
內容源於網絡,如有侵權,請聯系刪除。











