撰文:丁欣田,陈淳,赵恒,戴彬,叶磊,宋涛,黄帅,王嘉,尤涛
脊髓损伤是中枢神经系统严重的创伤性疾患[1, 2],发病率呈逐年现递增的趋势,但迄今仍缺乏有效的治疗方法[3, 4]。脊髓损伤可分为原发性和继发性损伤两个阶段,其中原发性损伤是不可防治的,而继发性损伤是可防治的。原发性损伤可导致细胞因子的大量释放,引起级联炎症反应,导致脊髓损伤加重。调控继发性炎症,可打破恶性循环,成为治疗脊髓损伤方向之一。PTPN11基因编码的蛋白酪氨酸磷酸酶(Src homology 2-containing protein tyrosine phosphatase 2,SHP2)可通过去磷酸化作用调节多种信号通路的活性,在免疫炎症中参与了多个关键的信号通路[5]。SHP2可介导肿瘤坏死因子和白细胞介素1等,影响炎症反应的发生和发展[6]。SHP2也参与Toll样受体信号通路中炎症介质的产生和炎症反应的调节[7]。但SHP2在脊髓损伤的免疫炎症微环境中的作用尚未见报道。
来自中国科学技术大学附属第一医院尤涛团队在【中国神经再生研究(英文版)】(Neural Regeneration Research)上发表了题为「 Inhibiting SHP2 reduces glycolysis, promotes microglial M1 polarization, and alleviates secondary inflammation following spinal cord injury in a mouse model 」的研究,发现SHP2可通过能量代谢,促进小胶质细胞的糖酵解,介导中枢神经系统常驻免疫细胞-小胶质细胞的亚型,从而调控脊髓损伤的继发性炎症以及神经元损害的病理过程。进一步体内外实验均表明,抑制SHP2可降低脊髓损伤的炎症水平,促进损伤后的运动功能恢复。SHP2的别构抑制剂NSC87877能显著减轻脊髓损伤继发性炎症,有利于脊髓功能的恢复。这一发现提示SHP2介导小胶质细胞亚型转变是调控脊髓继发性炎症的新机制,而抑制SHP2是脊髓损伤治疗新的策略。
小胶质细胞的激活,是脊髓继发性损伤炎症的标志[8, 9],与脊髓损伤的功能恢复密切相关。尤涛等首先发现SHP2与脊髓损伤的病理进程密切相关,且高表达于损伤区域的小胶质细胞中( 图1 );随后证实,以siRNA及SHP2抑制剂抑制SHP2表达可抑制由脂多糖诱导的小胶质细胞炎症( 图2 )。敲低SHP2可抑制脊髓损伤小鼠的炎症水平,且其运动功能恢复得更快( 图3 )。这些证明SHP2可能通过介导小胶质细胞的炎性激活,加重了脊髓损伤损害。
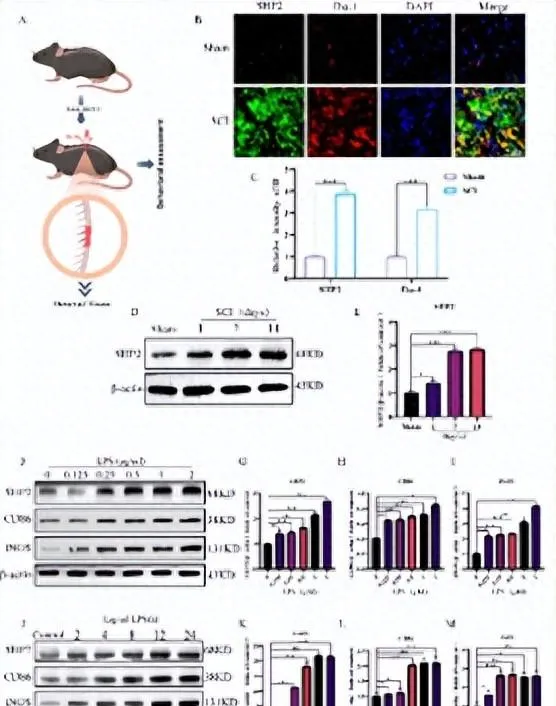
图1 SHP2在小鼠脊髓损伤组织和脂多糖诱导的小胶质细胞中的表达
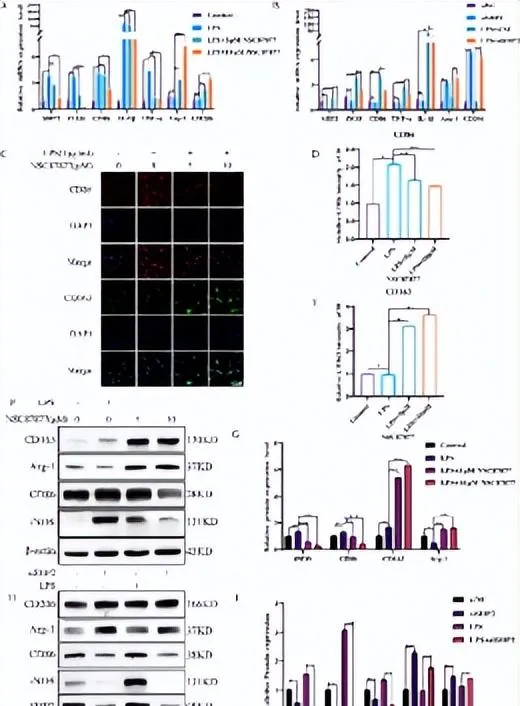
图2下调SHP2可减轻小胶质细胞及巨噬细胞炎症反应
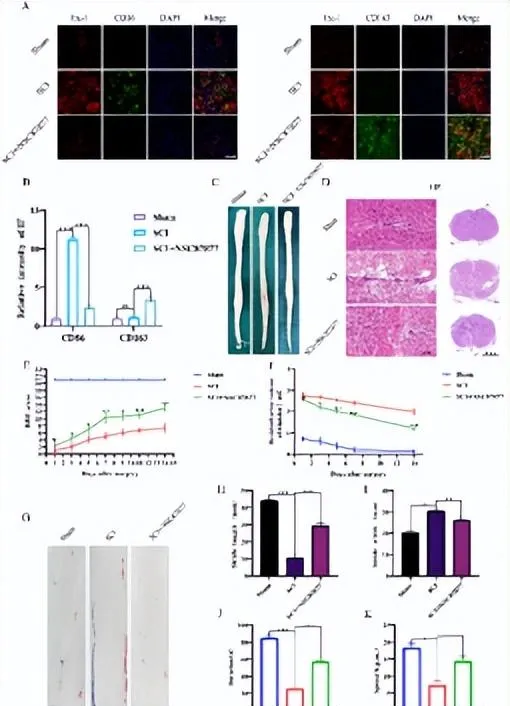
图3 SHP2可调节脊髓损伤后的免疫炎症微环境进而影响脊髓损伤后功能恢复
小胶质细胞的激活在组织损伤修复过程中是一把双刃剑[9, 10]。过度活化的M1型小胶质细胞经常释放大量的促炎介质,进一步加重了对组织细胞的损伤;另一方面,活化的M2型小胶质细胞可吞咽和清除细胞碎片,释放营养因子[11, 12],调节炎症反应有利于损伤修复。体外实验使用SHP2抑制剂后,脂多糖诱导的小胶质细胞的M1表型标记物CD86下降,M2表型标记物CD163升高,说明SHP2的下调能促进小胶质细胞M2型极化,抑制M1型极化( 图4 )。此外,共培养实验评估了SHP2抑制剂处理的小胶质细胞对神经元细胞的影响。结果表明,SHP2抑制剂可减少小胶质细胞炎症引起的神经元凋亡( 图5 )。可见SHP2通过调节小胶质细胞的活化亚型,干预神经元的命运,影响脊髓损伤。
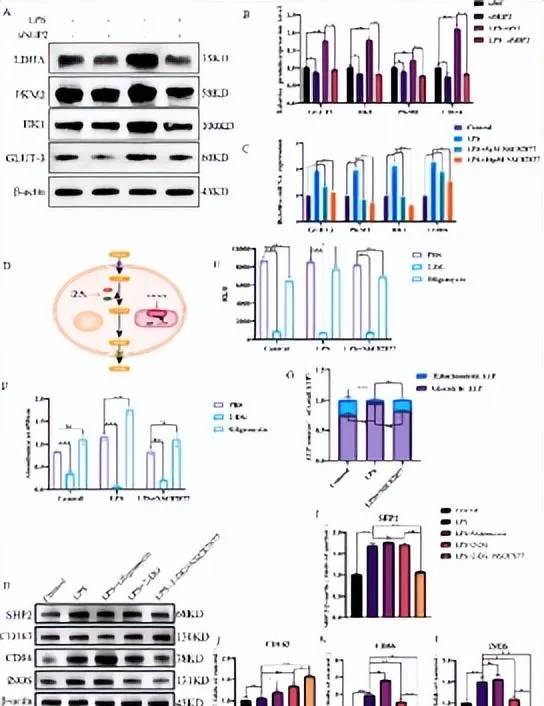
图4 SHP2可通过调控小胶质细胞的糖酵解/氧化磷酸化,介导炎症表型
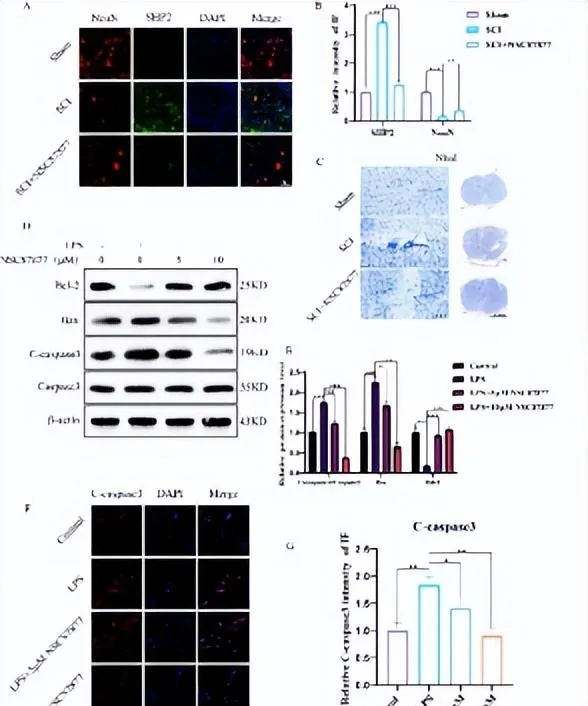
图5 抑制SHP2可通过小胶质细胞间接的减少脊髓损伤神经元的凋亡
小胶质细胞极化与代谢重编程,特别是糖酵解有着错综复杂的联系[13]。与促炎反应相关的小胶质细胞,即使在常氧条件下,也表现出对糖酵解代谢的依赖性增加,这种现象被称为「有氧糖酵解」或「瓦伯格效应(Warburg effect)」。这种糖酵解转移支持ATP的快速产生,并为生物合成途径提供中间体,从而促进M1小胶质细胞的炎症表型。另一方面,与抗炎相关的M2小胶质细胞和组织修复功能相关,主要依赖于氧化磷酸化来满足其能量需求。研究利用糖酵解及氧化磷酸化抑制剂寡霉素、2-脱氧-D-葡萄糖探讨了SHP2对小胶质细胞BV2糖代谢的影响,以及糖代谢对小胶质细胞极化的影响。体外实验验证了小胶质细胞/巨噬细胞M1极化主要是通过糖酵解途径来进行产能,而抑制糖酵解之后,小胶质细胞炎症相关指标下降( 图5 )。这与现在的大多数观点高度一致。下调SHP2后能量代谢的产生开始向氧化磷酸化倾斜,抑制了小胶质细胞的糖酵解,促进了氧化磷酸化,从产生相应的极化亚型。而实验也发现抑制糖酵解和氧化磷酸化的通路并不会对SHP2产生很大的影响,这可能是因为SHP2是能量代谢的上游靶点。
综上所述,SHP2可通过能量代谢,促进糖酵解,介导小胶质细胞的活化亚型,从而调控脊髓损伤后的继发性炎症,以及神经元损害的病理过程。抑制SHP2降低脊髓损伤小鼠的炎症水平,促进损伤后的功能恢复。因此,抑制SHP2可能是一个很有前途的治疗脊髓损伤的新方法,特别是越来越多SHP2别构抑制剂研发的兴起为脊髓损伤的治疗展现美好的前景。
当然,脊髓损伤微环境的变化极其复杂,炎症和细胞相互作用的体外模型显然不能完全模拟脊髓损伤后微环境的变化。SHP2的表达增加可能会引起复杂的负反馈抑制,而负反馈效应会影响SHP2更好地发挥其功能作用。此外,目前SHP2抑制剂仍然处于临床前期阶段,生物毒性、细胞靶向性仍需进一步研究,其应用于脊髓损伤临床治疗还需要更加深入的研究。
原文链接: https://doi.org/10.4103/NRR.NRR-D-23-01925
参考文献
[1] Mothe AJ, Tator CH. Advances in stem cell therapy for spinal cord injury. J Clin Invest. 2012;122(11):3824-3834.
[2] Nakamura M, Okano H. Cell transplantation therapies for spinal cord injury focusing on induced pluripotent stem cells. Cell Res. 2013;23(1):70-80.
[3] Courtine G, Sofroniew MV. Spinal cord repair: advances in biology and technology. Nat Med. 2019;25(6):898-908.
[4] Hutson TH, Di Giovanni S. The translational landscape in spinal cord injury: focus on neuroplasticity and regeneration. Nat Rev Neurol. 2019;15(12):732-745.
[5] Song Z, Wang M, Ge Y, et al. Tyrosine phosphatase SHP2 inhibitors in tumor-targeted therapies. Acta Pharm Sin B. 2021;11(1):13-29.
[6] Howard CJ, Hope JC, Stephens SA, et al. Co-stimulation and modulation of the ensuing immune response. Vet Immunol Immunopathol. 2002;87(3-4):123-130.
[7] O'neill LA. When signaling pathways collide: positive and negative regulation of toll-like receptor signal transduction. Immunity. 2008;29(1):12-20.
[8] Cowan M, Petri WA, Jr. Microglia: immune regulators of neurodevelopment. Front Immunol. 2018;9:2576.
[9] Devanney NA, Stewart AN, Gensel JC. Microglia and macrophage metabolism in CNS injury and disease: The role of immunometabolism in neurodegeneration and neurotrauma. Exp Neurol. 2020;329:113310.
[10] Hu X, Leak RK, Shi Y, et al. Microglial and macrophage polarization—new prospects for brain repair. Nat Rev Neurol. 2015;11(1):56-64.
[11] Gensel JC, Nakamura S, Guan Z, et al. Macrophages promote axon regeneration with concurrent neurotoxicity. J Neurosci. 2009;29(12):3956-3968.
[12] Lourbopoulos A, Ertürk A, Hellal F. Microglia in action: how aging and injury can change the brain's guardians. Front Cell Neurosci. 2015;9:54.
[13] Yu H, Chang Q, Sun T, et al. Metabolic reprogramming and polarization of microglia in Parkinson's disease: Role of inflammasome and iron. Ageing Res Rev. 2023;90:102032.
文章摘要: 减轻继发性炎症反应是治疗脊髓损伤方向之一,而小胶质细胞可参与继发性炎症反应。PTPN11基因编码的蛋白酪氨酸磷酸酶(SHP2)在体内中广泛表达,并通过多种机制参与炎症反应,因而被认为是治疗炎症相关疾病的潜在靶点,但其在脊髓损伤继发性炎症反应中的作用尚未见报道。此次实验发现SHP2可在脊髓损伤部位小胶质细胞中大量表达。在脂多糖诱导的小胶质细胞炎症模型中,以siRNA及SHP2抑制剂抑制SHP2表达可减轻小胶质细胞的炎症反应。值得注意的是,SHP2抑制剂治疗的脊髓损伤小鼠,其后肢功能显著改善且膀胱残余尿量减少。而后在体外实验中,在脂多糖诱导小胶质细胞中,以SHP2抑制剂抑制SHP2表达,可促进小胶质细胞M2型极化,抑制M1型极化。最后以共培养实验评估了SHP2抑制剂处理的小胶质细胞对神经元细胞的影响,结果显示,小胶质细胞产生的炎症因子可导致神经元凋亡,而抑制SHP2表达可减轻上述影响。总之,SHP2可通过介导小胶质细胞的活化亚型,调控脊髓损伤后的继发性炎症以及神经元损害的病理过程。而抑制SHP2可减轻脊髓损伤小鼠的炎症反应,促进损伤后的功能恢复。
文章关键词: 脊髓损伤;糖酵解;SHP2;小胶质细胞;极化;炎症反应;神经元;细胞凋亡
文章来源: Ding X, Chen C, Zhao H, Dai B, Ye L, Song T, Huang S, Wang J, You T (2025) Inhibiting SHP2 reduces glycolysis, promotes microglial M1 polarization, and alleviates secondary inflammation following spinal cord injury in a mouse model. Neural Regen Res 20(3):858-872.











