
2024年8月23日,王磊团队在【科学】发文「Mechanisms of minor pole-mediated spindle bipolarization in human oocytes」。 本文图片 复旦上医供图
全球不孕不育率持续上升,如今已接近15%-20%,成为仅次于癌症、心脑血管疾病的人类第三大健康问题。从细胞生物学与遗传学角度出发,复旦大学生物医学研究院王磊、桑庆、武田宇团队联合上海交通大学附属国际和平妇幼保健院李文团队的最新研究成果揭示了人类卵母细胞纺锤体双极化机制,为生殖障碍疾病的研究与治疗,提供了重要的解释视角与理论支持。
2024年8月23日,相关成果以「Mechanisms of minor pole-mediated spindle bipolarization in human oocytes」为题,发表在最新一期的【科学】(Science)杂志上。这也是复旦大学上海医学院王磊团队在人卵发育的生理与病理机制研究上取得的又一重大突破。
该研究发现,人卵纺锤体微管聚合启动后,会经历一段较长时间的 「多极纺锤体」(Multipolar spindle)阶段,而后才形成双极状纺锤体,同时发现了调控纺锤体双极化的关键蛋白,并在临床多个卵子和胚胎发育异常患者中鉴定到编码这些关键蛋白的基因存在突变,从而揭示了人卵纺锤体双极化的独特生理病理机制。
研究图示。
全球有6000万-8000万对夫妇面临不孕之苦,有数百万人进行试管婴儿治疗,但临床中时常遇到卵子、授精及胚胎发育异常的情况,人们对这些异常背后的原因及机制所知甚少。
王磊十多年前提出研究假设:遗传因素可能是导致人卵成熟与发育异常的重要原因之一。2016年,王磊/桑庆团队发现人类卵子成熟障碍的第一个致病基因——灵长类特异β-微管蛋白TUBB8,从而明确了此疾病为人类新遗传病。该基因可解释约30%卵母细胞成熟障碍患者,如今已广泛应用于临床检测。继TUBB8之后,团队又陆续发现24个人类卵子成熟障碍的致病基因并明确了机制。
研究团队认为,纺锤体的存在及其正常与否,直接决定了卵子是否能够正常成熟与受精。作为人卵纺锤体的主要组成部分,灵长类特异基因TUBB8的发现,标志着人类卵子成熟障碍机制研究迈出了第一步,同时也表明人卵纺锤体成分具有独特性。
更深层的核心问题在于:人卵如何从零开始组装成一个纺锤体?纺锤体是如何发展成为双极纺锤体的?为厘清生理机制,王磊/桑庆/武田宇团队持续深耕,将研究聚焦至人卵纺锤体组装的早期阶段,即微管聚合机制研究。

研究团队成员。
2022年,团队发现人卵中存在一种独特的微管组织中心,将其命名为huoMTOC,进一步揭示人卵纺锤体的独特之处,打破了此前学界普遍认为人卵中没有微管组织中心结构的观点。
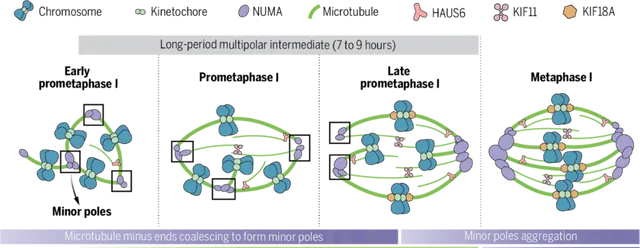
在最新研究中,团队通过免疫荧光和活细胞时间序列成像技术,首次对减数分裂开始后纺锤体的组装过程进行了高清晰度的实时观察。结果显示,人卵母细胞核膜破裂之后,染色体动粒会相聚成簇。随后,新生微管负端在动粒附近聚合并初步形成纺锤体的极,将其命名为「小极(Minor pole)」。
在第一次减数分裂前中期,多个「小极」组装形成典型的「多极纺锤体」,多极纺锤体状态持续长达7-9个小时。在此期间,小极的数目逐渐增多并聚集,直到第一次减数分裂中期形成两个「大极(Major pole)」,最终完成纺锤体双极化过程-多极纺锤体转变为双极纺锤体。「以上过程与有丝分裂及其他哺乳动物卵母细胞的纺锤体双极化过程截然不同,进一步展现出人卵纺锤体组装的独特机制。」王磊强调。
研究人员通过筛选发现了3种蛋白(HAUS6,KIF11和KIF18A)的缺失会导致人卵纺锤体双极化失败:HAUS6通过促进微管的扩增为纺锤体双极化提供物质基础;KIF11通过调控微管间的交联和相对滑动实现纺锤体的双向延伸;KIF18A通过抑制微管的过度生长维持纺锤体的稳定性。这3种蛋白相互配合,在人卵纺锤体双极化建立过程中发挥了重要作用。
在卵子和胚胎发育异常患者中进行的突变筛查显示,11位患者分别携带以上3种蛋白的致病突变,这些突变位点会引起不同程度的纺锤体双极化异常,从而导致卵母细胞成熟障碍、受精失败及早期胚胎发育停滞。
综上所述,该研究首次揭示了人卵纺锤体双极化的生理机制,发现「多极纺锤体」是人卵纺锤体双极化过程中必经的生理状态,明确了调控此过程的关键蛋白;同时,发现关键基因突变导致双极化异常引起卵子和胚胎发育障碍的病理机制。研究为人卵纺锤体组装过程提供了全新认识,并为临床生殖障碍疾病的诊疗提供理论依据。











