僅供醫學專業人士閱讀參考
點選右上方「關註」, 準時接收每日精彩內容推播。
控制和局部遞送治療藥劑 對於增強藥物效果同時最小化全身性副作用的發生具有很重要的意義。控釋可以透過各種遞送系統實作,包括水凝膠。它們的半固體三維網路通常由親水性聚合物和高水分含量(通常> 90% w/w)組成,並且具有良好的組織相容性。此外,它們可調的機械強度使它們非常適合各種組織的機械要求。然而,盡管水凝膠作為大分子如蛋白質的有效遞送系統,它們的多孔結構允許親水小分子容易地擴散出來,通常導致大量的初始突釋和較短的釋放持續時間。特別是在物理交聯的水凝膠中(即透過靜電、氫鍵或疏水鍵交聯),由於它們的基質可以迅速膨脹和消散,釋放尤其迅速,但即使在水凝膠中的聚合物是共價交聯的情況下,小分子也可以透過其多孔網格快速釋放。解決這一挑戰可能有益於遞送小親水藥物用於各種病理,如疼痛管理、抗菌治療和癌癥。雖然局部施用低分子量親水性藥物的控釋可以在目標部位維持高濃度,減少全身性副作用,並提高患者的依從性。然而,實作低分子量親水性藥物的緩慢釋放非常困難,主要因為藥物會迅速從藥物遞送系統中擴散出來。
來自美國哈佛大學醫學院的Daniel S. Kohane團隊 開發了一種完全基於脂質體自組裝的可註射且自愈合的水凝膠 。透過修改膽固醇含量和表面電荷來誘導脂質體的膠凝,而不損害其結構完整性。小親水分子熒光素鈉,要麽裝載在脂質體外的間隙中,要麽包裹在脂質體的水核內。這種包裹策略使得可以根據凝膠的機械強度實作可控和可調的釋放曲線。該水凝膠具有較高的機械強度、最小的膨脹和緩慢的降解。基於脂質體的水凝膠在體內具有延長的機械穩定性,並且沒有局部不良反應。這項工作展示了一類新型的可註射水凝膠,有希望成為多功能的藥物遞送系統。相關工作以題為 「Injectable Hydrogel Based on Liposome Self-Assembly for Controlled Release of Small Hydrophilic Molecules」 的文章發表在2024年06月02日的期刊 【Acta Biomaterialia】 。

1.創新型研究內容
本文假設:透過減少靜電排斥和增加膜的靈活性,脂質體可以凝膠化。由此,本文設計了一個帶負電的脂質體制劑,它可以自組裝成一個可註射的水凝膠(GelLip),同時保留脂質體的結構完整性,而不需要額外的凝膠劑。只有在表面電荷被遮蔽時,即簡單地透過增加懸浮液的離子強度(例如,添加等滲氯化鈉),凝膠化過程才會開始,而在低離子條件下則阻止凝膠化。小親水藥物可以被包裹在脂質體的水核中和/或脂質體外的間隙中,允許實作各種釋放曲線。脂質體的膽固醇含量和表面電荷是凝膠形成的主要驅動力。由於陽離子脂質體被認為比陰離子脂質體更具毒性,因此未對陽離子脂質體進行探索。水凝膠展現出高且可調的機械強度,透過針頭擠壓後迅速愈合,低膨脹,緩慢降解,體內註射後的機械穩定性和高化石相容性,所有這些對於生物醫學套用來說都是重要的特性。
【影響GelLip形成的物理化學參數】
基於脂質體凝膠化原理,本文透過減少脂質體的表面電荷(即低靜電排斥)和增加它們的膜靈活性,用改良的薄脂膜水合法制備了由1,2-二硬脂酰-sn-甘油-3-磷酸膽堿(DSPC)組成的低表面電荷且不含膽固醇的脂質體。為評估膽固醇的影響,制備了含有膽固醇的帶負電脂質體(Chol+ Lip),其莫耳比為3:1:2(分別為DSPC:DSPG:膽固醇),其物理化學性質與不含膽固醇的脂質體(Chol− Lip)相似。將Chol+ Lip(圖1b)和Chol− Lip(圖1c)暴露於透過添加NaCl而增加離子強度的介質中,直至最終濃度為9% w/v。Chol+ Lip沒有形成水凝膠,但Chol− Lip在NaCl濃度超過0.45% w/v時凝膠化,對應的zeta電位為-34 ± 1 mV或更低(絕對值)。Chol+ Lip和Chol− Lip的zeta電位(絕對值)隨著離子強度的增加而相似地降低,證明了膽固醇對凝膠化的抑制作用。水凝膠的儲能模量(G')(在0.9% NaCl中)隨著膽固醇濃度的增加而降低,當膽固醇濃度超過0.8 mg/mL時,凝膠化被完全抑制(圖1d)。在0.9% NaCl存在下,隨著磷脂濃度從6.4增加到51.4 mg/mL,凝膠的G'從0.02 ± 0.01 kPa增加到16.3 ± 1.0 kPa(圖1e)。在磷脂濃度≤ 3.2 mg/mL時,Chol− Lip不會形成凝膠(G' = 0)。基於這些結果,凝膠化被定義為材料不流動的狀態(磷脂濃度> 12.8 mg/mL),對應於G'值> 0.34 ± 0.03 kPa。

圖1 影響GelLip形成的物理化學參數
【GelLip 的形態】
透射電子顯微鏡(TEM)結果顯示:水中的脂質體(凝膠化前;圖2a)顯示出平均大小為156 ± 20 nm的球形脂質體,與動態光散射(DLS)測量得到的尺寸相似。由於水凝膠的高粘度,制備用於TEM成像的水凝膠可能很困難,因此在將GelLip樣品沈積在Cu網格上之前,先用純水稀釋並用200 µL通道移液器在25℃下機械破碎。破碎的凝膠由緊密堆積的脂質體組成,其平均尺寸與凝膠化前測量的相比沒有顯著變化(126 ± 34 nm;p > 0.05;圖2b)。相鄰脂質體界面的高倍放大顯示了兩個分離的脂質雙層(圖2c)。采用了改良的冷凍場發射掃描電鏡(cryo-FF-SEM)方法來評估GelLip在其完整狀態(無機械破壞)下的結構。GelLip由緊密堆積的微米級簇組成,形成了一個超分子凝膠網路(圖2d)。其中,簇表面上的∼30 nm球形結構推測是在樣品制備過程中水分昇華時形成的NaCl鹽晶體。

圖2 Chol-Lip 和 GelLip 的形態
【GelLip 的機械效能】
本文透過振蕩剪下流變學評估了不同磷脂濃度下GelLip的機械效能 。GelLip在1-10%的應變範圍內表現出斷裂,這與磷脂濃度無關。對於所有測試的GelLip型別,在0.1%的應變下,G'在廣泛的頻率範圍(1 - 200 rad/s)內高於G'',並且測量的G'與頻率無關,證明了水凝膠具有良好的黏彈性特性。在加入NaCl後立即開始凝膠化,最終濃度為0.9%(t = 0時G' > G''),並在磷脂濃度為51.4、25.7和12.8 mg/mL分時別在大約50、75和150分鐘達到平台期(圖3a),表明凝膠化過程的完成。理想情況下,醫用水凝膠的機械強度應在生物學相關溫度範圍內保持穩定。在25 – 40℃的溫度測試顯示,所有測試的磷脂濃度下的GelLip都有G' > G''(圖3b),室溫(25℃)下測量的G'減少了不到45%。磷脂濃度為12.8、25.7和51.4 mg/mL的GelLip在21天的時間範圍內分別表現出低膨脹比為17.1%、36.3%和43.3%(圖3c)。透過計算21天後剩余幹磷脂的初始品質百分比來評估GelLip的體外降解(圖3d)。降解隨著磷脂濃度的增加而略微減少,但在所有情況下,> 84%的起始品質被保留。
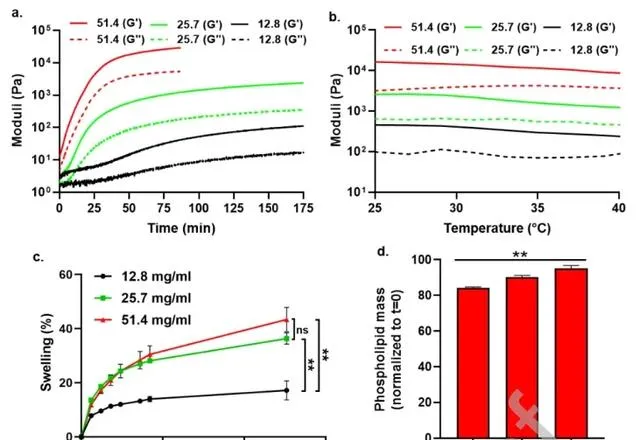
圖3 GelLip 的流變特性、膨脹和降解
本文透過振蕩剪下流變學檢查了不同磷脂濃度下GelLip的可註射性 (圖4a-4c)。在間歇施加的高應變(50%)和低應變(0.1%)條件下,GelLip在所有三個測試的磷脂濃度下都表現出剪下稀化行為(即,G'' > G';液體行為),在高應變下允許流動,而在低應變下則表現出自愈行為(即,G' > G''),恢復到凝膠狀的機械效能。因此,即使在G'超過16 kPa的51.4 mg/mL時,GelLip也可以透過23G針頭輕松註射(圖4d-f)。
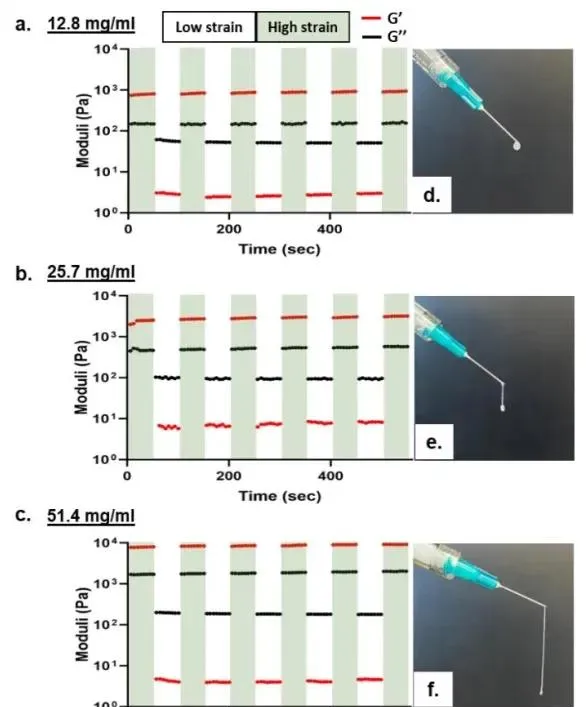
圖4 GelLip 的可註射性
【GelLip 中親水分子的釋放動力學】
本文透過在37℃下進行釋放動力學研究評估了GelLip提供親水性小分子控釋的能力。 選擇NaFluo作為模型藥物,因為它具有低分子量(376 Da)、高水溶性(500 mg/mL)、負電荷(最小化脂質體:染料靜電交互作用),並且可以在非常低的濃度下被檢測到。NaFluo通常用於模擬從不同的藥物遞送系統如水凝膠和脂質體中釋放模型藥物。NaFluo要麽裝載在脂質體外的空間(即,透過在凝膠化之前將預制的空脂質體與NaFluo溶液混合,50 µM),要麽裝載在脂質體的水性核心內(即,脂質體內空間;NaFluo濃度為49.7 ± 2.9 µM,包封效率為3.3 ± 0.2%)。與遊離染料相比,將NaFluo封裝在脂質體外減緩了染料的釋放,並且這種減緩以磷脂濃度依賴的方式發生(例如,在24小時,與遊離染料相比,來自磷脂濃度為12.8、25.7和51.4 mg/mL的GelLip的釋放分別減慢了18%、34%和48%;p < 0.01;圖5a)。為研究染料釋放與GelLip機械強度之間的相關性,本文將24小時的累積釋放量與從圖1e獲得的G'值進行了比較(圖5b)。結果表明,在G'值高於0.3 kPa時已經可以獲得減緩的釋放。與在脂質體外封裝的NaFluo相比,將NaFluo封裝在脂質體的水性核心內進一步減緩了釋放,在同一磷脂濃度下(例如,在48小時,釋放分別減慢了55%和34%;51.4 mg/mL;p < 0.01;圖5c)。
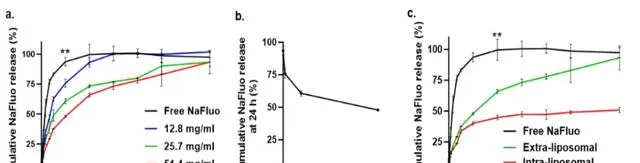
圖5 GelLip的體外藥物釋放
【GelLip 的保留時間】
GelLip(磷脂濃度為51.4 mg/mL)的組織保留持續時間透過使用近紅外染料Cy7標記的磷脂DSPE的前體脂質體進行了評估(通常用於評估體內生物分布)。將標記的GelLip註射到大鼠的坐骨神經中,並透過體內成像系統(IVIS)在預定的時間點監測熒光訊號,隨後使用Living Image軟體進行影像分析(圖6a和6b)。遊離Cy7在註射後迅速減少熒光訊號(1天後< 10%剩余),而GelLip的熒光訊號則緩慢減少(7天後> 80%剩余)。為了確定GelLip在註射組織中的機械穩定性,在註射後的1、4和7天收獲凝膠,然後測量水凝膠體積和G'(分別為圖6c和圖6d)。GelLip體積在7天內沒有顯著變化(圖6c)。在註射後第7天觀察到水凝膠的G'顯著減少(從初始G'減少了89%)。然而,水凝膠在這7天的時間框架內保持了其黏彈性行為,並表現出相對較高的G'值,類似於磷脂濃度為25.7 mg/mL的GelLip的G'值(G' = 1233 Pa;圖6d)。
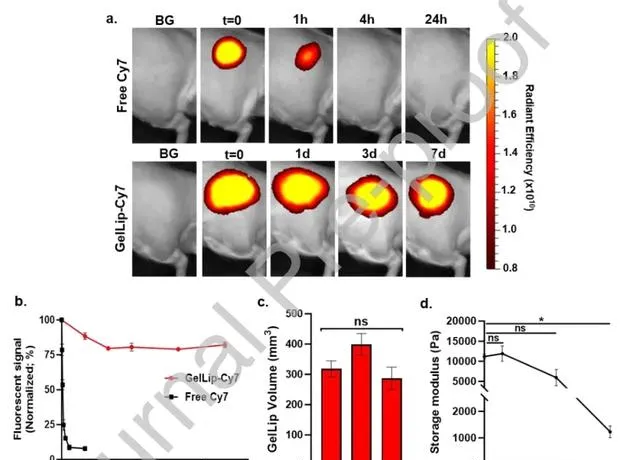
圖6 GelLip 在體內的保留時間和機械穩定性
【GelLip 的體內外化石相容性】
為評估組織反應,將GelLip以測試中最高的磷脂濃度(51.4 mg/mL)註射到大鼠大轉子前內側的肌肉周圍結締組織中 。該位置透過骨骼標誌容易辨識(便於恢復),包括肌肉、結締組織和血管。在註射後的第4天和第30天,將大鼠處死,並收獲肌肉組織,透過蘇木精-伊紅染色進行組織學分析(圖7a和7b)。在4天時對組織的顯微鏡檢查顯示,肌肉表面(即凝膠註射部位)出現穿透肌肉的淋巴組織細胞炎癥。 在註射後30天,僅存在輕微的殘留炎癥,並且在任何時間點都沒有觀察到肌毒性。
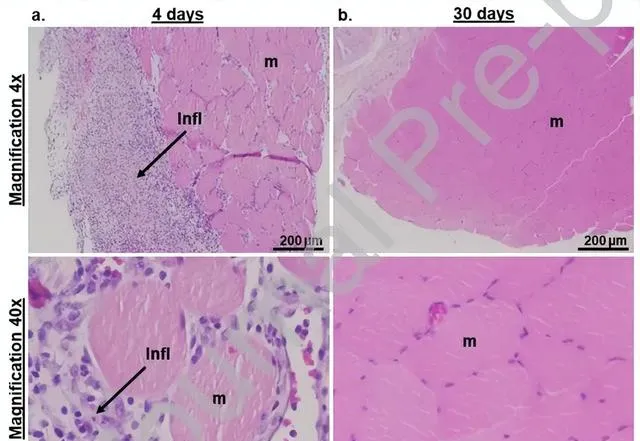
圖7 GelLip 的體內化石相容性
2.總結與展望
本文開發了一類全新的水凝膠,其由自組裝的脂質體組成且無需額外的凝膠劑,具有高且可調的機械強度、易於註射、快速自愈合、緩慢降解、在註射部位的延長滯留、體內高機械穩定性和良好的化石相容性 ,這些對於生物醫學套用來說都是重要的特性。這種水凝膠可以實作小親水分子的控制釋放。透過改變脂質體的濃度以及將藥物包裹在脂質體外的間隙和/或脂質體的水核內,可以修改釋放曲線。
了解更多
關註「EngineeringForLife」,了解更多前沿科研資訊











