
2024年8月23日,王磊團隊在【科學】發文「Mechanisms of minor pole-mediated spindle bipolarization in human oocytes」。 本文圖片 復旦上醫供圖
全球不孕不育率持續上升,如今已接近15%-20%,成為僅次於癌癥、心腦血管疾病的人類第三大健康問題。從細胞生物學與遺傳學角度出發,復旦大學生物醫學研究院王磊、桑慶、武田宇團隊聯合上海交通大學附屬國際和平婦幼保健院李文團隊的最新研究成果揭示了人類卵母細胞紡錘體雙極化機制,為生殖障礙疾病的研究與治療,提供了重要的解釋視角與理論支持。
2024年8月23日,相關成果以「Mechanisms of minor pole-mediated spindle bipolarization in human oocytes」為題,發表在最新一期的【科學】(Science)雜誌上。這也是復旦大學上海醫學院王磊團隊在人卵發育的生理與病理機制研究上取得的又一重大突破。
該研究發現,人卵紡錘體微管聚合啟動後,會經歷一段較長時間的 「多極紡錘體」(Multipolar spindle)階段,而後才形成雙極狀紡錘體,同時發現了調控紡錘體雙極化的關鍵蛋白,並在臨床多個卵子和胚胎發育異常患者中鑒定到編碼這些關鍵蛋白的基因存在突變,從而揭示了人卵紡錘體雙極化的獨特生理病理機制。
研究圖示。
全球有6000萬-8000萬對夫婦面臨不孕之苦,有數百萬人進行試管嬰兒治療,但臨床中時常遇到卵子、授精及胚胎發育異常的情況,人們對這些異常背後的原因及機制所知甚少。
王磊十多年前提出研究假設:遺傳因素可能是導致人卵成熟與發育異常的重要原因之一。2016年,王磊/桑慶團隊發現人類卵子成熟障礙的第一個致病基因——靈長類特異β-微管蛋白TUBB8,從而明確了此疾病為人類新遺傳病。該基因可解釋約30%卵母細胞成熟障礙患者,如今已廣泛套用於臨床檢測。繼TUBB8之後,團隊又陸續發現24個人類卵子成熟障礙的致病基因並明確了機制。
研究團隊認為,紡錘體的存在及其正常與否,直接決定了卵子是否能夠正常成熟與受精。作為人卵紡錘體的主要組成部份,靈長類特異基因TUBB8的發現,標誌著人類卵子成熟障礙機制研究邁出了第一步,同時也表明人卵紡錘體成分具有獨特性。
更深層的核心問題在於:人卵如何從零開始組裝成一個紡錘體?紡錘體是如何發展成為雙極紡錘體的?為厘清生理機制,王磊/桑慶/武田宇團隊持續深耕,將研究聚焦至人卵紡錘體組裝的早期階段,即微管聚合機制研究。

研究團隊成員。
2022年,團隊發現人卵中存在一種獨特的微管組織中心,將其命名為huoMTOC,進一步揭示人卵紡錘體的獨特之處,打破了此前學界普遍認為人卵中沒有微管組織中心結構的觀點。
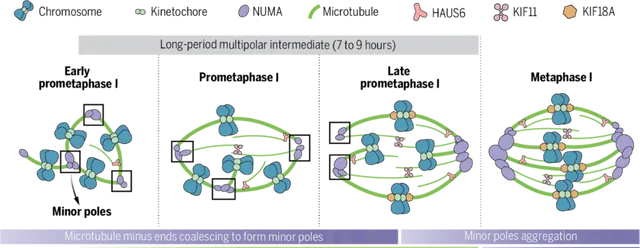
在最新研究中,團隊透過免疫熒光和活細胞時間序列成像技術,首次對減數分裂開始後紡錘體的組裝過程進行了高解析度的即時觀察。結果顯示,人卵母細胞核膜破裂之後,染色體動粒會相聚成簇。隨後,新生微管負端在動粒附近聚合並初步形成紡錘體的極,將其命名為「小極(Minor pole)」。
在第一次減數分裂前中期,多個「小極」組裝形成典型的「多極紡錘體」,多極紡錘體狀態持續長達7-9個小時。在此期間,小極的數目逐漸增多並聚集,直到第一次減數分裂中期形成兩個「大極(Major pole)」,最終完成紡錘體雙極化過程-多極紡錘體轉變為雙極紡錘體。「以上過程與有絲分裂及其他哺乳動物卵母細胞的紡錘體雙極化過程截然不同,進一步展現出人卵紡錘體組裝的獨特機制。」王磊強調。
研究人員透過篩選發現了3種蛋白(HAUS6,KIF11和KIF18A)的缺失會導致人卵紡錘體雙極化失敗:HAUS6透過促進微管的擴增為紡錘體雙極化提供物質基礎;KIF11透過調控微管間的交聯和相對滑動實作紡錘體的雙向延伸;KIF18A透過抑制微管的過度生長維持紡錘體的穩定性。這3種蛋白相互配合,在人卵紡錘體雙極化建立過程中發揮了重要作用。
在卵子和胚胎發育異常患者中進行的突變篩查顯示,11位患者分別攜帶以上3種蛋白的致病突變,這些突變位點會引起不同程度的紡錘體雙極化異常,從而導致卵母細胞成熟障礙、受精失敗及早期胚胎發育停滯。
綜上所述,該研究首次揭示了人卵紡錘體雙極化的生理機制,發現「多極紡錘體」是人卵紡錘體雙極化過程中必經的生理狀態,明確了調控此過程的關鍵蛋白;同時,發現關鍵基因突變導致雙極化異常引起卵子和胚胎發育障礙的病理機制。研究為人卵紡錘體組裝過程提供了全新認識,並為臨床生殖障礙疾病的診療提供理論依據。











