2013年5月,亚洲首例猪-猴异种异位部分肝移植获得成功;2020年6月,异种肝移植受体存活刷新世界纪录;2023年,异种异位辅助肝移植取得新突破;2024年3月10日这一次,则首次将一只多基因编辑猪的全肝,以辅助的方式移植到一位脑死亡患者体内……至此,空军军医大学西京医院历经11年的异种肝脏移植临床研究,取得重大突破,猪肝有望很快用于移植挽救肝衰竭患者。
重大突破 猪肝首次被移植到人体内
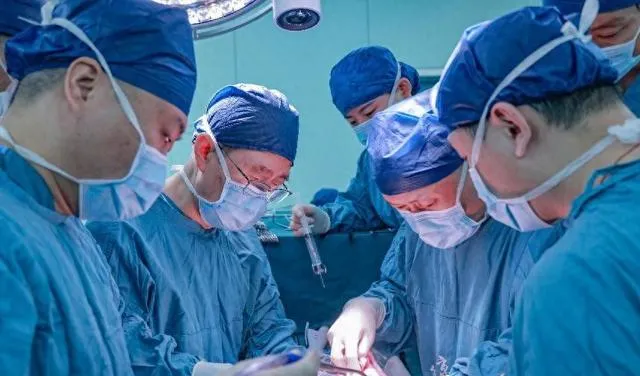
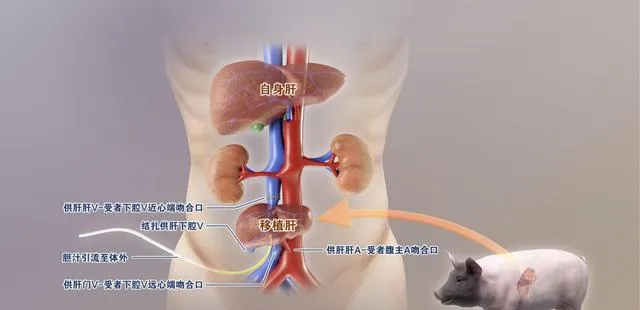
3月10日,对陕西乃至全国来说,都是值得铭记的日子。因为这一天,中国科学院窦科峰院士、空军军医大学西京医院陶开山主任团队,在多次的「猪猴异种肝移植动物实验」基础上,以成都中科奥格生物科技有限公司提供的一头O型血、23公斤重的多基因编辑猪作为供体,一例重型闭合性颅脑损伤导致的脑死亡患者作为受体,实施了保留移植患者自身肝脏的辅助性肝移植,模拟了临床肝衰竭患者的替代支持治疗过程,属世界首例。至此,异种肝脏异种移植步入临床研究阶段,该研究首次探索了「基因编辑猪-人」肝脏异种移植的可行性。
3月17日,记者从西京医院了解到,3月10日手术当天,麻醉科、外科手术室、心血管外科等14个科室共同参与,一切准备就绪后,供体猪全麻,专家团队打开腹腔,游离、灌注、获取供肝,对供肝进行修整,称重700g,组织学检查显示肝组织形态结构正常。受者常规麻醉,取腹部正中切口……术中,B超显示移植肝灌注良好,整个手术历时约9小时顺利结束。
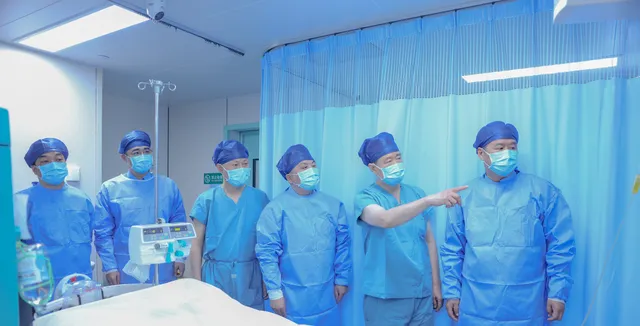
术后24小时,受体血流动力学平稳,移植肝脏胆汁分泌良好,B超显示移植肝脏血供良好,移植肝脏穿刺病理显示未见排斥反应。据西京医院肝胆外科陶开山主任介绍,移植的基因编辑猪肝脏无论从胆汁、血供和病理结果来讲,情况良好,手术效果超出团队预想。
据窦科峰院士讲,这是医学界第一次将基因编辑猪肝植入人体内。目前,经超过96小时的观察,移植的基因编辑猪肝脏,在人体内能够发挥生理功能,正常分泌胆汁,说明有可能替代人类肝脏。
据了解,我国有近4亿肝病患者,700多万肝硬化患者,同时,每年新增30万~50万的肝衰竭患者。对于肝衰竭,肝移植是唯一有效根治方式。现实中,很多人因等不到人类供肝而失去生命。而被选择为最佳供体的多基因编辑猪,因为其生理、生化与人体相似,易于基因改造、培育,繁殖周期短,可随时获得,而且数量不限,可使更多终末期肝病患者获益,未来可能完全替代同种肝移植。
探索研究 猪-猴到猪-人移植历经11年
记者采访了解到,从2013年5月亚洲首例猪-猴异种异位部分肝移植获得成功,到2024年3月的这次基因编辑猪至脑死亡受者肝移植,窦科峰院士、陶开山主任带领的异种肝脏移植临床研究团队,为了能让异种肝脏移植尽快运用于临床,在长达11年的时间里,先后进行了多次猪猴异种肝移植动物实验。
2013年5月7日,成功完成国际首例转基因猪-藏酋猴异种异位脾窝辅助性肝部分移植术,切除猴的脾脏,将猪的部分肝脏放在猴的脾窝。虽然手术很顺利,但由于经验不足,受体猴在存活26小时后不幸死亡。5月28日,开展了第二例同样的移植实验手术,手术切除受体猴的脾脏,将供体猪的200克肝脏放在猴的脾窝部位。截至2013年6月6日下午2时,移植猪肝的猴子,创下术后存活10天的最新医学纪录。
2020年6月13日,成功实施多基因编辑猪-猴肝心肾移植术,研究团队将一个供体猪的肝、心、肾分别移植给3只恒河猴受体。期间,肝脏移植采用脾窝异位辅助性肝移植。术后,移植肝和受体存活超过16天,创造猪-猴辅助性肝移植受体存活世界纪录。
2022年10月16日,历时14个小时成功实施国际首例多基因编辑猪-猴多器官多组织同期联合移植。研究团队通过获取1头多基因编辑猪的肝脏、心脏、肾脏3个脏器,以及角膜、皮肤、骨骼3个组织,分别为4只受体猴同期实施肝肾联合移植、心脏移植、角膜和皮肤移植、骨骼移植。术后,受体猴及肝脏等移植器官、组织存活良好。
2023年10月29日至30日,成功实施的多基因编辑猪-猴异位辅助肝移植,取得新突破。术中将1只基因编辑猪的肝脏、肾脏、心脏、腹壁、角膜、骨、神经等多个器官和组织,移植给7只受体猴,术后肝脏等器官功能良好。
2024年3月10日这一次,则首次将一只多基因编辑猪的全肝,以辅助的方式移植到一位脑死亡患者体内,且已持续工作超96小时。对此,窦科峰院士表示,该项研究的顺利开展,是异种器官移植领域的重大突破,也是异种肝移植向临床迈进的关键一步,为下一步的临床应用提供了理论依据和数据支撑。
临床应用 可暂时替代同种肝移植辅助治疗
11年时间,历经了多次猪猴异种肝移植动物实验,此次进行的「基因编辑猪-人」肝脏移植,受体为何选择脑死亡患者而非需要肝移植的肝衰竭患者?
据窦科峰院士介绍,异种器官移植采用狒狒、猕猴等动物作为移植受体,是进行临床前研究所必需的,因为它们的结构和生理与人类最相近。对于以狒狒、猕猴为受体的异种移植,敲除了某些猪抗原的六基因编辑猪,可能会加重移植肝脏的排斥反应,但对以人体为受体的移植手术来说,却是有益的。因此,采用脑死亡受体进行异种器官移植临床试验,能更好地反映移植器官的功能,检测猪的基因编辑策略是否合适,也能积累更多临床经验。
另外,采用狒狒、猕猴等动物进行异种器官移植研究,往往会使用一些还处于研究阶段的新型免疫抑制药物,这些药物没有实现临床应用,并不能直接用于疾病治疗。因此,动物研究中优化的免疫抑制方案,并不一定适合人类受体。但以脑死亡患者为移植受体,则可使用临床免疫抑制药物,继而得出最优化的临床异种器官移植免疫抑制策略。
「基因编辑猪-人」肝脏移植的成功实施,是否预示着猪的肝脏可替代人类肝脏发挥功能?
对此,窦科峰院士告诉记者,相对于肾脏和心脏,肝脏涉及合成、分解、凝血、解毒和免疫等功能,解剖结构和生理功能更为复杂,因此,基因编辑猪的肝脏还不能完全替代人类肝脏发挥功能,异种肝脏移植技术难度和科学意义更大。
尽管动物研究中,异种肝移植受体的存活时间没有异种肾脏和心脏移植存活时间长,却有着非常迫切的临床急救需求。特别是对于急性暴发性肝功能衰竭患者,肝移植是唯一救命方式。因此,现阶段将异种肝移植作为一种暂时的同种肝移植替代治疗手段,或让患者自身肝脏经过移植肝的帮助后功能得以恢复。从这个层面来讲,异种肝移植就有非常大的临床应用价值,这是该研究采用辅助性肝移植方式的原因。 (记者 李海涛)











