*仅供医学专业人士阅读参考
让肿瘤微环境里一些走上邪路的细胞「浪子回头」,从抑制抗肿瘤免疫应答变为助力免疫应答,应该算是许多科研工作者的夙愿了,而常被提到的挽救对象之一就是肿瘤相关巨噬细胞(TAMs),不过让它们改邪归正的难度确实不小,奇点糕也经常在想,要是有某个通路或分子能像开关一样,只要轻轻一拨把它激活,就能让TAMs们迷途知返呢?
别说,这样的开关或许真的有。国庆假日期间,Science Advances期刊发表了一项来自复旦大学基础医学院张思团队与复旦大学附属中山医院董玲、薛如意团队的最新研究成果,研究揭示在肝细胞癌(HCC)中,激活TAMs表面的NOD样受体(NLRs)家族成员NOD1,就可以让TAMs切换为助力抗肿瘤免疫应答的正向形态。
NOD1在HCC肿瘤微环境里的TAMs中广泛存在,且与患者对免疫治疗的应答和预后正相关。从作用机制来说,激活NOD1可有效下调TAMs内脂滴相关蛋白perilipin 5,阻碍TAMs的脂肪酸氧化作用、使游离脂肪酸在细胞内堆积,而这些代谢改变会促进共刺激分子OX40L的膜定位,使TAMs激活CD8+T细胞的能力显著增强,也就上调了免疫应答[1]。

论文首页截图
人体内具有抗原呈递功能的细胞,例如巨噬细胞和树突状细胞都存在NLRs高表达,不过此前学界围绕NLRs展开的研究,大多与它们在抗感染过程中激活固有免疫通路相关[2],直到近些年焦点才向癌症倾斜,开展本次研究的复旦团队也在2021年发表论文,初步揭示了NOD2促HCC发生的潜在机制[3],但研究发现的也是NOD2对癌细胞行为的影响。
那换个角度来看,在肿瘤微环境中的巨噬细胞是否会高表达NLRs,NLRs又有怎样的影响呢?研究者们通过分析HCC单细胞测序结果,发现HCC微环境内大量存在的抑癌性M1型TAMs,会特征性高表达NOD1等关键基因,且NOD1+TAMs对T细胞激活的调控作用明显较NOD1-TAMs更强,这在初步筛选的关键基因中是独一份。
自然而然地,NOD1就成为了后续研究的重点,流式细胞术和多重荧光免疫染色(mIF)分析显示,存在较多NOD1+TAMs的HCC内,激活状态CD8+T细胞的占比也明显更高,且在NK细胞、调节性T细胞等其它免疫细胞组分占比未发生明显改变的状况下,NOD1+TAMs水平就与患者生存预后(OS/RFS)呈显著的正相关性。

HCC微环境内的NOD1+TAMs水平,与CD8+T细胞激活状态及患者生存预后均呈正相关
体外细胞实验显示,激活NOD1可使TAMs转变为免疫刺激表型,它们激活CD8+T细胞增殖和细胞毒性功能的效果显著增强,放到荷瘤小鼠身上就能转化为CD8+T细胞依赖性的抑癌效应,显然是值得利用的正向调节,那就得阐明激活NOD1具体的起效机制了。
基因集富集分析(GSEA)很快提示,NOD1激活与TAMs内的脂肪酸氧化(FAO)相关通路呈显著负相关性,其中受影响最明显、作用也最关键的就是perilipin 5,NOD1对它的调控可能是经由激活p38信号通路,下调PPARα来影响其编码基因的转录;而FAO则是影响TAMs功能的「命门」[4],其减弱也会使TAMs内的游离脂肪酸(FFAs)显著增多。
而在增多的FFAs中,对NOD1激活调控CD8+T细胞最重要的是棕榈酸,它是表观遗传修饰中「棕榈酰化修饰」的主角,受影响的蛋白质之一就是共刺激分子OX40L: 在被棕榈酰化修饰增强疏水性后,OX40L就更易出现在TAMs的膜表面 ,这正是TAMs转变为免疫刺激表型、更好地激活CD8+T细胞的底层机制。
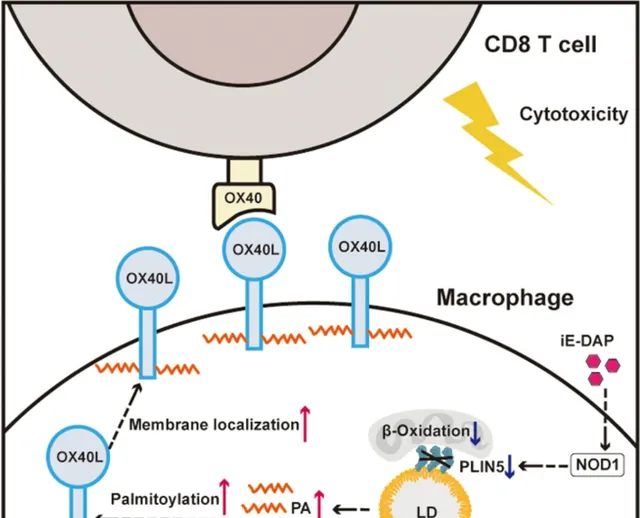
NOD1激活下调FAO,转变TAMs功能表型的具体机制
因此显而易见,激活NOD1能够在小鼠实验中与PD-1抑制剂治疗实现协同增效,微环境内存在更多NOD1+TAMs也是HCC患者接受免疫应答的利好消息,但要把这次研究的发现成功向临床转化,科研工作者们就得找到只精准打开TAMs表面NOD1开关的办法,加油努力吧~

参考文献:[1]Zhang F, Jiang Q, Cai J, et al. Activation of NOD1 on tumor-associated macrophages augments CD8+ T cell–mediated antitumor immunity in hepatocellular carcinoma[J]. Science Advances, 10(40): eadp8266.
[2] Chen G, Shaw M H, Kim Y G, et al. NOD-like receptors: role in innate immunity and inflammatory disease[J]. Annual Review of Pathology: Mechanisms of Disease, 2009, 4(1): 365-398.
[3] Zhou Y, Hu L, Tang W, et al. Hepatic NOD2 promotes hepatocarcinogenesis via a RIP2-mediated proinflammatory response and a novel nuclear autophagy-mediated DNA damage mechanism[J]. Journal of Hematology & Oncology, 2021, 14: 9.
[4] Su P, Wang Q, Bi E, et al. Enhanced lipid accumulation and metabolism are required for the differentiation and activation of tumor-associated macrophages[J]. Cancer Research, 2020, 80(7): 1438-1450.

本文作者丨谭硕











