7月24日,上海交通大學 蔡宇伽 團隊與丹麥奧胡斯大學 Søren R Paludan 團隊聯合在【Nature】上發表了一項突破性研究成果(上海交通大學為第一單位),題為「TMEFF1 is a neuron-specific restriction factor for herpes simplex virus」。該研究利用全基因組CRISPR篩選技術發現了神經元細胞特異表達的TMEFF1蛋白在中樞神經系統中對單純皰疹病毒HSV存在顯著的限制作用。 本研究首次報道了一種獨立於幹擾素系統的、神經元獨有的抗病毒因子,為大腦抗病毒免疫機制研究提供了全新的視角。
宿主對微生物感染的防禦能力是物種生存的最基本前提之一,其重要性堪比能量攝取和生命繁衍。然而,免疫反應也有可能對宿主造成嚴重損害,並且消耗大量的能量。因此,大多數免疫機制都是誘導型且受到嚴格的調控。這一原則對於人體有效對抗感染是非常關鍵的,可以對免疫損傷高度敏感的組織如中樞神經系統(CNS)形成全面和周到的保護。大腦跟人體其他組織和器官一樣,同樣面臨病毒感染的風險,且一旦發生後果往往更為嚴重。然而, 目前我們對於大腦中神經元細胞是如何對抗病毒感染的這一基本生物學問題的了解仍然十分有限,尚未發現任何神經元特有的抗病毒機制。
單純皰疹病毒(HSV)是一種廣泛存在的嗜神經性雙鏈DNA病毒。據統計,50-80%的成年人血清學檢測呈陽性,是一個巨大的全球公共衛生挑戰。HSV的原發感染通常發生在上皮細胞中,隨後進入感覺神經,建立潛伏感染狀態。單純皰疹病毒感染可以引起生殖器皰疹和病毒性角膜炎等癥狀,也被認為跟阿爾茲海默癥和帕金森病存在一定的關聯。所幸的是,盡管大多數人都是皰疹病毒的攜帶者,多數人並不會表現出明顯的疾病癥狀。 為什麽在多數攜帶者中,作為嗜神經性病毒的HSV不會引起腦部感染?大腦是否存在神秘的守衛者? 這些問題的答案依然是一個謎團,因此,有必要對神經元細胞對抗病毒的機制進行系統研究。
研究團隊在人源幹細胞衍生的神經元中發現,TMEFF1的敲除會導致HSV-1復制顯著增加,並引發神經元死亡。在Tmeff1基因剔除的小鼠模型中,大腦神經元中的病毒載量顯著升高,表現為大腦對HSV-1感染的敏感性顯著增加,而這一現象在外圍組織中並未觀察到(圖1)。 這些表明TMEFF1作為神經元特異性的限制因子,在控制HSV-1復制和預防腦感染中起著關鍵的作用。
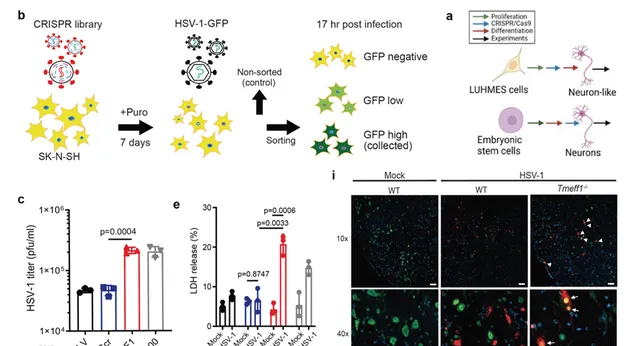
圖1 利用CRISPR文庫篩選並在體內外驗證TMEFF1的抗病毒作用
進一步的研究表明,TMEFF1的表達不受經典的幹擾素和炎癥細胞因子的通路調控。盡管目前已發現多種HSV-1限制因子,如MxB、IFI16和PML-核體蛋白等,這些因子作用於病毒DNA入核、轉錄和DNA復制等過程,其共同特點是都要受幹擾素的調節,且沒有一種在神經元裏邊特異表達。該項研究 首次報告了一種獨立於幹擾素系統的神經元特有的HSV-1限制因子 。研究還發現TMEFF1透過與病毒的入膜受體Nectin-1和非肌型肌球蛋白重鏈IIA/B相互作用來阻止病毒入膜,能同時幹擾HSV-1 gD蛋白介導的病毒結合階段及HSV-1gB蛋白介導的病毒融合階段,從而限制病毒的復制(圖2)。 這種雙重防禦機制反映了將HSV-1這種極為普遍的病毒阻擋在中樞神經系統外對於維持宿主的健康和功能至關重要性。
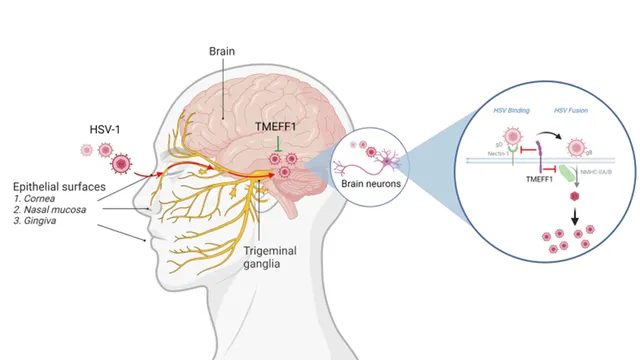
圖2 TMEFF1在中樞神經系統神經元中限制HSV-1的作用模型
抗感染免疫反應必須在消除病原和免疫損傷之間找到微妙平衡。特別是對於腦部這樣高度敏感的部位,失控的先天和適應力免疫反應都可能造成淪陷性的後果。該項研究不僅首次揭示了一種神經元特有的免疫機制,還為理解大腦中最佳的抗病毒免疫機制提供了重要線索。研究認為,大腦中最佳的抗病毒免疫機制是固有型免疫和幹擾素驅動的免疫的結合。固有型免疫能即時作出響應,建立並提高感染的閾值;而幹擾素驅動的免疫雖然更強大,但可能導致組織損傷。因此,這種結合提供了一種平衡狀態,最大程度減輕病毒感染對中樞神經系統的傷害。
此外,本研究中根據TMEFF1抗病毒作用的機制,發現了一種TMEFF1衍生的多肽具有高效抵禦HSV感染的功能。因此,這些發現也 為開發新型抗病毒治療策略貢獻了新靶點 ,有望助力新型HSV藥物開發,對公共衛生和醫學研究具有重要意義。
上海交通大學系統生物醫學研究院 蔡宇伽 教授與奧胡斯大學 Søren R Paludan 教授為該論文共同通訊作者,上海交通大學系統生物醫學研究院蔡宇伽課題組 博士生戴瑤 和奧胡斯大學Søren教授課題組 Manja Idorn博士 為本文的共同第一作者。上海交通大學潘小勇、朱金偉、達林泰、陸青教授以及蔡宇伽課題組姜卓凡、鐘亦曄和張淑慧等人也為這項研究的完成做出了重要貢獻。 本研究受到了兩項國家自然科學基金面上專案的資助(批準號:31971364;32370148)。
本研究的靈感來自於2016年從事病毒載體與基因編輯研究的蔡宇伽博士在丹麥工作期間找到從事免疫研究的Søren教授的一次頗為隨意的談話。蔡宇伽提出既然病毒與宿主的之間存在很多未知,為什麽我們不用基因編輯篩選工具來系統性審視呢?肯定會有新發現!Søren回答也很幹脆:「我這裏正好有很多HSV」。雙方一拍即合。雖然論文順利發表,研究過程充滿艱辛與挑戰,歷時整整8年。蔡宇伽博士克服前期經費不足、人員短缺等困難,用了兩年的時間終於釘選了目標分子TMEFF1,進而對其展開分子機制研究。對於純粹科學問題的好奇心一直是驅動蔡宇伽團隊不斷前進的最大動力。 整個研究周期長、挑戰多,歷經中丹美跨國協調、全球多團隊合作、跨學科溝通,終於解開了大腦獨特的抗病毒謎團,回答了大腦如何對抗病毒感染這一最基本的生物學問題之一。
專家點評

趙國屏
(中國科學院院士、中國科學院合成生物學重點實驗室主任)
蔡宇伽和Søren等人的研究發現並鑒定了一種此前從未發現的主要在神經元細胞中特異表達的病毒限制性因子TMEFF1。該因子透過與單純皰疹病毒(HSV)受體Nectin-1和非肌肉型肌球蛋白鏈(NMHC)IIA/B相互結合的雙保險機制來阻止病毒進入細胞,因此,是在病毒感染的第一時間也就是病毒入膜階段發揮限制作用。TMEFF1與已知的大多數限制性因子不一樣,它獨立於經典的先天性免疫反應和幹擾素(IFN)系統的調控,透過內在的、非誘導型的作用機制發揮功能,有利於神經元在遭遇HSV病毒感染時以最快的速度做出響應,對於維護大腦和神經元的健康具有重要意義。考慮到全球有數十億單純皰疹病毒的感染者,TMEFF1這項研究對於全球公共衛生具有重要的意義。
研究團隊透過全基因組CRISPR篩選技術成功發現了TMEFF1這一抗病毒因子,展現了基因組編輯技術在病毒學研究中的套用潛力。此外,研究者基於TMEFF1的抗病毒機制發現了一種抗病毒多肽,這種多肽具有潛在的臨床套用前景,可以成為未來抗病毒藥物研發的重要方向。
TMEFF1的發現豐富了我們對大腦抗病毒機制的認知,幫助我們理解大腦在如何消除病毒感染和避免免疫細胞損傷上演化出的 「微妙平衡」,也為今後開發針對HSV的預防和治療手段提供了新的科學依據,在科學和轉化方面均具有重要的意義。 這項研究不僅僅是病毒學領域的一次重大突破,也是神經科學和免疫學的一次重要交匯,為人類健康事業做出了一個重要的貢獻。

李斌
(上海交通大學特聘教授、上海市免疫學研究所科研副所長)
I型單純皰疹病毒(HSV-1)是一種高度流行的嗜神經性雙鏈 DNA 病毒,大約有50-80%的成年人呈血清陽性。HSV-1感染可以引起口唇部皰疹,也可以引發致盲性角膜炎,在特殊情況下,HSV-1 感染可從外周神經進入中樞神經系統,引起單純皰疹性腦炎,死亡率可高達70%。即使患者獲得治愈,後期仍面臨著較高程度的神經後遺癥。中樞神經系統作為人體的最為重要和敏感的組織之一,受到人體系統嚴格的保護,如血腦屏障可以過濾部份病毒的入侵。種種跡象表明神經元可能存在獨特的抗病毒策略,能夠在不啟用炎癥反應的情況下直接限制病毒的復制。然而,神經元到底透過什麽樣的機制發揮獨特的抗病毒功能仍然不清楚。
本研究中,蔡宇伽等研究人員透過全基因組CRISPR篩選首次報道了神經元特異的HSV限制因子TMEFF1,並在幹細胞分化的人神經元與Tmeff1敲除的小鼠中證實了TMEFF1高效限制病毒感染的功能,闡明了其發揮作用的具體分子機制。TMEFF1透過與介導病毒結合及融合的細胞表面受體相互作用,直接阻斷了病毒進入細胞的行程,在第一時間將病毒阻擋在神經元細胞外。 有意思的是,與多種已發現的幹擾素(IFN)介導的病毒限制因子相比,TMEFF1的表達不受 IFN 和炎癥細胞因子的調節,因此,避免了過度的IFN引起的病理損傷。 該研究的重要性在於首次鑒定了TMEFF1作為神經元特異性的HSV限制因子,並行現了其保護神經元免受病毒感染的作用機制。該研究成果對於人體對抗病毒反應的研究與認知具有重要的意義。
團隊介紹
蔡宇伽課題組長期致力於藥物靶點發現、基因治療工具開發,以及轉化醫學研究。在靶點發現、載體開發和臨床研究上均做出了重要貢獻。代表性成果有:開發了原創型基因編輯遞送載體類病毒體VLP;開發了DC靶向性VLP mRNA疫苗技術;發現新抗病毒因子TMEFF1和PARP1。其中,VLP技術已用於兩種疾病基因編輯治療的臨床研究。近年來,以通訊作者在Nature(2024), Nature Biotechnology(2021), Nature BME(2021/2024), Cell Stem Cell(2024)等發表多篇學術論文。課題組對新型基因編輯和遞送工具開發、腫瘤和衰老的新靶點和難治性疾病創新療法、人工智能與生物醫學交叉以及生命科學原理性問題有著濃厚的興趣,歡迎有相關研究背景的優秀學生和博士後加入團隊,用科學和技術改變人類的生命質素和長度。
論文連結:
https://www.nature.com/articles/s41586-024-07670-z
來源:系統生物醫學研究院
編輯:「四力」共行計劃成員
致遠學院 孫殷彤
責任編輯:陳煜陽
主編:金雪











