糖基化 透過多種機制影響蛋白質和細胞生物學活性,如蛋白質 穩定性 、 受體相互作用 和 訊息傳遞 。在許多風濕性疾病中,蛋白質(尤其自身抗體)糖基化發生轉變,與炎癥過程和疾病進展有關。
自身抗體糖基化
免疫分子的糖基化
蛋白質可以具有N-連線和/或O-連線糖基化。
N-連線聚糖
N-連線聚糖連線到 天門冬醯胺 (asparagine,N) 殘基上 。N-糖基化共有序列包括天門冬醯胺-X-絲胺酸/蘇胺酸( N-X-S/T ,其中「X」可以是除脯胺酸以外的任何胺基酸),或不太常見的天門冬醯胺-X-半胱胺酸( N-X-C )基序。
在存在共有序列的情況下,前體聚糖在內質網(ER)中以共轉譯或轉譯後方式連線到天門冬醯胺殘基上。
葡萄糖殘基的去除起質素控制作用,只有這樣蛋白質才能進入高基氏體。這裏,高甘露糖結構(具有五到九個甘露糖殘基的聚糖)可以透過糖苷酶和d糖基轉移酶的相互作用進行修剪並隨後延伸以形成復合N-糖。
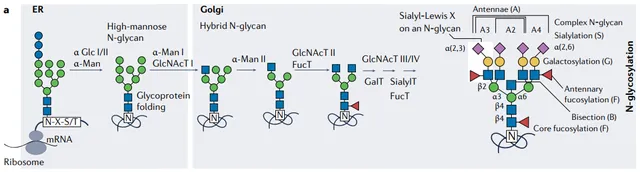
Nat Rev Rheumatol. 2023
O-連線聚糖
O-連線聚糖在高基氏體中僅以轉譯後方式附著在更復雜基序的 絲胺酸(S) 或 蘇胺酸(T) 殘基上。
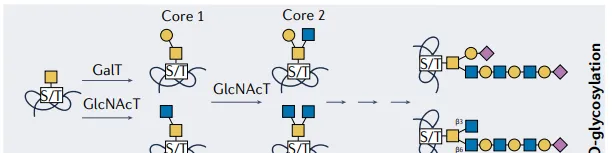
Nat Rev Rheumatol. 2023
最常見的是,N-乙酰半乳糖胺(GalNAc)殘基(形成O-GalNAc聚糖)被轉移到S/T胺基酸中,然後可以透過廣泛的糖基轉移酶添加到其中。因此,最終的聚糖組成可能受到多種因素的影響,包括核苷酸糖的可用性、糖基轉移酶、聚糖轉運蛋白和糖苷酶的表達和定位,以及特定共識序列的可及性。
細胞的代謝狀態在決定聚糖的組成方面也起作用,因為它可以影響ER和高基氏體中糖蛋白。
關鍵點
幾乎所有透過ER的膜或其他蛋白質都是糖蛋白,包括 細胞因子 , 趨化因子 、及其受體,以及 T細胞受體 (TCR), B細胞受體 (BCR), 免疫球蛋白 以及 MHC 和 MHC樣 分子。
BCR/TCR糖基化
當Ag結合時,B細胞表面與 脂筏相連 的BCR啟用,觸發訊息傳遞。核心巖藻糖基化促進B細胞形成高效的脂筏結構域,促進BCR訊息傳遞。
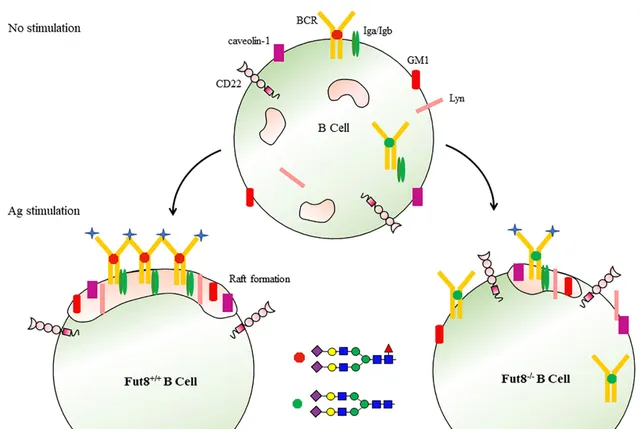
Front. Immunol. 2022
Nat Rev Rheumatol. 2023
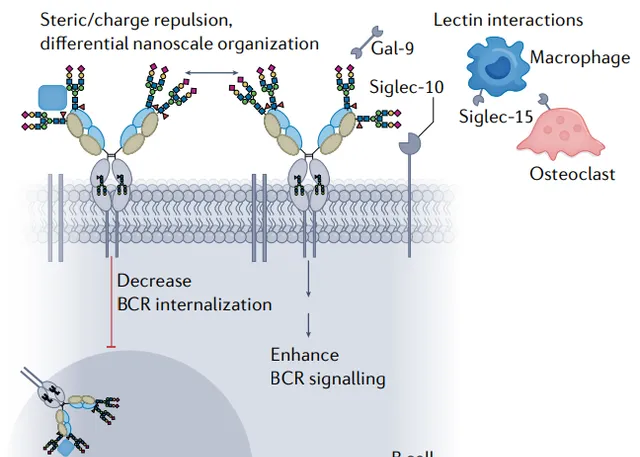
在表達ACPA的B細胞中,負調控因子CD22對Fab糖聚糖介導的BCR訊息傳遞效應沒有明顯的影響。 因此,目前還缺乏對Fab聚糖如何影響B細胞活化和生物學的精確機制的理解。
其機制可能包括末端含唾液酸的Fab聚糖與其他膜結合或可溶性凝集素的相互作用,如Siglec-10或半乳糖凝集素-9。然而,也可以想象,Fab聚糖改變了BCR的結構,從而影響訊號傳導。BCR的二聚和定位可能受到空間或電荷誘導(帶負電荷的Fab聚糖的排斥或與凝集素的相互作用)。
值得註意的是,甘露糖苷acetylglucosaminyltransferase 5,在一種N-聚糖分支 增加GlcNAcβ1,6的酶,6在N-聚糖上的分支,減少了 TCR N-聚糖 的分支,並透過直接促進TCR聚集,降低了T細胞啟用的閾值。相比之下,TCR上分支的n-聚糖的存在能夠與周圍的半乳糖凝集素相互作用,從而減少TCR與其他共受體的聚類和定位。TCR N-聚糖的分支增強,從而降低了T細胞的啟用狀態,從而降低了對潰瘍性結腸炎等自身免疫性疾病的易感性。
Fab聚糖也可能有助於濾泡性淋巴瘤中調節失調的B細胞的選擇,其中在BCR Fab結構域中存在豐富的N-聚糖位點。濾泡性淋巴瘤中B細胞上高度甘露糖化的Fab聚糖可能與甘露糖結合凝集素相互作用,導致不需要刺激B細胞的抗原刺激。
抗體糖基化
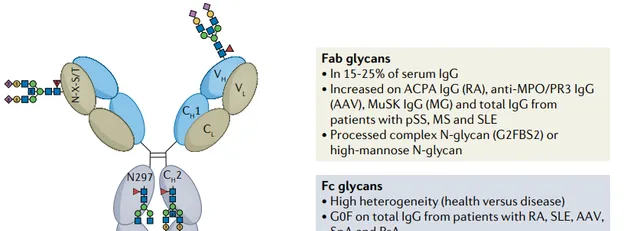
除了前進演化上保守的Fc N-糖外,15-25%的人IgG Fab區域可以攜帶N-糖基化共有序列。相對於Fc聚糖,Fab N-聚糖具有更高水平的半乳糖基化、唾液酸化,而巖藻糖基化減少。
Nat Rev Rheumatol. 2023
低水平的高甘露糖型結構發生,可能取決於N-糖基化位點的位置,糖基轉移酶的可及性。
初始人B細胞抗體庫幾乎沒有這樣的位點,因為只有 IGHV1-8 ,IGHV4-34, IGHV5-10-1,IGLV3-12 和 IGLV5-37 編碼N-糖基化基序。
Fab N-糖基化序列主要在體細胞超突變之後的抗原特異性免疫應答期間引入。
與Fc區域中的引入N-連線糖基化位點不同,Fab結構域中引入的N-糖基化位點不一定被聚糖占據,因為Fab N-糖基化位點的可及性可能受到限制。Fab N-糖基化位點主要出現在重鏈和輕鏈的抗原結合口袋附近(在框架或互補決定區)附近。
與Fc聚醣類似, Fab聚糖可以對抗體的穩定性產生影響 ,可能影響IgG形成 免疫復合物 或 聚集體 ,因此可能調節IgG效應功能(例如補體活化)。
除了對抗體穩定性和聚集的影響外,Fab聚糖對抗原結合的影響也不同,具體取決於糖基化共有序列的數量和位置。
Fab聚糖可以防止與自身抗原的結合,同時保持與外來抗原的交叉反應性,並且這種「原始救贖」可能使BCR擺脫自身反應性並逃避負選擇。
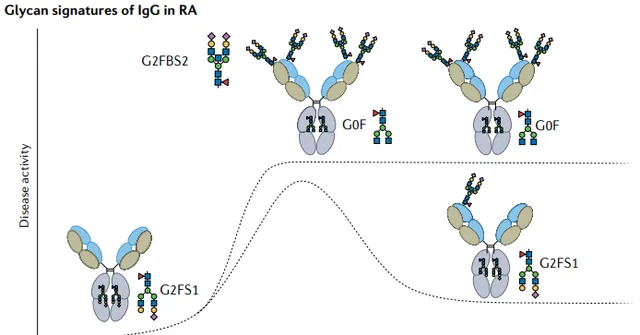
與血清 IgG 中 15–25% 的 Fab 糖基化相反,重鏈和輕鏈可變結構域中的 N-糖存在於 >90% 的風濕性關節炎 anti - ACPA IgG 自身抗體上。從炎癥部位(滑液)分離的自身抗體的Fab聚糖發生率為>100%,表明多個聚糖附著在一個ACPA分子可變區域。
anti-ACPA IgG Fab聚糖具有較高的雙糖化和半乳糖基化率,並且主要為二唾液酸化。ACPA Fab聚糖不僅在已發病的RA患者中含量豐富,而且在 疾病發病時增加 ,而且它們可 預測RA的進展 。
除ACPA外,其他與風濕性疾病相關的自身抗體的Fab聚糖發生率也很高。 原發性幹燥症候群 、 多發性硬化癥、 SLE 患者的獲得性N-連線糖基化位點的IgG發生率高於健康個體。
N-連線的糖基化基序也存在於抗肌肉特異性激酶受體自身抗體的可變結構域中,表明 Fab 聚糖在 重癥肌無力 發病中的作用。
值得註意的是,在接受阿達木單抗或英夫利昔單抗治療的患者中出現的 抗藥物抗體 也具有較高的Fab N-聚糖。
糖基化的臨床套用潛力
疾病診斷
與風濕性疾病相關的IgG特異性聚糖特征,有潛力作為預後標誌物,以改善 同質患者 群體的辨識。目前基於糖基化的方法尚未整合到臨床實踐中,部份原因是聚糖分析技術具有 挑戰性 且 成本高昂 。
更容易獲得的診斷工具和高通量篩選方法,例如基於凝集素的測定,可能在不久的將來能夠測量患者的特異性IgG糖基化譜。
疾病治療
特異性修飾蛋白質(特別是抗體)、組織和細胞的糖基化性狀可能為基於聚糖的療法提供一條新的途徑。
小鼠臨床前模型研究結果表明, 改變抗體Fc糖基化 可能是治療幹擾自身免疫過程的策略。
給予 使IgG Fc結構域糖化的酶可以影響小鼠的關節炎強度。內切糖苷酶S治療導致有效的IgG N-糖去除和隨後的抗炎表型,包括減少關節腫脹和募集炎癥效應細胞。
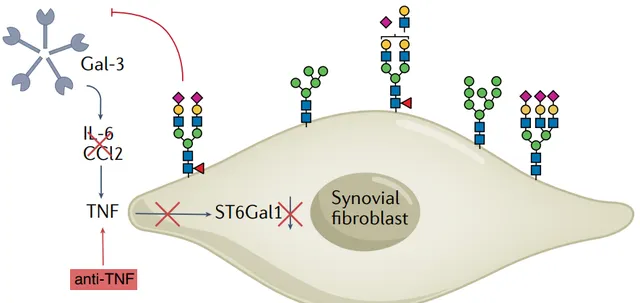
除了操縱抗體的糖基化外,滑膜成纖維細胞或其他細胞類別的表面糖基化的改變代表了減少炎癥的有希望的治療幹預。這種修飾可以透過細胞因子介導的酶機制的調節來實作,該調節決定唾液酸化或半乳糖基化水平。
Nat Rev Rheumatol. 2023
使用 TNF抑制劑 調節滑膜成纖維細胞中 糖基轉移酶 表達從而調節細胞表面糖基化的理論概念。
另一種具有成本效益且無毒的治療幹預措施是 直接給予甘露糖或改變聚糖生物合成的代謝物供應 。例如,透過施用GlcNAc增強己糖胺途徑可減少慢性炎癥和自身免疫。鑒於GlcNAc在IBD中的免疫調節作用,目前正在進行兩項臨床試驗(II/III期試驗(NCT01893606)和III期試驗(NCT02504060))中進行測試,此前一項試點研究顯示,接受GlcNAc的IBD患兒實作了臨床緩解。
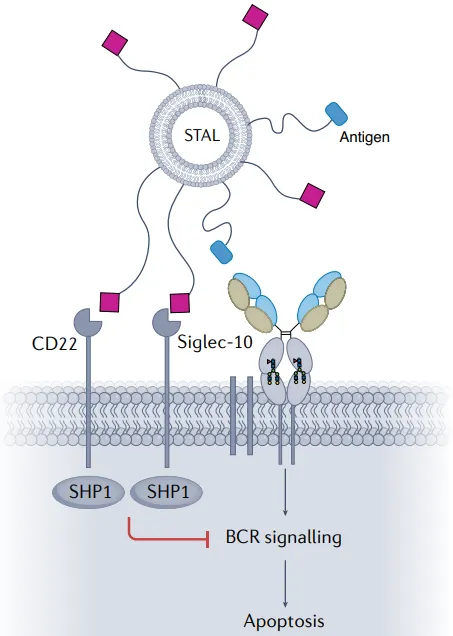
基於聚糖的幹預措施可用於自身反應性B細胞或其分泌的抗體細胞的靶向降解。例如, Siglec參與耐受誘導抗原脂質體(STAL)可以將Siglecs(B細胞受體訊號傳導的負調節因子)募集到自身抗原特異性B細胞的免疫突觸中。
Nat Rev Rheumatol. 2023
參考資料
Kissel, T. et al. Genetic predisposition (HLA-SE) is associated with ACPA-IgG variable domain glycosylation in the predisease phase of RA. Ann. Rheum. Dis. 81, 141–143 (2022)
Mandel-Brehm, C. et al. Elevated N-linked glycosylation of IgG V regions in myasthenia gravis disease subtypes. J. Immunol. 207, 2005–2014 (2021).
Collin, M., Shannon, O. & Bjorck, L. IgG glycan hydrolysis by a bacterial enzyme as a therapy against autoimmune conditions. Proc. Natl Acad. Sci. USA 105, 4265–4270 (2008).
Verhelst, X. et al. Protein glycosylation as a diagnostic and prognostic marker of chronic inflammatory gastrointestinal and liver diseases. Gastroenterology 158, 95–110 (2020).
Brandt, A. U. et al. Association of a marker of N-acetylglucosamine with progressive multiple sclerosis and neurodegeneration. JAMA Neurol. 78, 842–852 (2021)
Kissel T, Toes REM, Huizinga TWJ, Wuhrer M. Glycobiology of rheumatic diseases.Nat Rev Rheumatol. 2023 Jan;19(1):28-43.
Sun Y, Li X, Wang T and Li W (2022) Core Fucosylation Regulates the Function of Pre-BCR, BCR and IgG in Humoral Immunity. Front. Immunol. 13:844427












