在药剂学发展史上,药物递送载体是一些不具有生物活性的成分。近年来,纳米药物递送载体蓬勃发展,常见的纳米载体包括聚乳酸-羟基乙酸共聚物 [poly(lactic-co-glycolic acid),PLGA]、阳离子聚合物、金属元素等。然而,一些纳米载体在体内的安全性存在争议。研究发现,高浓度金纳米粒子可能与血液成分相互作用,并在体内特定组织中蓄积,从而产生细胞毒性[1]。因此,如何设计生物相容性高、可生物降解的纳米载体仍是提高药物有效性和安全性亟需解决的问题。
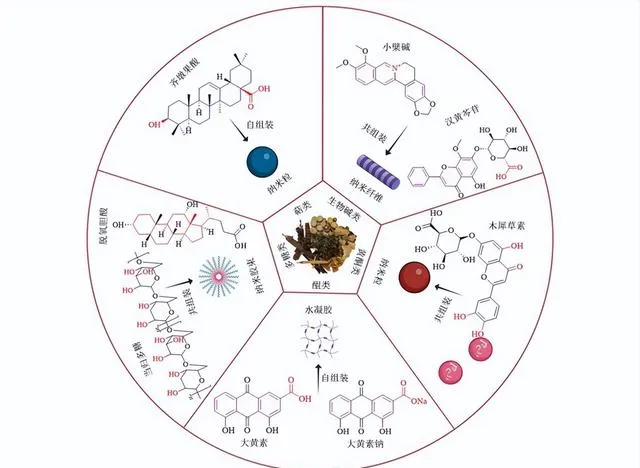
中药含有多种活性成分,已被广泛用于预防和治疗疾病。其不仅表现出显著的生物活性,而且具有良好的生物降解性和生物相容性。近年来,大量研究发现一些中药活性成分如萜类、生物碱、黄酮类、蒽醌类、多糖类,具备自组装或共组装形成药物递送载体的能力(图1)。相较于目前正在使用的一些药物递送载体,中药活性成分作为纳米载体具有较高的生物相容性、毒性和不良反应较小,且这些成分本身就具有药理活性,与被包载的药物能够协同作用,发挥「药辅合一」的效应。因此,许多中药活性成分有望成为新一代药物递送载体,发挥更强的药物递送和疾病治疗功能。
本文重点介绍了基于不同种类的中药活性成分作为药物递送载体的最新进展,总结了载体形成的理化机制,并概述了其在疾病治疗中的应用。通过深入剖析这些纳米载体的形成机制,为中药活性成分作为药物递送载体的研究提供理论基础,并为中药制剂现代化提供新的研究思路。
1 基于萜类化合物及其苷的载体
萜类化合物以异戊二烯为基本结构单元,是最丰富的中药活性成分之一。常见的萜类化合物为四环三萜和五环三萜。萜类化合物缺乏柔性的甾体侧链,其独特的刚性框架使其更容易通过弱分子间力在溶液中形成自组装纳米聚集体。
1.1 齐墩果酸
齐墩果酸是一种五环三萜类化合物,以游离酸的形式存在于马缨丹的根皮中,具有抗肿瘤等药理作用。Bag等[2]报道了齐墩果酸在苯、甲苯、5-三甲基苯、溴苯、硝基苯等25种溶剂中的自组装特性。研究发现其在苯、甲苯、氯苯、丙醇、异丙醇等溶剂中均表现出优异的自组装特性,并在19种液体中产生了强凝胶。
并且,在不同的溶剂中,齐墩果酸自组装形成的载体大小不尽相同。如在氯苯中,齐墩果酸形成的球形自组装体平均直径为(99.8±9.0)nm;而在异丙醇和水性二甲基亚砜介质中,齐墩果酸均形成2.5~5.0 μm的球形自组装体。同时,这些自组装体均呈现双层囊泡结构。研究者进一步研究了形成自组装体的主要作用力,发现除了非极性三萜类主链的分散相互作用外,羟基和羧基间的氢键是主要驱动力。最后,将这种球形自组装体用于包封化疗药阿霉素,发现其可以高效地包封阿霉素[3],提示齐墩果酸自组装体可以成为一种潜在的药物递送载体。
1.2 甘草酸和甘草次酸
甘草酸和甘草次酸是甘草的主要活性成分。甘草酸是一种五环三萜酸,水解脱去糖酸链即得到甘草次酸,二者都具有广泛的药理活性,如抗癌、抗炎等。甘草酸的分子结构由亲水性二葡萄糖醛酸单元和疏水性三萜苷元部分(即甘草次酸)组成。由于C-18空间构型的存在,天然甘草酸以2种差向异构体18α-甘草酸和18β-甘草酸存在,后者具有更强的生物活性和表面活性,在研究和实际应用中更常见。由于两亲结构和手性,甘草酸分子在水中表现出分级自组装行为[4-5]。且大量研究表明甘草酸的这种自组装行为可用于增加难溶性药物的溶解度,如黄芩素[6]、紫杉醇[7]、小檗碱[8]、鬼臼毒素[9]等。
此外,基于甘草酸的多种衍生物也被用于开发多功能软材料。如含醛甘草酸与羧甲基壳聚糖间可以通过希夫碱反应形成杂化水凝胶,这种水凝胶表现出独特而显著的抗炎作用和抗菌能力。体内实验表明,杂化水凝胶通过增强肉芽组织的形成、促进胶原沉积、减少细菌感染和下调炎症反应,促进未感染的和金黄色葡萄球菌感染的皮肤伤口愈合,有望成为生物医学应用中一种有前途的伤口愈合敷料[10]。
尽管甘草次酸缺少亲水性二葡萄糖醛酸单元,研究发现甘草次酸能在多种溶剂中自组装,并能够形成纳米尺寸的球形花状物体[11]。扫描电镜结果显示,花状物体由33~88 nm厚度的2D片组成,而2D片由30~40 nm横截面的交织纤维组成。此外,有研究发现甘草次酸和齐墩果酸也可以通过氢键和疏水作用自组装形成纳米载体。这种自组装载体不仅提高了齐墩果酸和甘草次酸的生物溶解度和稳定性,并且其发挥的抗肿瘤作用远大于游离的齐墩果酸和甘草次酸。此外,使用其作为药物载体来递送紫杉醇,可以增强抗肿瘤活性并最大限度地减少紫杉醇引起的肝损伤,可见具有相似药理活性组分的共组装可以提高药物载体的药理功效[12]。
1.3 熊果酸
熊果酸是一种存在于夏枯草等植物中的五环三萜类化合物,具有抗氧化、抗炎、抗菌、抗肿瘤等活性[13]。基于静电和疏水相互作用,熊果酸可以自组装形成纳米颗粒,其直径约为150 nm。与游离的熊果酸相比,熊果酸纳米颗粒表现出更高的抗增殖活性,并且可以显著增加CD4+ T细胞的活化,表明熊果酸纳米颗粒具有免疫治疗的潜力[14]。后续,熊果酸自组装体被用于递送多种药物,包括紫杉醇[15]、阿霉素[16]、阿司匹林[17]、造影剂吲哚菁绿[18]等。
同时,包载的药物性质也会影响自组装体的结构与形态。如熊果酸与紫杉醇自组装体呈现一种特殊的双层囊泡结构。这是由于熊果酸与紫杉醇结构中的苯环形成很强的疏水相互作用,进而使紫杉醇结构中与酰胺键相连的2个苯环接近熊果酸结构中的2个甲基。借助于双层囊泡结构,熊果酸和紫杉醇能直接通过被动扩散穿透细胞膜进入细胞,发挥强效的体内外抗肿瘤效应。
1.4 桦木酸及其衍生物
桦木酸是一种单羟基6-6-6-5五环三萜酸,分布于大枣、连翘等中药中。具有抗肿瘤、抗炎、抗菌、抗病毒和抗糖尿病作用[19-20]。桦木酸可在多种有机溶剂和醇水混合物中自组装形成凝胶或部分凝胶,提示其可作为药物递送载体[21]。桦木酸除了可以自组装,还可以与其他分子通过共组装的形式实现药物递送。
如Cheng等[22]将桦木酸与壳聚糖通过分子内和分子间氢键共组装形成两亲性前药分子。该制剂能与光敏剂Ce6通过π-π堆积结合,形成具有空心壳网络结构的无载体光化疗纳米粒。这种纳米粒具有生物相容性好、可生物降解、低毒高效的特点,可协同抗细胞程序性死亡-配体1单抗,从而发挥抗肿瘤化疗/光动力疗法/免疫治疗效应。桦木酮酸是桦木酸的衍生物,具有相似的药理作用。同样,桦木酮酸也能通过分子间π-π堆积相互作用和疏水相互作用与Ce6共组装,形成球状纳米药物,进而增加Ce6在水中的溶解度,在体内外表现出化学/光动力的协同抗肿瘤效应[23]。
1.5 人参皂苷
人参皂苷是人参的主要活性成分,按其皂苷元结构分为齐墩果酸型五环三萜皂苷和达玛烷型四环三萜皂苷。其中达玛烷型人参皂苷包括二醇型人参皂苷(PPD)和三醇型人参皂苷(PPT)。PPD型皂苷的糖链位于苷元碳骨架的C-3和/或C-20位,包括人参皂苷Rb1、Rd、Rg3、Rp等;PPT皂苷的糖链位于苷元碳骨架的C-3、C-6和/或C-20位,包括人参皂苷Re、Rg1、Rg2、Rp等。人参皂苷具有调节免疫、抗疲劳、调节代谢和抗氧化等多种活性[24]。近年来,大量研究报道了基于人参皂苷的多种药物递送系统[25]。
人参皂苷骨架中的四环三萜呈现疏水性,而糖基又呈现亲水性。这种两亲性使人参皂苷在水溶液中表现出自组装倾向,形成胶束结构。胶束的形成不仅能包载药物,提高药物在水中的溶解度,也改变其在溶液中的理化性质。如自组装的人参皂苷Rb1胶束可以负载双氯芬酸,得到胶束型滴眼液。与市售双氯芬酸滴眼液相比,胶束型滴眼液可显著改善药物的角膜渗透性及抗炎功效[26]。
除了自组装外,人参皂苷还可与其他药物分子共组装形成胶束,起到协同治疗的作用。Li等[27]将雷公藤红素和人参皂苷Rp共价结合到聚乙二醇片段的2端,从而构建了双亲性聚合物。这种具有「疏水-亲水-疏水」结构的聚合物材料可将雷公藤红素封装在胶束的疏水内核中,改善雷公藤红素的生物利用度,从而提高抗肿瘤效应。此外,将人参皂苷Rg3引入到泊洛沙姆/磷脂酰胆碱/胆固醇聚合物胶束中,可以增强胶束对人结肠癌Caco-2细胞的药物渗透,增加口服给药的肠道吸收水平。
有趣的是,不同的人参皂苷与同一种药物分子形成的载体形式也不尽相同。Guo等[28]考察了多种人参皂苷与柴胡皂苷形成自组装体的能力。发现人参皂苷Ro和柴胡皂苷主要形成纳米囊泡,人参皂苷Rg1和柴胡皂苷可形成球形纳米胶束,而人参皂苷Rb1和柴胡皂苷可形成蠕虫形纳米胶束[29]。表明影响自组装体行为的主要因素是人参皂苷含有的糖基链大小和种类。
脂质体是一种在药物递送领域应用非常广泛的载体。其主要由磷脂双分子层、胆固醇组成,其中胆固醇主要发挥稳定磷脂双层膜的作用。人参皂苷的四环三萜骨架与胆固醇的结构类似[30],那么其是否可以作为胆固醇的替代物用于制备脂质体?通过考察了多种人参皂苷与磷脂形成双分子层的能力。发现人参皂苷Rg3、Rg5和Rp可代替胆固醇制备多功能脂质体,不仅能增强脂质体的稳定性,而且具有控制药物缓释、增强药物治疗效果、延长脂质体血液循环时间的特点[31-33]。
此外,不同结构的人参皂苷也能赋予载体不一样的特性。研究显示,人参皂苷Rg5能与肿瘤细胞膜上的葡萄糖转运蛋白高效结合,因此人参皂苷Rg5脂质体具有肿瘤主动靶向效应[34]。而且,人参皂苷Rg5脂质体在体内递送时还具备隐形效应。其能通过皂苷二糖基团的第3骨架减少脂质体表面调理素的吸附,增加载脂蛋白E的吸附,从而延缓巨噬细胞对脂质体的清除。将人参皂苷Rg5脂质体用于包载紫杉醇(G-紫杉醇)可以实现比市售紫杉醇制剂(Abraxane®、力扑素)更显著的抗肿瘤效应,并阻止耐药性的产生。进一步的研究证实,G-紫杉醇通过抑制P-糖蛋白外排功能和调节肿瘤细胞的自噬,逆转了已存在的耐药性并阻止了获得性耐药的发展。
1.6 其他萜类
有研究发现来自于茯苓的三环、四环类三萜化合物及来自于枫香的五环类三萜化合物都可以自组装成可注射凝胶[35-36]。这些凝胶剂具有优良的缓释性、生物可降解性、生物相容性,在肿瘤等治疗领域可发挥协同作用。
2 基于生物碱的药物载体
生物碱在许多中药中广泛存在,大多数有复杂的环状结构,且含有N元素,呈现碱的性质。生物碱是植物在应对环境胁迫时产生的次生代谢产物,往往具有一定的毒性。在药理方面,其表现为抗病毒、抗菌的活性。生物碱可以与多种中药活性成分共组装,以其自身作为药物和载体作为药物和载体,从而发挥更强的药效。
2.1 小檗碱
小檗碱是从黄连中分离得到的一种异喹啉类生物碱,是黄连的主要抗菌成分。研究发现小檗碱的季铵离子和苯环结构可以与黄酮苷类化合物自组装形成具有合适粒径的纳米载体。小檗碱能与黄芩中主要活性成分黄芩苷和汉黄芩苷分别形成自组装体(表1),并且具有截然不同的纳米级形态。扫描电镜分析发现黄芩苷和小檗碱自组装形成纳米粒,而汉黄芩苷和小檗碱则自组装形成纳米纤维[37]。
有趣的是,这2种纳米载体在抗菌性能上也截然不同:黄芩苷和小檗碱自组装形成纳米粒具有比游离的小檗碱更强的抗菌作用,而汉黄芩苷-小檗碱纳米纤维的抗菌作用则比游离的小檗碱要弱。可能是由于2种自组装体表面性质不同引起的。黄芩苷和小檗碱自组装形成纳米粒具有的亲水性表面使其更容易附着在细菌上,并持续释放出小檗碱,导致局部药物浓度较高,有利于杀死细菌;汉黄芩苷-小檗碱纳米纤维具有的疏水性表面使其很难附着在细菌上,因此抗菌效果较差。

除了黄酮类化合物,小檗碱还能与有机酸成分自组装。如小檗碱和肉桂酸自组装形成的纳米粒,在这个过程中无需任何特殊处理。该纳米粒在抑制多重耐药金黄色葡萄球菌方面远优于一线药物诺氟沙星、阿莫西林、四环素等[38]。
除了协同发挥药效,小檗碱可以通过与毒性较大的药物自组装来对抗其毒性。马兜铃酸是细辛和马兜铃等传统中药的成分之一,其具有显著的肾毒性和肝毒性。近年来研究发现,含马兜铃酸的中草药与小檗碱原产药黄连合用可显著降低马兜铃酸的溶出。Wang等[39]发现小檗碱和马兜铃酸能通过静电吸引、π-π堆积和疏水相互作用共组装形成线性异质超分子,从而降低马兜铃酸在汤剂中的浓度。为理解传统中医使用不同药性的中药来减轻毒性提供了一种新思路。由于其强大的共组装能力和抗菌潜力,小檗碱已成为中药活性成分作为递送载体研究最多的成分之一,目前已经有报道的共组装体见表1。
2.2 喜树碱及其衍生物
喜树碱是一种天然植物生物碱,可以靶向细胞内DNA拓扑异构酶,表现出有效的抗肿瘤活性[44]。喜树碱本身的水溶性较低,因此生物利用度较低。近年来研究发现喜树碱可以自组装成螺旋状纳米带。和游离的喜树碱相比,喜树碱自组装体具有更强的肿瘤抑制效应。此外,喜树碱衍生物(羟喜树碱、伊立替康等)也可以自聚集成扁平和圆柱形纳米带。目前,喜树碱和其衍生物形成的自组装纳米带已被报道用于递送阿霉素[45]、类姜黄素[46]等多种其他化疗药物,以实现肿瘤的协同治疗。
2.3 血根碱
博落回的提取物血根碱具有抗炎、抗氧化、抗微生物、改善肠道健康、抗癌症等生物学活性。Wang等[47]发现血根碱能与黄芩苷通过静电吸引、π-π堆积、氢键等非共价键自组装形成无载体二元小分子水凝胶。这种小分子凝胶具有可塑性和可注射性,并且具有显著的抗菌效应和生物相容性,可作为促进伤口愈合的敷料。
3 基于黄酮类化合物及其苷的载体
黄酮类化合物是2个苯环通过3个碳原子相互连接而成的一系列化合物的总称。常见的药理活性包括抗肿瘤、抗菌、抗突变活性、心血管保护作用及抗氧化能力[48-49]。其中的多种儿茶酚类黄酮,如木犀草素、槲皮素、山柰酚、黄芩素和儿茶素,可以与包括铁离子(Fe3+)在内的金属离子结合进行配位自组装。与金属离子的配位自组装不仅会影响黄酮类化合物本身的稳定性,也可以表现出更强甚至全新的药理活性。
3.1 木犀草素
木犀草素是一种天然黄酮类化合物,存在于多种中药中,如金银花、紫苏等,具有消炎、抗过敏、降尿酸、抗肿瘤、抗菌、抗病毒等药理活性[50]。木犀草素中含有1个羰基和4个酚羟基,易与金属离子配位,并自组装形成纳米粒[51]。与木犀草素相比,纳米粒表现出高溶解度,并且表现出显著增强的抗氧化作用。重要的是,Fe3+配位纳米粒表现出超分子光热效应,使其发挥光热剂的作用。体外抗肿瘤实验表明,纳米粒可以更有效地杀死癌细胞。可见,配位自组装在中药现代化方面具有广泛的用途和前景,并且可能对推进癌症治疗具有重要意义。
3.2 槲皮素
槲皮素是一种广泛存在于柴胡、桑叶等中药的类黄酮化合物。其结构中包含许多具有氧化还原活性的酚羟基,表现出抗氧化、抗缺血、神经保护等药理作用[52]。类似于木犀草素,研究表明其也可与多种金属离子形成络合物[53]。且该配合物的活性显著高于槲皮素本身。如槲皮素-钴复合物和槲皮素-铬(III)复合物比槲皮素具有更高的1,1-二苯基-2-三硝基苯肼自由基清除活性,并且槲皮素与多种金属离子形成的络合物都比槲皮素具有更强的抗肿瘤效应[54-56]。此外,槲皮素-铜络合物具有显著的DNA切割效应,提示其有望在抗肿瘤、抗菌等方面发挥潜在作用[53]。此外,作为一种疏水性分子,槲皮素与亲水性分子如壳聚糖、透明质酸等缀合后可以自组装形成胶束,用于递送治疗性药物(如紫杉醇)和生物成像试剂(如银纳米粒)等[57-59]。
3.3 黄芩苷
黄芩苷是黄芩的活性成分,具有抗炎、抗菌的作用[60]。其结构中的2个酚羟基、3个羟基、1个羰基和1个羧基,可以通过配位键和氢键与金属离子如Al3+自组装形成纳米粒。基于此,Jia等[61]开发了一种口服胰岛素递送载体,可以保护胰岛素在胃部强酸性条件下不被降解,而在肠道碱性条件下释放胰岛素并延长其保留时间。同时,黄芩苷可通过细胞旁路途径改善胰岛素的吸收水平,产生显著的降血糖效应。此外,黄芩苷本身作为一种两亲性化合物,能够与小檗碱形成共组装,并提高小檗碱的溶解度。
3.4 葛根素
葛根素是一种来自葛根的天然生物活性异黄酮类化合物,具有扩张脑血管和冠状动脉的功能,可以改善心脑血管的血液供应。其无需任何结构修饰即可自组装形成pH敏感的水凝胶。Pang等[62]对葛根素成胶的机制进行研究。发现在过饱和浓度下,凝胶化过程是由成核引发的,然后纤维从成核中心迅速生长。随着过饱和度的增加,纤维生长类型从「线性」转变为「非线性」,导致结构更致密,分形维数更高,力学性能更强。由于可生物降解性且无毒性,这种自组装葛根素水凝胶可以作为聚合物凝胶的替代品。
4 基于多糖的载体
中药多糖具有生物可降解性、高安全性和生物相容性等特点,表现出免疫调节、抗炎、抗氧化、抗肿瘤等生物活性。从结构上看,中药多糖由不同长度的糖链及其支链组成,糖链中含有大量的羟基、羧基、醛基等亲水基团,因此可以通过将疏水基团缀合到多糖分子上,合成两亲性聚合物,从而使其自发聚集成胶束。此外,多糖也可以通过化学或物理交联形成水凝胶[63]。不同于均一性分子形成的水凝胶,多糖形成的水凝胶具有不同尺度的有序结构,因此具有优异的性能,在材料科学中具有广阔的应用前景。
4.1 灵芝多糖
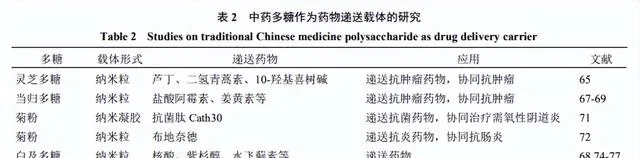
灵芝多糖是灵芝的主要活性成分之一,具有抗肿瘤、免疫调节、抗氧化、降血糖等药理作用。灵芝多糖由葡萄糖、甘露糖、半乳糖、木糖、岩藻糖和阿拉伯糖等组成,但只有β-葡聚糖(纯葡萄糖聚合物)被认为是灵芝多糖中的活性成分之一[64]。
将亲水的灵芝多糖与疏水的药物分子缀合,可以自组装形成纳米粒。如Zheng等[65]将疏水的芦丁和二氢青蒿素(DHA)分别通过硼酸酯和二硫键连接到灵芝多糖上,并用于包载10-羟基喜树碱(HCPT),形成芦丁-羧基苯基硼酸-灵芝多糖-二硫代二丙酸-DHA/HCPT聚合物纳米颗粒。在微酸性肿瘤微环境中,硼酸酯键首先断裂,芦丁被释放。然后,在肿瘤细胞高浓度的谷胱甘肽作用下,二硫键断裂,DHA和HCPT被释放到细胞内。体内外实验表明,基于灵芝多糖的pH和谷胱甘肽双响应纳米颗粒可以有效杀死肿瘤细胞,抑制肿瘤生长,并且不良反应较小。
4.2 当归多糖
当归多糖是当归的主要有效成分,具有较强的免疫调节、抗氧化、抗肿瘤和保护肝脏活性[66]。近年来,当归多糖作为药物载体的研究受到广泛关注。由于其具有高密度的半乳糖和支链结构,当归多糖对肝脏中分布广泛的脱唾液酸糖蛋白受体具有高亲和力,因此基于当归多糖开发的药物方面具有潜在的应用前景。通过将亲水的当归多糖与疏水性分子如脱氧胆酸等进行嵌合,得到两亲性分子。这种分子进一步自组装能形成纳米粒,用于包载亲水性药物(如盐酸阿霉素)[67]或疏水性药物(如姜黄素)[68-69]。研究表明,当归多糖不仅具有药物载体的作用,而且还起到改善肿瘤微环境、增强免疫功能的作用,与化疗药物产生协同抗肿瘤效应。
4.3 菊粉
菊粉是一种常见的中药,是菊科植物野菊的干燥头状花粉,主要由果糖和葡萄糖组成。菊粉是一种益生元,通过在体内产生短链脂肪酸(乙酸、丙酸、丁酸)来改善肠道微环境,降低pH值,促进双歧杆菌和乳酸菌的生长[70]。因此,菊粉具有恢复酸性微环境和促进益生菌增殖的能力。
Wang等[71]报道菊粉能够和明胶共组装成核心纳米颗粒,后续通过化学交联作用可将其稳定化为核壳纳米凝胶(CSNGs)。该研究通过静电作用将抗菌肽Catp0包载到CSNGs中,用于需氧性阴道炎治疗。在致病菌分泌的明胶酶作用下,纳米凝胶能够缓慢将Catp0和菊粉释放,从而发挥双重治疗效应。
研究显示,菊粉在上消化道不能被代谢,在结肠区域微生物作用下才能被代谢。因此,其可以作为一种结肠靶向给药的递送载体。Sun等[72]在菊粉上通过二硫键修饰了一种疏水基团4-氨基苯硫酚,得到两亲性菊粉衍生物。这种衍生物可以进行自组装形成纳米粒,并用来包载疏水性药物如布地奈德。在炎症性肠病的氧化应激环境下,二硫键发生还原性裂解,释放出药物和菊粉分子,产生协同抗炎作用。
4.4 白及多糖
白及多糖是从白及中分离得到的主要活性成分,其具有收敛止血、促进伤口愈合的作用[73]。白及多糖富含甘露糖,而甘露糖可以与巨噬细胞表面高表达的甘露糖受体结合,从而被介导内吞进入巨噬细胞。那么是否可以将白及多糖作为载体,将药物靶向递送至巨噬细胞呢?Dong等[74]在白及多糖上修饰了含氮基团乙二胺,使其具有大量阳离子。这种阳离子化的白及多糖与呈现负电的核酸自组装形成纳米粒,并将核酸靶向递送至巨噬细胞。
用疏水基团(烷基、芳烷基和脂肪酸)修饰亲水性多糖,可产生两亲性多糖衍生物,从而提高捕获疏水性抗癌药物如多西紫杉醇(DTX)、阿霉素的能力[68,75-76]。疏水基团的取代度值会影响自聚集纳米粒子的性能。如随着硬脂酸部分取代度的增加,白及多糖-硬脂酸纳米颗粒中DTX的累积释放百分比、临界聚集浓度和平均粒径均下降,而包封率和负载量增加[77]。同时,胶束壳和负载的药物之间存在一些化学键,这些化学键可以响应某些刺激而断裂[78]。此外,由于中药多糖巨大的比表面积和丰富的活性基团,白及多糖本身也可以与靶向配体如叶酸、生长因子、抗体和肽等相连,以实现对特异性组织的靶向,提高给药效率[76]。
中药多糖作为药物递送载体的研究见表2。
5 基于其他中药成分的载体
5.1 醌类
醌类化合物是一类含有醌结构的有机化合物,具有良好的生物相容性、氧化还原特性和可修饰性。醌类化合物因其独特的化学性质和多重功能,可作为药物递送载体,通过调控其结构和性质,实现对药物的高效递送、控制释放及提高药物的生物利用度。大黄酸是一种来源于大黄的醌类化合物,是大黄中的主要活性成分之一,具有刺激肠道蠕动、抗炎、抗氧化、抗菌活性。研究报道大黄酸在pH 8.0~9.4时可以自组装成基于纳米纤维网络的水凝胶[81]。
这种水凝胶可以使大黄酸缓慢释放,从而实现更强和更持久的抗炎效应。该研究通过紫外光谱、圆二色谱、X射线衍射分析和理论计算,提出了一种可能的大黄酸水凝胶自组装过程:在弱碱性条件下,部分大黄酸分子去质子化形成大黄酸钠盐。大黄酸单体和大黄酸钠盐通过π-π堆积形成二聚体。由于羧酸离子间的静电排斥,2个分子倾向于以相反的方向排列。随后,二聚体进一步组装成三聚体、四聚体和更高阶的聚集体,最终交联形成3D网络。
5.2 酚醚类
和厚朴酚是主要来源于厚朴的一种酚醚化合物,具有抗炎[82]、抗癌[83]、抗氧化[84]等药理功效。尽管和厚朴酚表现出多种显著的药理功效,其溶解度低、生物利用度低、代谢快等缺点,限制了其在临床上的广泛使用。Ji等[85]通过分子间氢键和疏水相互作用将和厚朴酚自组装成纳米粒子。这种纳米粒子本身可以作为载体,同时又是药物,增加了和厚朴酚的溶解度和稳定性。此外,该纳米粒子在肿瘤区域具有高渗透长滞留效应而表现出优异的肿瘤靶向能力。
5.3 二酮类
二酮类化合物姜黄素是姜黄中的主要活性成分,具有抗氧化、抗炎、抗肿瘤、免疫调节等多种药理活性[86]。姜黄素可以与金属元素钆(Gd)进行配位作用,形成姜黄素-Gd纳米粒。姜黄素与Gd3+配位组装的纳米粒子显著提高了姜黄素的生物利用度和载药量。Wen等[87]将姜黄素-Gd纳米粒包封光敏剂吲哚菁绿,显著提高了肿瘤化疗联合光动力治疗的治疗效应。
5.4 蛋白质类
最近有报道称,传统中药汤剂中形成的胶体与其疗效密切相关[88]。这种胶体聚集体可穿透单层Caco-2细胞,这种现象已在60种中成药制剂和24种草药的煎剂中观察到[89]。考虑到水几乎是中药煎煮的唯一溶剂,且许多生物活性化合物都是疏水性的,推测煎煮过程(通常认为是长时间的煮沸)会诱导两亲性生物大分子(如蛋白质和多糖)和疏水性生物活性成分自发形成复合物,两亲性物质可以作为疏水性物质的载体来提高它们的包封率。
受此启发,Weng等[90]探索了太子参蛋白作为药物递送载体的潜在应用。太子参蛋白来源于太子参,具有显著抗氧化的功效。研究通过热处理模拟中药煎煮的过程,将太子参蛋白与疏水性药物姜黄素自组装形成了纳米复合物[91]。这种纳米复合物不仅提高了姜黄素的生物利用度,还可以协同发挥药效,具有更强的抗氧化效应。
5.5 挥发油类
挥发油是从植物的叶、花、皮、芽、种子、茎、根、皮和豆荚等不同部位分离出来的次生代谢物[92]。是极性和非极性化合物的复杂混合物。从药用植物中提取的挥发油具有抗糖尿病作用、抗真菌作用、抗痉挛作用及抗炎和抗氧化活性[93]。
丁香酚是一种酚类芳香族化合物,主要从丁香的挥发油中获得。这种简单的苯酚具有多种药理特性,如抗氧化、抗炎和抗癌活性等[94]。研究证明,丁香酚通过改变膜脂肪酸、破坏细胞质膜完整性或抑制酶活性等多种作用机制,显著抑制细菌和真菌的生长和繁殖[95-97]。但丁香酚的水溶性和稳定性差,限制了其作为抗菌剂的广泛应用。Fan等[98]在不添加任何助表面活性剂的情况下,由槐脂和丁香酚作为原料自组装制成稳定的纳米乳剂,平均粒径小于200 nm。与丁香酚相比,这种纳米乳剂对革兰阳性和革兰阴性食源性细菌的抗菌活性都有显著提高,为开发抑制致病性污染或细菌感染的抑菌剂提供了一种绿色有效的方法。
欧芹挥发油是一种从广泛分布于地中海地区的植物欧芹中提取的挥发油,在传统医学中用于治疗胃酸和消化问题,及预防呼吸道感染等[99]。Miranda等[100]将欧芹挥发油作为纳米颗粒制剂的一种纳米结构剂,制备了具有高捕获效率和良好稳定性的纳米脂质体,然后将这种胶体系统结合到水凝胶中。欧芹挥发油具有纳米颗粒的活性成分和纳米结构的双重关键功能,同时该凝胶具有持续释放行为和储库效果,适用于长期局部递送。
已有研究表明,多种中药挥发油可作为脂质体原料。除了欧芹挥发油,Carbone等[101]将迷迭香、薰衣草和牛至属挥发油作为纳米脂质载体,这种脂质载体具有增强生物相容性并降低纯油的细胞毒性的作用,可用于联合给药氯霉素,具有协同效应。实验结果表明,将这些挥发油作为固有油性成分制备纳米脂质体,不仅具有潜在的抗菌活性,还延长了抗生素的体外释放时间,是一种有望提高局部念珠菌病药物有效性的策略。
6 结语与展望
本文总结了近年来中药活性成分作为载体材料在药物递送系统中的应用,分析了这些化合物形成药物递送载体的机制,并展望了中药活性成分作为载体材料在药物递送系统领域的发展潜力。这些发现有助于更深入地认识中药活性成分的结构特征及其形成递送载体的机制,同时也为构建更有效的药物递送系统提供了新的启示,为中药活性成分实现「药辅合一」开辟了新的研究方向和可能性。
不同类型的中药活性化合物形成药物递送载体的机制与其结构特征密切相关。四环三萜和五环三萜等萜类化合物具有刚性甾体骨架,这种结构间的疏水相互作用可使其在溶液中具有自组装特性。萜类化合物往往含有羧基,可以与其自身或其他化合物的羟基形成氢键,从而形成自组装或共组装体[102]。生物碱是一类含氮杂环化合物,这类荷正电的化合物可以通过静电作用与含有羧基等荷负电的化合物组装构建药物递送体系。此外,生物碱中的芳香环结构也容易与自身或其他含有芳香环的化合物通过π-π堆积进行组装[103]。
黄酮类化合物具有苯环结构,π-π堆积是其最常见的组装机制。特别的是,诸如木犀草素[51]、槲皮素[104]等黄酮是一类具有多羟基结构的化合物,这些空间上接近的2个羟基,或4-位羰基与其在空间上接近的羟基,可以与金属离子通过配位作用形成螯合组装体系。醌类化合物通常具有平面结构,其中包含的芳香环形成了平行的π电子体系,这种平面结构有助于醌类化合物之间π-π电子体系的相互作用而构成组装体系[81]。中药多糖里含有大量的羟基、羧基、醛基等亲水基团,往往可以与疏水性基团共价结合形成两亲性聚合物,从而组装形成胶束、纳米粒等药物递送系统。
相比于传统药物递送系统,将中药活性成分开发为药物递送纳米载体具有显著的优势。
(1)一些中药活性成分具备通过自组装形成「自递药系统」的能力,可以充分利用其自身性质形成递送系统,实现「药辅合一」。如和厚朴酚通过分子间氢键和疏水相互作用自组装成纳米粒子,这种纳米粒子本身可以作为载体,同时又是药物,可明显提高载药量[85]。
(2)传统制剂在靶向方面需要复杂设计,而一些中药活性成分具有天然的靶向性。如在当归多糖上嵌合脱氧胆酸,赋予了当归多糖两亲性,进而自组装形成纳米粒[67]。由于当归多糖具有高密度的半乳糖和支链结构,对肝脏中分布广泛的脱唾液酸糖蛋白受体具有高亲和力,使当归多糖纳米粒具有肝脏靶向性。
(3)将中药活性成分通过配位作用与金属离子络合,可增强化合物本身的稳定性。如将槲皮素与钴或铬配位形成的复合物,槲皮素的稳定性增强[56]。
(4)相比于化学合成的药物递送载体,中药活性成分作为递送纳米载体还具有生物相容性高、毒性小的特点。由于这种系统可以通过自组装或共组装的形式构建得到,其制备工艺较为简单,易于工业化生产,并且具有绿色环保的特性。
然而,目前关于中药活性成分作为递送纳米载体的研究还有一定的局限性。后续研究者利用中药活性物质开发新型药物递送系统时,可重点考虑以下几个方面:
(1)不同类型的中药活性成分形成药物递送系统的机制不同,在设计时可以根据成分的类别和结构特性设计适宜的体系,以提高系统的稳定性、载药和释药性能;
(2)目前以中药活性成分作为药物递送系统主要集中在抗肿瘤药物递送和创面药物递送领域,而中药活性成分的药理作用广泛,其作为递送系统在抗炎、抗氧化、抗菌、抗病毒等领域中可进一步拓展;
(3)虽然人参皂苷脂质体已进入临床试验阶段,未来有上市的可能性,但生物碱、黄酮类、醌类、多糖类等活性成分作为药物递送系统目前尚未有进行临床试验的报道;
(4)虽然中药的生物相容性较好,但是提取出来的活性成分作为纳米递药载体是否会在体内滞留、蓄积,并产生毒副作用并不完全清楚。因此,中药活性成分作为药物递送系统的安全性与成药性还需进一步考察。
中药活性物质各个成分间复杂的相互作用是其发挥整体药效的基础。以中药活性成分作为新一代载体在药物递送领域逐渐崭露头角,为实现中药「药辅合一」开辟新的研究方向,为中药创新制剂的开发提供新的发展机遇。
来 源:韩 静,包纯洁,段嘉伦.中药活性成分作为药物递送纳米载体的研究进展 [J]. 中草药, 2024, 55(16): 5678-5692.











