前言
核盘菌是一种寄主植物和范围广泛的病原真菌,油菜菌核病便是该病原真菌引起的主要病害之一,油菜菌核病会导致植株减产作物质量下降乃至坏死,严重影响我国长江中下游油菜主产地区的产业发展,研究核盘菌的分子致病机制可以为菌核病的绿色防治和抗病作物育种提供理论依据,
BTB,蛋白是一种广泛真核生物中的超蛋白家族中的蛋白,BTB,蛋白在人体以及动物的研究中被报道地较多,在植物和真菌中的研究相对比较滞后。

研究报道植物BTB,蛋白家族基因参与植物抗逆性、抗病性、泛素化、离子通道、细胞降解及循环调控过程,在真菌中,有研究发现,BTB,蛋白在与毒素合成、蛋白互作调控致病力相关,目前,核盘菌的含有,BTB,结构域的基因功能未知,是值得研究的一个课题,
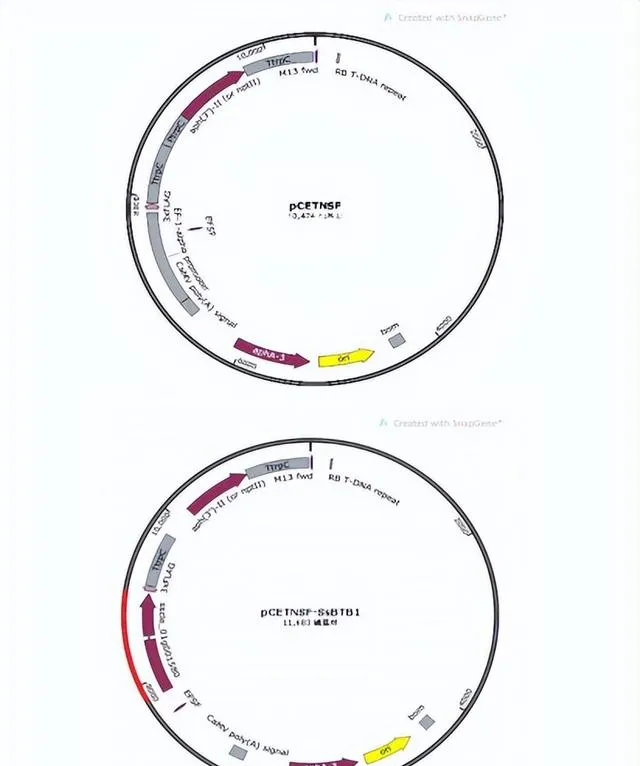
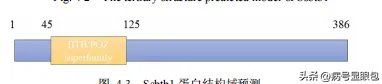
本实验亦筛选出一个含有,BTB,结构域的基因,命名为,SSBTB1.生物信息学预测Ssbtb1,蛋白属于,BTB/POZ,家族,含有,Kelch,重复元件,主要参与细胞调控相关,本实验利用分割标记法以及子囊孢子单孢分离纯化法顺利获得纯合的SsBTBI基因敲除菌株。

并通过农杆菌转化法成功获得基因敲除回补菌株,使得突变体表型恢复至野生型表型,观察基因SsBTBI在核盘菌中的功能影响。
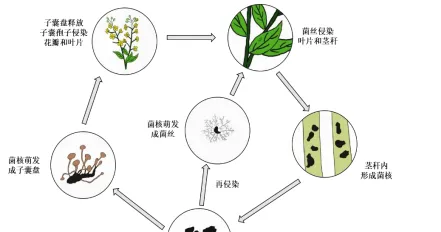
核盘菌的生活史
核盘菌抗逆性很强,核盘菌的菌核能够在土壤中存活长达8年,菌核是核盘菌的病害循环中最主要的初侵染源,支撑着核盘菌度过各种不良的生活环境。
在良好的湿度、气温环境下,会重新诱导子囊盘萌发,释放子囊孢子入侵寄主植物,同时寄主植物也会被直接由菌核阶段生长出的菌丝侵染157,核盘菌可以通过在田间传播并且侵染植株,在运输以及存储的过程中也会进行传播病害。
核盘菌主要直接伤害植物的根茎,从而导致植物的根茎坏死9,从核盘菌侵染寄主植物开始,就会立即杀死寄主本身细胞并且吸收寄主植物的养分,在寄主植物上生长发育,染上菌核病的寄主植物的质量直线下降,严重时甚至会直接导致寄主植物的死亡10121。
核盘菌的菌丝在,0C-30°℃的温度条件下都可以生长,在,20°℃-25℃℃的温度范围中,核盘菌生长最适宜,核盘菌有很强的耐酸碱能力,在酸性和碱性条件下都可以正常萌发和生长。
其中酸性环境下核盘菌可以更好地生长131,菌丝需要在潮湿的环境才可以生长,环境中需要达到85%的湿度,否则菌丝将会生长缓慢甚至不能生长,在核盘菌处于不利环境时,便有菌核的产生!核盘菌侵染植物时能够以菌丝形态在寄主植物上短暂存活。
核盘菌的菌丝为透明状或浅褐色状,有隔膜以及分支,当外界环境适合时,大量的菌丝体会产生侵染垫并且快速侵染寄主植物1719,核盘菌在适宜的环境下会生长出子囊柄及子囊盘,子囊盘的萌发率和相对湿度有关系,在相对湿度在85%以上萌发率会提升,紫外线对于子囊盘有明显的抑制作用,光照4h后子囊盘便会失去萌发子囊孢子的能力0,子囊孢子。
一般侵染点在于植株老化脱落的叶片或者是植物的伤口处侵入,从而使寄主植物染病,不易侵染健康的植株2,寄主植物感染菌核病后,感病植株通过接触继续感染其他健株,感病后会感染其他的健株。
核盘菌在侵染不同的寄主或者同一寄主的不同位置后的症状有差异,在植物叶片受到侵染时,菌丝在叶片上生长,会在叶片的表面形成侵染垫侵入表皮细胞,通过细胞间的扩展,侵入表皮细胞的菌丝会进一步到叶肉细胞层产生分支。

在细胞间或者穿透细胞扩展,直到有水渍状的病斑,便会快速地侵染叶柄以及茎秆部位123-251,被侵染后的茎部会出现黑斑和菌丝,并且逐渐坏死的情况,在侵染初期,大多情况症状不明显,而在侵染后期,菌丝侵染逐渐深入。
到达一定程度后,植物的主干部位也会被侵染,这种情况会导致植株的萎蔫126-28,随着侵染的加深,侵染部位进行外部泛白到逐渐分解的过程,最后只剩下维管束组织,组织表面不会有明显菌丝的存在,茎秆内会产生菌核。
菌核及菌核形成相关因素
菌核是菌核病流行的关键因子,其外表坚硬,起到保护病原菌的作用!,菌核是丝状真菌中所专有的功能,菌核病的生活史中非常重要的一部分,菌丝折看盘结的一种深色坚硬的形态,包括外壳及皮层组织和髓部。
部有着各色营养丝汇集交织,存储着很多营养物质,菌核的生命力很顽强,抗逆性也很强,使得病原菌度过不良环境,菌核的外壁含有黑色素,从而使得菌核外表呈现黑色,有着影响菌核菌丝萌发和帮助病原菌抵御不良环境的作用。
从菌丝到菌核的生活史有三个阶段:第一阶段是起始阶段,菌丝产生聚集并且出现白色的菌丝团:第二阶段是发育阶段,菌丝生长并且进一步聚集,使得丝团体积增大:第三阶段是成熟阶段,菌核成型。
其外壳黑色素会产生沉积并目使得内部的结构开始巩固[41-,在起始阶段,菌丝交织形成菌核基础,变成肉眼可见的白色颗粒状菌核,表面会布满白色的菌丝,且会分泌出少量的液体:在发育阶段,菌丝盘结成菌核,体积逐渐变大,表面仍旧会有菌丝,颜色会慢慢地加深变成黄色乃至黄褐色。
随着时间的推移,菌核表面的菌丝会慢慢减少;在成熟阶段,液珠会出现在菌核的表面,菌核外壳的黑色素会稳步沉积,呈黑色颗粒状,形状为球型或者是长条型,大小基本一致,表皮凹凸不平不是很光滑,而且十分地坚硬。
菌核在形成过程中有多种因素会影响其发育,目前有许多研究表明,环境因素、细胞内的信号转导途径、蛋白磷酸酶以及凝集素类蛋白在菌核的形成过程中有着非常重要的影响。

子囊孢子涂布分离及抗性筛选
用无菌水将收集到的子囊孢子悬浮液稀释到合适浓度,吸取100L稀释后的孢子悬浮液,涂布于含有,100,μg/mL,HYG,和,200,μg/ml,头孢克肟的,PDA,培养基上,等到微干后置于,25℃℃培养。
待子囊孢子在培养基表面萌发后,挑取单菌落的菌丝尖端,转到含有100μg'mL,HYG,的,PDA,平板上,继代培养3,代以上,提取菌丝的,DNA,以及,RNA,设计相应引物进行,PCR,验证,从而获得,SsBTBI基因的敲除纯合突变菌株,SsBTBI,基因在核盘菌中的表达模式。
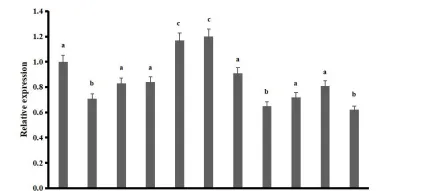
将核盘菌野生型菌株,1980,接种于铺有玻璃纸的PDA,上培养,1-10,d,分别收集,1-10d的菌丝、菌核以及有性生殖时期的子囊盘,提取RNA,并进行反转录,设计引物,SsBTB-gF,和SsBTB-qR扩增SSBTB1,以核盘菌的管家基因,Tubulin为内参基因,进行荧光定量。
PCR,荧光定量PCR反应程序:95℃℃,30s:95℃℃,10,s;60°℃,30,s;30,个循环,荧光定量,PCR,反应体系为2xS6,Universal,SYBR,qPCRmix,10,μL;上下游引物,各,0.5,μL:反转录获得cDNA,2μL:去离子水,7,μL,使用,2-^^CT法计算并且分析不同时期的核盘菌,&B7BI基因的表达量,每组样品有3个重复,实验重复3次。

菌丝生长速率的测定使用5mm,的打孔器在新鲜的敲除突变体Ssbib1-2、4Ssbrb1-3,及回补菌株4Ssbrb1-C1,与野生型菌株1980的菌丝尖端打取菌块,分别接种于不含任何胁迫因子的定量为,17.5,mL的,PDA,培养基上,20℃℃培养36h。
每12h通过十字交叉法测量菌丝直径,分析敲除突变体Ssbib1-2、4Ssbib1-3株及回补ASsbib1-CI菌株与核盘菌野生型,1980菌株的差异,本实验每组有5个生物学重复,实验重复5,次。
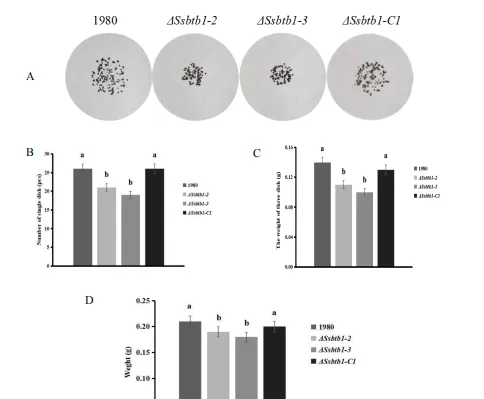
按照,3.2.10.1的方法培养菌株,20℃℃培养待测菌株,15,d,15d后将成熟的菌核收集转移到无菌培养皿中,将菌核烘干,直到菌核重量不再发生变化,队每皿的菌核数量进行计数,称量三皿总干重以及百粒菌核干重并进行分析,本实验每组有5个生物学重复,重复实验5次。
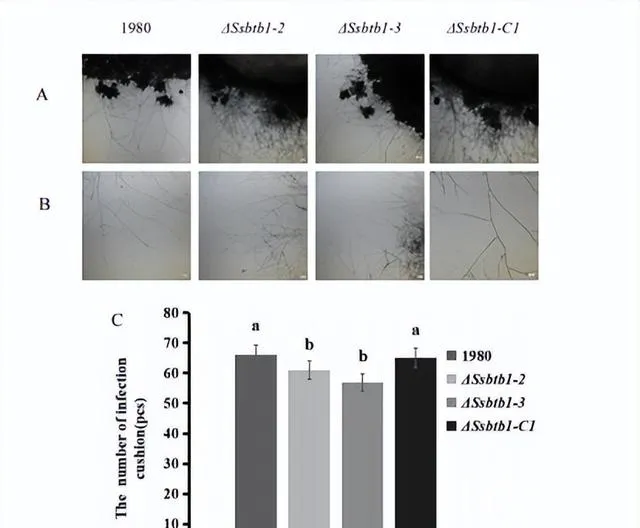
使用直径为5mm,的打孔器在新鲜的核盘菌野生型菌株1980、敲除突变体4Ssbrb1-2、4Ssbrb1-3,及回补菌株4Ssbib1-C1的菌丝尖端打取菌块,并将菌块放置在无菌载玻片上,25℃℃培养36h,通过倒置显微镜观察敲除突变体菌丝尖端及侵染垫的形态,对侵染垫进行计数。

刚果红(Congo,Red)和,0.01%SDS,是检测植物细胞壁和细胞膜变化的指标,与不含胁迫因子的培养基相比,抑制率越高,对细胞壁和细胞膜的影响越大:反之越小。
不同浓度梯度的高盐(NaCl)和高渗透压(Sorbitol)环境,观察敲除突变体对胁迫应答的变化,抑制率越高敏感性越强,反之越弱;在植株感病后,在感病部位发生反应,产生了以过氧化氢(H0,)为主的活性,对于病原体的生长有一定的抑制作用。
结论
本实验通过构建,&BTBI的敲除突变体与回补转化子,结合各种生物学方法对基因,&BTBI,在核盘菌生长发育与致病过程中的功能进行研究。
获得了&BTBI纯合敲除突变体4Ssbrb1,并恢复了突变体至野生型表型敲除基因SBTB1后,在核盘菌的营养生长中,菌丝形态不变,但菌丝生长速率显著减慢;菌核形态不变,但菌核数量及干重重量显著减少;菌丝尖端形态不变,但侵染垫数目显著减少,发挥了重要作用。
敲除,SSBTB1后,敲除突变体在高盐、高渗透压、高活性氧的胁迫环境下耐受力显著降低:敲除突变体仍旧具备产酸能力:对于不同浓度的杀菌剂敲除突变体敏感性显著提升。
在离体叶片上,敲除突变体的致病力显著降低,根据实验结果表明,&BTBI基因在核盘菌的生长过程及致病过程中参与了调控,其编码产物是潜在的致病因子。











