撰文:陰知遠,康家輝,霍姝佳,徐海偉
視網膜神經元受損和遺失是視覺系統神經退行性疾病的特征,可能造成多種致盲性眼病[1, 2]。利用外源性和內源性幹細胞實作向視網膜神經元分化是治療神經退行性疾病的有效療法[3]。然而,供體細胞的來源、安全性和有效性等問題限制了外源性幹細胞的套用。以Müller膠質(Müller glia,MG)細胞為代表的內源性幹細胞在低等脊椎動物中表現出非凡的再生能力[4],然而,哺乳動物中Müller膠質細胞失去了重編程能力。分析Müller膠質細胞重編程能力的物種差異性,探索Müller膠質細胞重編程的策略並尋找更先進的重編程技術,對於提高哺乳動物中Müller膠質細胞的重編程能力具有重要的意義。
陸軍軍醫大學第一附屬醫院徐海偉團隊在【中國神經再生研究(英文版)】(Neural Regeneration Research)2025年第4期發表的綜述文章總結更新了過去十年來在小鼠中成功地進行Müller膠質細胞重編程策略的最新進展,討論了與Müller膠質細胞重編程相關的挑戰,並結合神經系統再生的研究進展,提出了六種有前景的小鼠Müller膠質細胞重編程策略,包括表觀遺傳重塑、代謝調節、免疫調節、化學小分子誘導、細胞外基質重塑和細胞融合,為開發小鼠Müller膠質細胞重編程的新策略提供了理論基礎。
神經膠質細胞在特定條件下可透過增殖重編程為視網膜神經元。在低等脊椎動物,如斑馬魚中,當視網膜受到急性損傷後,Müller膠質細胞可去分化為神經膠質來源的祖細胞,繼而轉分化為視網膜神經元,修復整個視網膜。而小鼠和人類視網膜中的Müller膠質細胞很少表現出重編程為視網膜神經元的傾向。比較Müller膠質細胞對視網膜損傷反應的種屬差異性[5, 6],研究視網膜細胞發育[7]以及體細胞向神經元的重編程[8]為探索小鼠Müller膠質細胞重編程開辟了新的可能性。
目前,研究人員已經開發出十余種促進小鼠Müller膠質細胞重編程為視網膜神經元的策略[9-18]。但目前的Müller膠質細胞重編程策略仍存在一些問題和爭議。如:重編程的效率和有效性較低,Müller膠質細胞來源的視網膜神經元與視網膜宿主神經元的差異性,在復雜的損傷環境中神經元存活及視功能改善水平的不確定性[18-21]。面臨著遺傳因素、表觀遺傳因素和復雜微環境等多種限制,迫切需要探索更先進的重編程策略。
Müller膠質間接重編程和直接重編程
該綜述將小鼠體內Müller膠質細胞重編程的方法分為「間接重編程」和「直接重編程」兩種。其中,「間接重編程」是將成體細胞誘導、去分化為多能幹細胞,再分化成特定的細胞型別[5]。「直接重編程」是將成體細胞直接轉分化為其他細胞型別,不經歷去分化階段[22](圖1)。
在斑馬魚中,視網膜受損後,Müller膠質細胞被雕亡細胞啟用,進入「間接重編程」狀態。部份Müller膠質細胞去分化獲得了幹細胞的特征,然後轉分化為視網膜神經元,新生的神經元整合到現有的神經元回路,修復損傷的視網膜[5]。間接重編程需要獲得穩定的多能性和重設表觀遺傳特征[23]。Müller膠質細胞的間接重編程不會導致Müller膠質細胞的短缺,因而更有利於視網膜的修復。但仍需進一步提高Müller膠質細胞去分化、增殖和轉分化操作的精確性。而將小鼠Müller膠質細胞直接重編程為視網膜神經元是一個更快、更高效的過程,且保留了與年齡相關的表觀遺傳特征,在組織修復方面具有獨特的優勢[23]。Müller膠質細胞的直接和間接重編程策略都存在爭議和難度,目前的重編程策略並沒有完全實作細胞類別的轉化,迫切需要新的Müller膠質細胞重編程策略。
目前,Müller膠質細胞重編程的策略主要是透過調控Müller膠質細胞中特定的基因,特別是轉錄因子來實作的。然而,目前篩選出來的用於調節小鼠Müller膠質細胞重編程的轉錄因子相對較少,透過利用多組學技術[14] 或采用基於演算法的轉錄因子預測和全基因組詳盡的CRISPR啟用來篩選作用於細胞命運轉化的轉錄因子和其他DNA結合調節因子,可以提高篩選調節小鼠Müller膠質細胞重編程的基因的效率[24]。
誘導小鼠Müller膠質細胞重編程的潛力策略
開發新的策略是實作小鼠Müller膠質細胞重編程的另一種選擇。多種非Müller膠質細胞靶向的調節方法可用於Müller膠質細胞重編程的實作,如表觀遺傳重構、代謝調節、免疫調節、化學小分子調控、細胞外基質重構和細胞-細胞融合(圖2)。
表觀遺傳重構 Müller膠質細胞重編程的遺傳學,特別是對譜系特異性轉錄因子的研究取得了相當大的成就。Ascl1和NeuroD1、Otx2、Crx、Nrl、Pou4f2、Atoh7和Islet1是不同視網膜細胞發育的關鍵轉錄因子[25],被廣泛用於小鼠的Müller膠質細胞重編程。DNA甲基化、DNA乙酰化、組織蛋白或非組織蛋白修飾、染色質重塑和非編碼RNA調控等表觀遺傳重構方式,極大地影響了細胞命運的決定[26-28],對Müller膠質細胞重編程至關重要,是促進小鼠Müller膠質細胞重編程的一種有前景的方法。
免疫調節 小膠質細胞是視網膜固有的巨噬細胞,視網膜受損時會產生一系列的炎癥反應,導致小膠質細胞的啟用。在斑馬魚中,急性炎癥啟用視網膜中的小膠質細胞,啟動並促進Müller膠質細胞的重編程[29]。而哺乳動物中,小膠質細胞在視網膜損傷和退行性病變期間持續過度啟用,引起慢性炎癥,加速視網膜感光細胞雕亡,Müller膠質細胞細胞增殖[30]。小膠質細胞對Müller膠質細胞重編程的影響表現出物種多樣性,改變小膠質細胞表型將是促進Müller膠質細胞重編程的有效策略。未來的研究需要進一步區分小膠質細胞表型的差異,理解小膠質細胞和Müller膠質細胞之間的互動作用,以便於透過間接地、精細地調節小膠質細胞的表型來促進小鼠Müller膠質細胞重編程。
Müller膠質細胞重編程過程中的重要訊號通路包括JAK-STAT訊號通路[31, 32]、NF-κB訊號通路[33, 34]、mTOR訊號通路[35]和TNF-α[36]等,均與細胞因子介導的免疫過程相關。未來需要進行全面的研究來確定急性和慢性炎癥調節的靶點在哺乳動物視網膜再生中的潛在作用。
代謝調節 代謝的變化可以決定幹細胞的命運和功能 [37, 38]。消除代謝障礙可提高直接神經元重編程的效率[39]。多種成體細胞在向幹細胞和神經元重編程的過程中伴有糖解作用[40]、氧化磷酸化[41]和脂質過氧化的變化[39]。單獨或聯合使用抗氧化劑和其他藥物調節Müller膠質細胞代謝是實作Müller膠質細胞重編程的可行方法。
粒線體的結構和活性對細胞重編程也有顯著影響[42-44]。粒線體移植不僅具有神經保護特性,而且能使自體視網膜幹細胞轉分化為視網膜神經節細胞再生[45-47]。細胞外囊泡可以調節Müller膠質細胞的代謝微環境,透過移植外泌體有望促進Müller膠質細胞重編程[48]。雖然目前還沒有透過粒線體移植和EV移植實作Müller膠質細胞重編程的成功案例,但幹細胞和癌細胞代謝重編程的研究為小鼠Müller膠質細胞重編程提供了許多啟示,是未來可研究的方向之一。
化學小分子誘導 小分子具有細胞滲透性,可以直接靶向細胞內和細胞表面蛋白,在細胞訊息傳遞和表觀遺傳修飾中發揮重要作用[49]。化學小分子註射不僅可透過直接重編程方式改變體細胞類別[50-52],還可以誘導小鼠和人體細胞進入多能幹細胞[53-55]。與基因組編輯技術相比,小化學分子不會整合到基因組,高度可控和高效,易於最佳化、標準化、制造,可聯合使用[49]。因此,使用小化學分子Müller膠質細胞重編程是細胞命運操縱的理想策略。然而,血-視網膜屏障是小分子進入視網膜的主要障礙。在開發小分子藥物時,必須考慮到脫靶效應的風險[21]。
細胞外基質重塑 眼睛的細胞外基質(Extracellular matrix,ECM)包括基底膜和非基底膜基質,前者包括內界膜和Bruch膜,後者包括光感受器外節周圍的光感受器間基質、填充視網膜下腔以及連線視網膜細胞的突觸周圍的突觸基質[56]。Müller膠質細胞是ECM分泌的主要來源。在疾病、損傷、視網膜去分化和再生的背景下,ECM伴隨著廣泛的重構過程。來自ECM的機械訊號在將體細胞重編程為幹細胞中發揮著重要作用,但這一過程的機制尚未明確[57]。大多數ECM分子促進神經膠質瘢痕的形成,並建立一個抑制視網膜再生的環境[58]。再殖的小膠質細胞可能透過調節ECM重塑而促進Müller膠質細胞獲得祖細胞樣特征[59]。視網膜細胞周圍的微環境影響Müller膠質細胞重編程過程,但對其參與程度還需要進一步的探索。
細胞-細胞融合 近年來,一種基於視網膜細胞間交互作用的新型Müller膠質細胞非靶向調控方法已經出現。細胞-細胞融合可以引起Müller膠質細胞內基因表現的實質性變化,重設多能幹基因的表達,並完全逆轉體細胞類別的譜系[60]。將造血幹細胞或骨髓細胞募集到小鼠視網膜中,可驅動Müller膠質細胞分別向光感受器祖細胞或神經節和無長突細胞重編程 [9, 10]。這些研究表明,細胞-細胞交互作用是實作Müller膠質細胞重編程的一種創新方法。
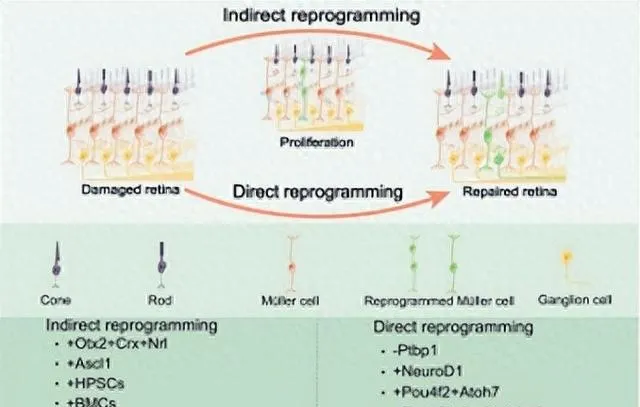
圖1 間接重編程和直接重編程示意圖
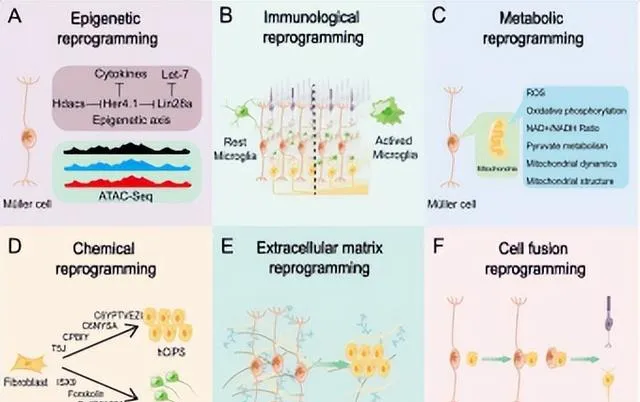
圖2 六種誘導小鼠Müller膠質細胞重編程的新策略
在過去的十年中,成年小鼠Müller膠質細胞重編程策略和機制的研究發展令人鼓舞。到目前為止,在小鼠中已經實作了相對成功的Müller膠質細胞重編程。為了進一步開發新的Müller膠質細胞重編程策略,作者們除了提供篩選辨識更多的轉錄因子的方法,還提出了六種有前景的小鼠Müller膠質細胞重編程策略。聯合使用多種策略可能是未來Müller膠質細胞重編程策略的發展趨勢。
然而,實作小鼠Müller膠質細胞的重編程仍存在諸多挑戰。比如如何提高重編程的效率和穩定性、將Müller膠質細胞來源的神經元視網膜回路整合,采用何種有效的工具來追蹤Müller膠質細胞細胞在體內的命運。此外,基於工具建立者、建模者和實驗者之間的成功合作,將對神經膠質生物學的發展至關重要,這可能會引發Müller膠質細胞重編程研究中的重大進展。
原文連結:https://doi.org/10.4103/NRR.NRR-D-23-01612
參考文獻
[1] Cheng YJ, Lin CH, Lane HY. From menopause to neurodegeneration-molecular basis and potential therapy. Int J Mol Sci. 2021;22:8654.
[2] Wan J,Goldman D. Retina regeneration in zebrafish. Curr Opin Genet Dev. 2016;40:41-47.
[3] Ikelle L, Al-Ubaidi MR, Naash MI. Pluripotent stem cells for the treatment of retinal degeneration: current strategies and future directions. Front Cell Dev Biol. 2020; 8:743.
[4] Jin ZB, Gao ML, Deng WL, et al. Stemming retinal regeneration with pluripotent stem cells. Prog Retin Eye Res. 2019;69:38-56.
[5] Lahne M, Nagashima M, Hyde DR, et al. Reprogramming Müller glia to regenerate retinal neurons. Annu Rev Vis Sci. 2020; 15:171-193.
[6] Hamon A, Roger JE, Yang XJ, et al. Müller Glial cell-dependent regeneration of the neural retina an overview across vertebrate model systems. Dev Dyn. 2016; 245:727-738.
[7] Buono L, Martinez-Morales JR. Retina development in vertebrates: systems biology approaches to understanding genetic programs: on the contribution of next-generation sequencing methods to the characterization of the regulatory networks controlling vertebrate eye development. Bioessays. 2020;42:e1900187.
[8] Gascon S, Masserdotti G, Russo GL, et al. Direct neuronal reprogramming: achievements, hurdles, and new roads to success. Cell Stem Cell. 2017;21:18-34.
[9] Sanges D, Simonte G, Di Vicino U, et al. Reprogramming Müller glia via in vivo cell fusion regenerates murine photoreceptors. J Clin Invest. 2016;126:3104-3116.
[10] Pesaresi M, Bonilla-Pons SA, Simonte G, et al. Endogenous mobilization of bone-marrow cells into the murine retina induces fusion-mediated reprogramming of müller glia cells. EBioMedicine. 2018;30:38-51.
[11] Jorstad NL, Wilken MS, Grimes WN, et al. Stimulation of functional neuronal regeneration from Müller glia in adult mice. Nature. 2017;548:103-107.
[12] Jorstad NL, Wilken MS, Todd L, et al. STAT signaling modifies Ascl1 chromatin binding and limits neural regeneration from Müller glia in adult mouse retina. Cell Rep. 2020;30:2195-2208.e2195.
[13] Yao K, Qiu S, Wang YV, et al. Restoration of vision after de novo genesis of rod photoreceptors in mammalian retinas. Nature. 2018; 560:484-488.
[14] Hoang T, Wang J, Boyd P, et al. Gene regulatory networks controlling vertebrate retinal regeneration. Science. 2020;370:eabb8598.
[15] Zhou H, Su J, Hu X, et al. Glia-to-neuron conversion by CRISPR-CasRx alleviates symptoms of neurological disease in mice. Cell. 2020; 181:590-603. 603.
[16] Xiao D, Jin K, Qiu S, et al. In vivo regeneration of ganglion cells for vision restoration in mammalian retinas. Front Cell Dev Biol. 2021;9:755544.
[17] Todd L, Jenkins W, Finkbeiner C, et al. Reprogramming Müller glia to regenerate ganglion-like cells in adult mouse retina with developmental transcription factors. Sci Adv. 2022;8:eabq7219.
[18] Pinsonneault CBP, David LA, Fernandes JAL, et al. Direct neuronal reprogramming by temporal identity factors. Proc Natl Acad Sci U S A. 2023; 120:e2122168120.
[19] Hoang T, Kim DW, Appel H, et al. Ptbp1 deletion does not induce astrocyte-to-neuron conversion. Nature. 2023; 618:E1-7.
[20] Xie Y, Zhou J, Wang LL, et al. New AAV tools fail to detect Neurod1-mediated neuronal conversion of Müller glia and astrocytes in vivo. EBioMedicine. 2023; 90:104531.
[21] Zhang H, Guo Y, Yang Y, et al. MAP4Ks inhibition promotes retinal neuron regeneration from Müller glia in adult mice. NPJ Regen Med. 2023; 8:36.
[22] Wang H, Yang Y, Liu J, et al. Direct cell reprogramming: approaches, mechanisms and progress. Nat Rev Mol Cell Biol. 2021; 22:410-424.
[23] Samoylova EM, Baklaushev VP. Cell reprogramming preserving epigenetic age: advantages and limitations. Biochemistry (Mosc). 2020; 85:1035-1047.
[24] Liu Y, Yu C, Daley TP, et al. CRISPR activation screens systematically identify factors that drive neuronal fate and reprogramming. Cell Stem Cell. 2018;23:758-771.e758.
[25] Xiang M. Intrinsic control of mammalian retinogenesis. Cell Mol Life Sci. 2013;70:2519-2532.
[26] Mitra S, Sharma P, Kaur S, et al. Histone deacetylase-mediated Müller glia reprogramming through Her4.1-Lin28a axis is essential for retina regeneration in zebrafish. iScience. 2018;7:68-84.
[27] Aldiri I, Xu B, Wang L, et al. The dynamic epigenetic landscape of the retina during development, reprogramming, and tumorigenesis. Neuron. 2017;94:550-568.e510.
[28] Xie X, Fu Y and Liu J. Epigenetic regulation of somatic cell reprogramming. Curr Opin Genet Dev. 2017;46:104-113.
[29] Iribarne M. Inflammation induces zebrafish regeneration. Neural Regen Res. 2021;16:1693-1701.
[30] Wang M, Ma W, Zhao L, et al. Müller cell responses to microglial activation mediate neuroprotection and coordinate inflammation in the retina. J Neuroinflammation. 2011; 8:173.
[31] Gorsuch RA and Hyde DR. Regulation of Müller glial dependent neuronal regeneration in the damaged adult zebrafish retina. Exp Eye Res. 2014;123:131-140.
[32] Wan J, Zhao XF, Vojtek A, et al. Retinal injury, growth factors, and cytokines converge on beta-catenin and pStat3 signaling to stimulate retina regeneration. Cell Rep. 2014;9:285-297.
[33] Palazzo I, Deistler K, Hoang TV, et al. NF-kappaB signaling regulates the formation of proliferating Müller glia-derived progenitor cells in the avian retina. Development. 2020;147:dev183418.
[34] Palazzo I, Todd LJ, Hoang TV, et al. NFkB-signaling promotes glial reactivity and suppresses Müller glia-mediated neuron regeneration in the mammalian retina. Glia. 2022;70:1380-1401.
[35] Zhang Z, Hou H, Yu S, et al. Inflammation-induced mammalian target of rapamycin signaling is essential for retina regeneration. Glia. 2020;68:111-127.
[36] Nguyen-Chi M, Laplace-Builhé B, Travnickova J, et al. TNF signaling and macrophages govern fin regeneration in zebrafish larvae. Cell Death & Disease. 2017; 8:e2979-e2979.
[37] Zheng X, Boyer L, Jin M, et al. Metabolic reprogramming during neuronal differentiation from aerobic glycolysis to neuronal oxidative phosphorylation. elife. 2016;10:e13374.
[38] Cliff TS and Dalton S. Metabolic switching and cell fate decisions: implications for pluripotency, reprogramming and development. Curr Opin Genet Dev. 2017;46:44-49.
[39] Gascon S, Murenu E, Masserdotti G, et al. Identification and successful negotiation of a metabolic checkpoint in direct neuronal reprogramming. Cell Stem Cell. 2016; 18:396-409.
[40] Tsogtbaatar E, Landin C, Minter-Dykhouse K, et al. Energy metabolism regulates stem cell pluripotency. Front Cell Dev Biol. 2020; 8:87.
[41] Magistretti PJ and Allaman I. A cellular perspective on brain energy metabolism and functional imaging. Neuron. 2015;86:883-901.
[42] Polyzos AA, Lee DY, Datta R, et al. Metabolic reprogramming in astrocytes distinguishes region-specific neuronal susceptibility in Huntington mice. Cell Metab. 2019; 29:1258-1273 e1211.
[43] Bahat A, Gross A. Mitochondrial plasticity in cell fate regulation. J Biol Chem. 2019;294:13852-13863.
[44] Liu W, Long Q, Chen K, et al. Mitochondrial metabolism transition cooperates with nuclear reprogramming during induced pluripotent stem cell generation. Biochem Biophys Res Commun. 2013;431:767-771.
[45] Nascimento-Dos-Santos G, de-Souza-Ferreira E, Lani R, et al. Neuroprotection from optic nerve injury and modulation of oxidative metabolism by transplantation of active mitochondria to the retina. Biochim Biophys Acta Mol Basis Dis. 2020; 1866:165686.
[46] Wu SF, Lin CY, Tsai RK, et al. Mitochondrial transplantation moderately ameliorates retinal degeneration in royal college of surgeons rats. Biomedicines. 2022; 10:2883.
[47] Zhang J, Wu S, Jin ZB, et al. Stem cell-based regeneration and restoration for retinal ganglion cell: recent advancements and current challenges. Biomolecules. 2021; 11:987.
[48] Fridman ES, Ginini L, Gil Z. The role of extracellular vesicles in metabolic reprogramming of the tumor microenvironment. Cells. 2022;11:1433.
[49] Wang J, Sun S and Deng H. Chemical reprogramming for cell fate manipulation: Methods, applications, and perspectives. Cell Stem Cell. 2023; 30:1130-1147.
[50] Xia X, Teotia P, Patel H, et al. Chemical induction of neurogenic properties in mammalian Müller glia. Stem Cells. 2021;39:1081-1090.
[51] Zhang L, Yin JC, Yeh H, et al. Small molecules efficiently reprogram human astroglial cells into functional neurons. Cell Stem Cell. 2015; 17:735-747.
[52] Mahato B, Kaya KD, Fan Y, et al. Pharmacologic fibroblast reprogramming into photoreceptors restores vision. Nature. 2020; 581:83-88.
[53] Hou P, Li Y, Zhang X, et al. Pluripotent stem cells inducedfrom mouse somatic cells by small-molecule compounds. Science. 2013; 341:4.
[54] Liuyang S, Wang G, Wang Y, et al. Highly efficient and rapid generation of human pluripotent stem cells by chemical reprogramming. Cell Stem Cell. 2023; 30:450-459 e459.
[55] Guan J, Wang G, Wang J, et al. Chemical reprogramming of human somatic cells to pluripotent stem cells. Nature. 2022; 605:325-331.
[56] Serjanov D and Hyde DR. Extracellular matrix: the unexplored aspects of retinal pathologies and regeneration. Adv Exp Med Biol. 2023; 1415:309-317.
[57] Liu L, Liu M, Xie D, et al. Role of the extracellular matrix and YAP/TAZ in cell reprogramming. Differentiation; research in biological diversity. 2021; 122:1-6.
[58] Reinhard J, Joachim SC, Faissner A. Extracellular matrix remodeling during retinal development. Exp Eye Res. 2015;133:132-140.
[59] Cheng X, Gao H, Tao Z, et al. Repopulated retinal microglia promote Müller glia reprogramming and preserve visual function in retinal degenerative mice. Theranostics. 2023; 13:1698-1715.
[60] Brown KE and Fisher AG. Reprogramming lineage identity through cell-cell fusion. Curr Opin Genet Dev. 2021; 70:15-23.
文章摘要: 視網膜神經元受損和遺失是視覺系統神經退行性疾病的特征,可能造成多種致盲性眼病。利用外源性和內源性幹細胞實作向視網膜神經元分化是治療神經退行性疾病的有效療法。然而,供體細胞的來源、安全性和有效性等問題限制了外源性幹細胞的套用。以Müller膠質細胞為代表的內源性幹細胞在低等脊椎動物中表現出非凡的再生能力,然而,哺乳動物中Müller膠質細胞失去了重編程能力。分析Müller膠質細胞重編程能力的物種差異性,探索Müller膠質細胞重編程的策略並尋找更先進的重編程技術,對於提高哺乳動物中Müller膠質細胞的重編程能力具有重要的意義。文章總結更新了過去十年來在小鼠中成功地進行Müller膠質細胞重編程策略的最新進展,討論了與Müller膠質細胞重編程相關的挑戰,並結合神經系統再生的研究進展,提出了六種有前景的小鼠Müller膠質細胞重編程策略,包括表觀遺傳重塑、代謝調節、免疫調節、化學小分子誘導、細胞外基質重塑和細胞融合,為開發小鼠Müller膠質細胞重編程的新策略提供了理論基礎。
文章來源: Yin Z, Kang J, Cheng X, Gao H, Huo S, Xu H (2025) Investigating Müller glia reprogramming in mice: a retrospective of the last decade, and a look to the future. Neural Regen Res 20(4):946-959.











