先導編輯(Prime Editing)系統,是美國哈佛大學劉如謙教授團隊的代表性成果之一。近日,該團隊的高鑫博士和同事,在此基礎之上打造出一款升級版基因編輯系統。

圖 | 高鑫(來源:高鑫)
這款升級版基因編輯系統, 能將整個基因精準地插入細胞 DNA 中的指定位置。不需要像其他基因編輯療法那樣,必須針對每種突變進行逐一修改。
透過此,高鑫等人突破了哺乳動物細胞基因組大片段定點整合效率的瓶頸,也提升了大基因片段在哺乳動物細胞中的整合效率和精確度,為基因編輯和基因治療帶來了新的技術支持。
基於此,未來有望實作只需開發一種基因編輯療法,即可治療由數百種、甚至上千種不同基因突變所引起的疾病。
(來源:Nature Biomedical Engineering)
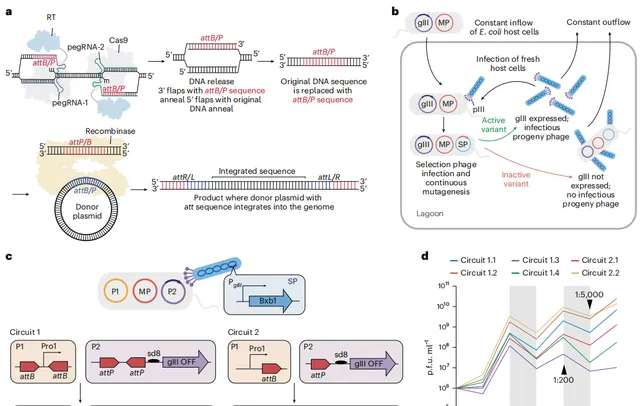
詳細來說,研究中高鑫和同事利用蛋白前進演化的手段,針對 DNA 大絲胺酸重組酶 Bxb1 進行了酶改造。
並將 Bxb1 作為可程式化的基因插入,探索了它在致病位點的套用價值,借此提出一款名為 eePASSIGE(evolved and engineered prime-editing-assisted site-specific integrase gene editing)的先導編輯技術。
同時,也在幹細胞和原代人成纖維細胞等具有藥用價值的細胞系中,進行了探索。
「先導編輯輔助位點特異性整合酶基因編輯」技術(PASSIGE,prime-editing-assisted site-specific integrase gene editing)是該團隊此前開發的定向基因插入技術。
美國麻省理工學院一間實驗室則「透過特定站點目標元素進行可編程添加」技術(PASTE,programmable addition via site-specific targeting elements)使用先導編輯器和大絲胺酸重組酶來實作大片段的定向基因插入。
本次研究之中,課題組也探討了 PASSIGE 技術在基因插入效率上優於 PASTE 技術的原因。

(來源:Nature Biomedical Engineering)
透過此他們證實:在目前已有的同類方法中, 本次研發的 eePASSIGE 方法,具備不錯的基因插入效率、以及可程式化的靈活性。
這讓 eePASSIGE 能夠為治療遺傳類疾病註入新希望,並有望在以下領域發揮作用:
其一,用於改造體外療法、CAR-T 免疫細胞療法等和新一代體內基因療法,從而更好地治療囊性纖維化、苯丙酮尿癥、眼部疾病等。
在此前的細胞療法之中,由於慢病毒的存在,故會在全基因組導致隨機的插入風險,以及導致初代 Cas9 和其他 DNA 雙鏈切割酶產生染色體變異。
而利用本次方法加以改造,將能避免上述問題的出現。
其二,用於實作更多的合成生物學套用。
即可以在生物活細胞內構建人工設計的基因回路,進而針對外界應激做出基因調控。
也可以透過改造細胞株來最佳化藥用蛋白的產量。
更可以透過定向、高效地插入大型調控元件,來研究三維基因組的構象和折疊、以及研究生物體的發育問題。
其三,用於提升農作物的性狀和產能。
對於改造農作物的性狀來說,如何實作定向的 DNA 序列插入是一個公認的難題,而 eePASSIGE 則有希望解決這一難題。
開發全新治療方法,解決不同種類的致病突變
據介紹,人體出現的基因突變(比如錯義突變和無義突變等),會導致基因功能喪失,從而引起遺傳疾病。
而對於某個會催生遺傳疾病的致病突變來說,它裏面又包含著許多種類。
比如:對於 PAH 基因來說,目前已知大約有 1000 個突變能導致苯丙酮尿癥;對於 CFTR 基因來說,目前已知大約有 2000 個突變能導致囊性纖維化。
通常來講,對於任何一種遺傳疾病而言,不同病人的體內致病突變體,也不盡相同。
而透過開發一款精準、定向的大片段基因插入技術,就能在內源位點插入病變基因的正確序列。
這樣一來,就能表達正常生理水平的基因產物,進而解決由於致病突變導致的基因功能缺失。
也就是說,只需開發一個療法,就能治療存在多種型別突變的絕大多數疾病。
此前,傳統基因療法主要依賴於外源病毒載體進行表達。由於缺少內源調控元件,因此很容易出現基因產物過度表達的問題,進而導致疾病的發生。
2021 年底,高鑫和同事在 Nature Biotechnology 上發表了 PASSIGE 技術的相關論文,實作了可程式化的大片段基因技術,並申請了美國專利(現已獲專利批準)。
PASSIGE 的工作原理,主要涉及到兩個步驟:
第一步,由先導編輯器和一對 pegRNA,在特定的基因位點匯入 DNA 絲胺酸重組酶,比如匯入 Bxb1 的辨識序列 attB/P;
第二步,當 Bxb1 辨識 attB/P 序列之後,可以將 plasmid DNA 載體插入到特定位點。
在先導編輯的幫助之下,該團隊填補了 DNA 絲胺酸重組酶 Bxb1 可程式程度性較低的缺陷,從而能在人類基因組的特定位點比如 AAVS1,精準地插入 5.6-kb 的基因序列,並能實作 6.8% 的效率。
他們還發現:盡管 Bxb1 是自然界中一個衍生細菌病毒的蛋白,但是在人類細胞之中即使穩定細胞系已經包含 attB/P 序列,然而 Bxb1 的插入效率仍然只能達到大約 10-20%。
這說明:Bxb1 的 DNA 重組酶活性制約,能在人類細胞中實作更高效的大片度基因插入效率。
因此,高鑫和同事決定使用實驗室開發的一種名為「噬菌體輔助連續前進演化(PACE,Phage-Assisted Continuous Evolution)」的蛋白前進演化方法,來提高 Bxb1 重組酶的插入效率。

(來源:Nature Biomedical Engineering)
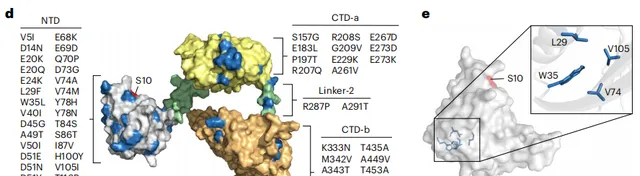
研究中,高鑫遇到了這樣一個問題:即那些前進演化出來的突變體,到底是如何提高插入效率的?
此前該領域內的學者,並沒有解析出來完整的 Bxb1 蛋白多聚體結構,自然也就無法回答上述問題。
這時,AI 技術為他們帶來了幫助。 透過使用 AlphaFold2,他們成功預測了 Bxb1 的結構,並與其他絲胺酸重組酶家族成員的部份結構進行了比對。
(來源:Nature Biomedical Engineering)
同時,為了提高 eePASSIGE 在原代人成纖維細胞的編輯效率,他們在各種條件之下,一遍又一遍地測試 DNA donor 和濃度等,終於摸索出了最佳的實驗條件。
日前,相關論文以【透過不斷前進演化的重組酶和先導編輯在哺乳動物細胞中高效地定點整合大片段基因】(Efficient site-specific integration of large genes in mammalian cells via continuously evolved recombinases and prime editing)為題發在 Nature Biomedical Engineering (IF 26.8)。
斯姆裏蒂·潘迪(Smriti Pandey)和高鑫是共同一作,劉如謙擔任通訊作者[1]。

圖 | 相關論文(來源:Nature Biomedical Engineering)
而實作 DNA donor 的遞送,將是高鑫的下一個研究目標。他表示:「進入細胞體內的外源 DNA,很容易啟用 T 細胞等人源原代細胞的防禦反應,從而產生細胞毒性。」
因此,要想實作基於 eePASSIGE 的細胞療法,就得開發和最佳化 DNA donor 的遞送方式。
另外,要想在動物體內和病人體內實作定向大片段基因的高效插入,則需要開發基於 eePASSIGE 新型基因療法。
所以,下一步高鑫也將結合病毒樣顆粒等新型遞送方式,來解決遞送大分子編輯器的難點。

既不循規蹈矩,也不博人眼球
此外,本次論文的順利發表,也離不開導師的幫忙。
高鑫表示:「因為 David(劉如謙)是美國霍華德·休斯醫學研究所(HHMI,The Howard Hughes Medical Institute)的 Investigator,所以每隔一段時間可以向 HHMI 遞交一些儀器申請。」
當時,高鑫代表實驗室起草了一個計劃,讓導師幫忙申請到一台 QX ONE ddPCR 儀器。
有了這款儀器,只需一個晚上就能一次性處理 5 個 96 孔板和 480 個樣品,不僅極大提高了本次課題的效率,也給組裏開發大片段基因插入方法的其他計畫帶來了幫助。

圖 | 劉如謙(來源:哈佛大學新聞網站)
多年來,高鑫所在的劉如謙實驗室,在基因編輯技術開發、分子藥物開發、蛋白工程改造等領域產出了不少成果。
對此,他表示:「我的導師 David 把一群擁有不同背景的研究者組合在一起,營造了一個既有創造力、又能互相協作的團隊。」
「David 每天都對工作充滿熱情,記得有一次我和他以及合作者在開會,他開玩笑地說周中或是周末對他來說都是一樣的。他的這種工作熱情也影響到了我們。」高鑫繼續說道。
另外,實驗室對於科研課題選擇上的「苛刻」,也讓高鑫非常受益。
他說:「我的個人感覺是導師既不循規蹈矩,也不為了某些噱頭做博人眼球的研究,這讓人感覺非常的踏實。」
通常,該團隊選擇課題的出發點是:這個問題為何是領域內的難點?解決它能帶來什麽現實意義?會給學界增加怎樣的新認知?能給已有技術帶來什麽突破?
「有時即使沒有達到最終極的目標,但是期間所累積的觀察和結果,也有可能產出一篇不錯的論文。」高鑫表示。
另據悉,高鑫的碩士和博士分別畢業於美國西北大學和美國麻薩諸塞州大學醫學院艾瑞克·桑特海默(Erik Sontheimer)教授課題組。2020 年,高鑫加入哈佛大學 劉如謙課題組成為一名博士後。
他說:「在加入這裏之前,我就被這裏的蛋白前進演化系統、套用單堿基編輯和先導編輯技術所吸引。」
在劉如謙課題組裏,他和同事先後開發了 PASSIGE 技術和本次的 eePASSIGE 方法。
「未來我很期待可以繼續在技術開發和套用上突破,將專利授權給一些藥企公司,從而將這些技術轉化成藥品,透過治愈遺傳疾病病人的病痛,為這些家庭帶去希望。」高鑫最後表示。
參考資料:
1.Pandey, S., Gao, X.D., Krasnow, N.A.et al. Efficient site-specific integration of large genes in mammalian cells via continuously evolved recombinases and prime editing. Nat. Biomed. Eng (2024). https://doi.org/10.1038/s41551-024-01227-1
營運/排版:何晨龍











