一切生物都由細胞組成,細胞是生物體結構和功能的基本單位。有些生物如細菌以單細胞生物的形式存在,而有些生物包括人類的組成極其復雜,由無數個協同工作的細胞組成,這些細胞精密排布、各司其職、共同協作。
公開資料顯示,人體約有億萬個細胞,成年男性體內平均有大約 36 萬億個細胞,而成年女性體內平均有 28 萬億個細胞。
在多細胞系統中,細胞並非孤立地發揮作用,而是會受到其空間位置和微環境的影響。比方說,細胞之間的關系以及它們在組織樣本中的相對位置對於深入理解疾病病理學至關重要。而當前常用的單細胞組學技術無法捕捉細胞的空間資訊,揭示細胞間通訊的局部網路,這往往會使得樣本遺失部份關鍵資訊。
在此背景下,科學家們開始積極探索空間多組學技術,這一技術可以透過從多個空間尺度獲得資訊幫助研究人員深入理解生物體內復雜的細胞交互作用、訊號通路、調控機制等生物學問題,已經被視為生命科學領域的「下一個風口」。
賓夕法尼亞大學助理教授鄧彥翔專註於此,他開發了兩項全新的空間組學技術 Spatial-CUT&Tag 和 Spatial-ATAC-seq,首次實作了在空間和全基因組水平上觀察組織發育的表觀遺傳機制。憑借在空間組學技術領域取得的突破性進展,鄧彥翔入選了 2023 年度【麻省理工科技評論】中國區「35 歲以下科技創新 35 人」。
圖 | 鄧彥翔博士
鄧彥翔在美國倫斯勒理工學院獲得機械工程博士學位,後在耶魯大學生物醫學工程系樊榮教授實驗室從事博士後研究。目前在賓夕法尼亞大學病理學與檢驗醫學系組建獨立實驗室,重點關註開發新型空間組學技術及其套用。
「我的研究計畫集中在空間多組學技術上,最重要的創新要素在於將機械工程的微流控技術、多種生化反應的最佳化以及大規模測序數據分析結合起來,從而實作了高空間分辨率的基因、蛋白質表達和表觀遺傳機制分析。 這種多學科融合的創新不僅可以提高研究的精確性和效率,也為疾病診斷和治療提供了全新的視角。」

首次實作空間表觀遺傳分析,已在推進轉化工作
鄧彥翔在博士後期間開始從事單細胞測序、單細胞轉錄組研究,後續轉向空間多組學研發。這也成為他目前以及未來的重點研究方向,他的研究範圍包括基因組、轉錄組和表觀遺傳。
「最初,我們專註於單細胞轉錄組學,不過後續認識到這種技術具有局限性,它會遺失細胞在組織或器官中的空間分布資訊,而細胞的空間排布與其功能密切相關。另一方面,當開發出空間轉錄組方法後,我們發現僅研究分子層級的轉錄組資訊遠遠不夠,細胞的交互作用機制不僅涉及轉錄組,還包括上遊的表觀遺傳等,上遊因素在基因和轉錄調控中起著至關重要的作用。」鄧彥翔說。
他進一步補充道,到目前為止,還沒有任何技術能夠實作對基因表現機制方面的高空間分辨率分析。染色質狀態決定基因組功能,並以細胞型別特異性的方式進行調節。同時,細胞在組織中的組織方式與它們的功能之間又存在很強的相互聯系。因此, 我們認為高空間分辨的表觀遺傳測序技術將為最前沿的空間組學領域開啟另一個全新的篇章。
基於這些認知,鄧彥翔開始探索一種可以分析表觀遺傳資訊的新方法,他成功開發出兩種全新的空間組學技術 Spatial-CUT&Tag 和 Spatial-ATAC-seq,這兩種技術從不同的角度解析細胞調控機制。前者利用微流控技術將組織進行空間二維編碼,可用於全基因組尺度的空間組織蛋白修飾分析;後者可用於空間染色質可及性分析。
具體而言,Spatial-CUT&Tag 利用相應的抗體去標記這些組織蛋白修飾,然後利用 pA-Tn5 酶,這種酶能夠與標記後的抗體結合,並將相關編碼序列插入到目標 DNA 序列中。這個過程利用微流控芯片實作對組織蛋白的空間編碼,編碼完成後,可以透過測序得到所有的基因序列,然後透過計算方法還原出組織蛋白在空間上的分布資訊。
而研究染色質可及性可以預測基因轉錄情況,Spatial-ATAC-seq 利用 Tn5 轉座酶切割開放的染色質區域,切割後,這些區域可以透過微流控芯片實作空間編碼。然後,透過二代測序技術測出這些區域的所有 DNA 序列,接著透過計算方法還原染色質可及性在基因組中的分布情況。
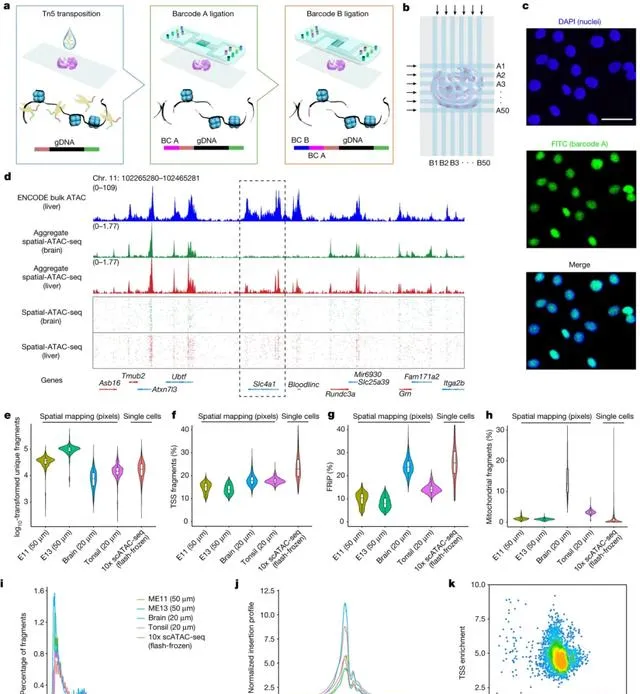
圖 | Spatial-ATAC-seq 設計、工作流程和數據品質(來源:Nature)
以癌癥為例,利用這些技術可以精確定位癌細胞位置和狀態,觀察其周圍微環境中的其他細胞型別。這些技術還可以揭示在微環境中癌細胞與附近免疫細胞或基質細胞之間的交互作用,而這些資訊對理解癌癥發生、發展和治療機制至關重要。
「組織蛋白質修飾和染色質可及性是表觀遺傳學的兩個不同方面,透過對表觀遺傳不同角度的分析,我們可以更全面了解表觀遺傳對基因表現和細胞功能的調控。更值得一提的是,這兩項新技術 首次實作 在空間和全基因組水平上觀察到組織發育的表觀遺傳機制,並實作與發育和疾病相關的表觀遺傳調節的空間對映,這是生物醫學領域的一項重大突破。」鄧彥翔說。
鄧彥翔指出,這些技術是一個全新的起點,可以在不同組織上進行更多類似的研究。從長遠來看, 我們可以利用這些新技術了解不同疾病狀態的表觀遺傳起源,開發表觀遺傳藥物,開辟一條全新的疾病治療途徑。
據鄧彥翔透露,這些空間多組學技術已經在一家成立於 2020 年的耶魯大學衍生公司 AtlasXomics Inc. 推進商業化,技術的套用場景包括用於基礎研究和臨床轉化。公開資料顯示,這家初創公司目前完成了約 600 萬美元的融資且已經開始提供相關服務。

「空間多組學是一個非常新興的領域」
空間多組學指的是在同一組織切片上觀察和分析多個組學層級的分子資訊。傳統的技術可能只能單獨分析轉錄組或表觀遺傳組,而多組學技術則可以在同一切片上同時觀察多個分子層面的資訊,如轉錄組和表觀遺傳組。 這種方法可以提供更完整和綜合的視角,使研究人員更全面理解細胞和組織的功能和交互作用,有助於揭示更加復雜和深層次的生物學機制。
這是一個非常新興且熱門的領域。2020 年,空間轉錄組測序被【自然-方法】選定為「年度創新技術」之一。2022 年,國際頂級學術期刊【自然】將空間多組學技術評為「年度七大顛覆性技術」之一。技術的快速發展和廣泛關註也反映了其在研究和套用中的潛力和重要性。
鄧彥翔坦言,空間多組學之所以重要,關鍵在於它能夠回答許多傳統方法無法解決的問題。其可以直接在組織層面觀察所有分子層級的表現,揭示細胞之間的交互作用及其對分子狀態的影響。 透過這些資訊,空間組學可以為基礎研究提供深刻的見解,同時對疾病診斷和治療也有著極大的套用潛力,它們有潛力成為生物醫學研究中非常有用的工具。
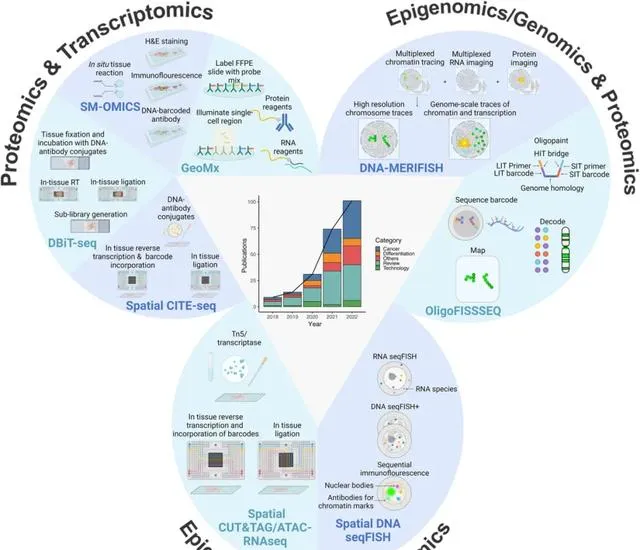
(來源:Signal Transduction and Targeted Therapy)
不過, 鄧彥翔也認為空間組學領域雖然已經取得了一些進展,但是還處在起步階段,挑戰猶在。 他表示,細胞是一個非常復雜的系統,仍有許多分子層級尚未被完全理解,包括 RNA 修飾。此外,空間組學產生了大量新數據和資訊,如何整合和利用這些資訊生成新知識和新見解,這也是一個很大的挑戰。機遇與挑戰並存,一方面空間組學具有很大的探索空間和潛力,同時在探索細胞復雜性和解決醫學問題方面也還有很長的路要走。
「空間多組學的產業化發展同樣處於早期階段。不同於基因測序領域,目前空間多組學領域內還未出現巨頭公司,初創公司還有很多機會。比方說,10x Genomics 目前的業務更聚焦在空間轉錄組和少量表面蛋白的分析上,也有公司專註提高空間分辨率和精度,但在空間多組學的產業化模式方面,尚未有太多進展。 總之,要將這些空間多組學技術大規模推廣並實作產業化還需要一段時間。 」
「隨著技術不斷發展以及市場對多組學數據需求的增加,空間多組學領域的推廣和套用速度可能會加快。未來,我相信空間多組學還會向著捕捉三維結構資訊、即時動態或連續監測等方向發展。我們的最終目標是開發同時具備三維結構和動態時間維度的空間組學技術,這種技術將能夠在三維空間中,隨時間變化,即時監測分子的分布和動態變化。」鄧彥翔總結道。
參考連結:
1.https://www.nature.com/articles/s41392-023-01507-3
2.https://www.nature.com/articles/s41586-022-05094-1
免責聲明:本文旨在傳遞生命科學和醫療健康產業最新訊息,不代表平台立場,不構成任何投資意見和建議,以官方/公司公告為準。本文也不是治療方案推薦,如需獲得治療方案指導,請前往正規醫院就診。











