編譯:微科盟 月亮魚,編輯:微科盟 景行、江舜堯。
微科盟原創微文,歡迎轉發轉載,轉載請註明來源於【轉錄組】公眾號。
導讀
鈣依賴性蛋白激酶(calcium -dependent protein kinase,CPKs)是植物中最具代表性的鈣傳感器,它參與調節植物生長發育及植物對生物和非生物脅迫的適應機制等多個方面。然而,CPKs如何調節抗氧化防禦系統在很大程度上仍然未知。研究者前期實驗結果表明, OsCPK12的功能受損會導致水稻氧化脅迫,產生更多的pO2、降低過氧化氫酶(CAT)活性並降低產量。因此,本研究探討了OsCPK12在水稻氧化耐受性中的作用 。 研究結果表明,OsCPK12與OsCATA和OsCATC的Ser11之間交互作用並磷酸化。敲除 OsCATA 或 OsCATC 都會導致氧化應激,並伴有更高的pO2積累。在 oscpk12-cr 品系中過表達模擬磷酸化的OsCATAS11D和OsCATCS11D降低了pO2的積累水平。此外,OsCATAS11D和OsCATCS11D在體內和體外均顯示出CAT活性增強。過表達 OsCPK12 的植株表現出更高的CAT活性以及對氧化脅迫的更高耐受性。綜上所述,本研究結果表明,OsCPK12透過磷酸化OsCATA和OsCATC的Ser11位點來影響CAT酶的活性,從而調節pO2的穩態,並介導水稻的氧化耐受機制。
論文ID
原名: OsCPK12 phosphorylates OsCATA and OsCATC to regulate pO2 homeostasis and improve oxidative tolerance in rice
譯名: OsCPK12透過磷酸化OsCATA和OsCATC調控pO2穩態從而提高水稻的氧化耐受性
期刊: Plant Communications
IF: 10.5
發表時間: 2023年12月
通訊作者: 曹立勇,劉群恩,程式華
通訊作者單位: 中國水稻研究所
DOI號: 10.1016/j.xplc.2023.100780
實驗設計
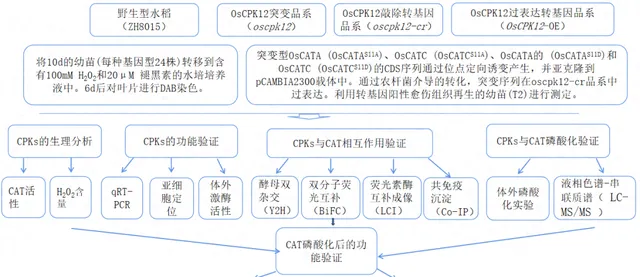
結果
1 OsCPK12 過表達增加了水稻中CAT活性,降低pO2的積累
鈣依賴性蛋白激酶(CPKs)在植物的生長發育以及應對生物和非生物脅迫中起著重要的作用。 為了探究水稻中OsCPK12的生物功能,研究人員將中恢8015(ZH8015)品系經甲烷磺酸乙酯(EMS)誘變處理後的突變系群體中鑒定出 oscpk12 突變品系。 此前,課題組此前研究表明oscpk12功能受損導致水稻早衰。 研究者比較了不同階段ZH8015野生水稻和 oscpk12 突變品系中CAT活性及p02含量 ,結果表明在20天幼苗期,野生品系ZH8015水稻和突變品系葉片中p02含量並無顯著差異,然而在 40天之後, oscpk12 突變品系中p02含量顯著高於野生品系ZH8015 (圖S1A)。 在不同發育階段 oscpk12 突變品系中CAT活性低於野生品系ZH8015水稻。為了進一步探究 OsCPK12 在水稻中的功能特性,研究者進一步比較了四種水稻品系(野生品系ZH8015, oscpk12 突變品系, OsCPK12-OE 過表達品系, oscpk12-cr 敲除品系)中CAT活性和p02水平 。在抽穗期,在 oscpk12 突變品系和 oscpk12-cr 敲除品系水稻葉中p02水平較高,而CAT活性較低(圖1A)。相比之下, OsCPK12-OE 過表達品系表現出CAT活性顯著升高和p02積累顯著降低(圖1B)。 上述結果表明過表達 OsCPK12 可以提高水稻中CAT活性並降低p02的積累。

圖1. ZH8015、oscpk12、oscpk12-cr和OsCPK12-OE品系的p02含量和CAT活性,OsCPK12和截斷OsCPK12的蛋白特性。 (A) 測定ZH8015、 oscpk12 、 oscpk12-cr 和 OsCPK12-OE 品系葉片中pO2的含量。 數據以mean±SD (n=6)表示。條形上方不同的字母表示顯著性 ( P <0.05)。 采用單因素變方分析確定 P 值 並透過Tukey的多重比較。 (B) 測定了ZH8015、 oscpk12 、 oscpk12-cr 和 OsCPK12-OE 品系葉片中CAT的酶活性。數據以mean±SD (n=6)表示。條形上方不同的字母表示顯著性 ( P <0.05)。 采用單因素變方分析確定 P 值 並透過Tukey的多重比較。(C)全長OsCPK12的激酶活性。純化了重組OsCPK12蛋白,在不含(2 mM EGTA)或存在0.5 mM 鈣離子的情況下,使用syntide 2作為受質測定了體外激酶活性。變性OsCPK12的活性作為陰性對照。用GloMax®-Multi檢測系統測定發光值(相對光單位,RLU)。發光訊號與存在的ATP量相關,與激酶活性的量呈負相關。ATP消耗量與激酶活性呈正相關。數據以mean+SD (n=3)表示。(D)截斷的OsCPK12的激酶活性。純化了重組截斷的OsCPK12蛋白,在不存在(2 mM EGTA)或存在0.5 mM 鈣離子的情況下,使用syntide 2作為受質測定了體外激酶活性。將變性截斷的OSCPK12作為陰性對照。用GloMax®-Multi檢測系統測定發光值(相對光單位,RLU)。發光訊號與存在的ATP量相關,與激酶活性的量呈負相關。ATP消耗量與激酶活性呈正相關。(E)測定OsCPK12對syntide 2的K m值。RLU值代表樣品相對於對照的減少,其與激酶活性成正比。數據以mean+SD (n=3)表示。(F)在有或沒有鈣離子的情況下,OsCPK12在30分鐘內的自磷酸化。變性的OsCPK12作為陰性對照。免疫墨點檢測的蛋白磷酸化經過Phos-Tag SDS-PAGE(上)後用 anti-GST抗體 探針檢測(上),用標準SDS-PAGE凝膠(下)染色考馬斯亮藍(CBB)表示蛋白負載。
2 OsCPK12的表達、亞細胞定位和蛋白特性
已有研究表明, OsCPK12 在所有器官中均能表達,但是綠色組織如葉片,莖和鞘等器官中表達量高。 為了探究OsCPK12在水稻整個生殖生長階段的轉錄水平,研究者透過qRT-PCR分析了野生品系水稻ZH8015和 oscpk12 突變品系水稻不同發育階段中葉片的 OsCPK12 表達情況。 在播種後的20天 OsCPK12 表達水平較高,而在播種後的30天後下降(圖S1C)。在 oscpk12 突變品系中 OsCPK12 基因表現水平顯著變低,且在不同發育階段, oscpk12 突變品系中OsCPK12基因表現水平的變化趨勢與野生品系ZH8015品系水稻大致相同(圖S1C)。 這些結果表明 OsCPK12 在水稻整個生長階段均能表達,但在播種後20天的表達水平最高。
CPKs由位於n端的V結構域、絲胺酸/蘇胺酸蛋白激酶的K結構域、自抑制連線的L結構域和包含4個EF-手型基序的R結構域組成。 為了驗證OsCPK12的亞細胞定位及其不同的結構域,研究者首先由CaMV35S啟動子驅動將 OsCPK12 的全長編碼序列(CDS)融合到綠色熒光蛋白(GFP)的N端,在水稻原生質體中瞬時表達。結果顯示,在整個細胞中均能檢測到GFP訊號,且其能與mCherry(紅色熒光蛋白變種)訊號完美融合(圖S2A-S2C)。OsCPK12全長序列的GFP訊號也與細胞核標記蛋白Ghd7-mCherry (圖S2D-S2E),膜標記蛋白Lazy1-mCherry(圖S2F,S2G)內質網標記蛋白mCherry-HDEL(圖S2H)融合。
N-豆蔻酰化是蛋白質中的一種酰化過程,僅在N-末端甘胺酸上發生。經NMT和Myristoylator兩個線上網站預測發現OsCPK12可以在glycine2被豆蔻酰化,並參與膜靶向的共轉譯修飾。在此基礎上, 研究者進一步探究了具有預測肉豆蔻酰基化位點的n端截斷V結構域的亞細胞定位情況。正如預期的那樣,OsCPK12-V-GFP的GFP訊號僅分布在膜內(圖S2I和S2J)。為了驗證OsCPK12的V結構域是否為全長OsCPK12的細胞膜定位所必需,研究者將N端截斷OsCPK12的 V結構域和K結構域與GFP融合,此外將OsCPK12的K結構域單獨與GFP融合,形成OsCPK12-V/K-GFP和OsCPK12-K-GFP 。研究者發現OsCPK12- v/K-GFP和OsCPK12-K-GFP中的GFP訊號與全長OsCPK12中結果相似(圖S2K和S2L,圖S2M和S2N)。 上述結果表明,OsCPK12定位於細胞膜、細胞質和細胞核中,且OsCPK12的N端V結構域足以實作其膜定位。
為了驗證OsCPK12是否為功能性蛋白激酶,研究者對其進行了體外酶活性測定。 此前有相關研究表明,透過故意去除CPKs的L結構域和R結構域,鈣離子依賴性可以從激酶活性中解耦聯,並且通常可能導致CPKs不受鈣離子的抑制。 研究者將缺失CAD結構域並融合谷胱甘肽s-轉移酶(GST)的OsCPK12- v/K和OsCPK12全長進行表達、純化和考馬斯亮藍(CBB)染色確認,然後用BCA蛋白測定試劑盒測定蛋白濃度,蛋白上清進一步進行體外激酶活性測定和自磷酸化測定 。 結果發現,ATP消耗量與激酶活性呈正相關。這一結果表明,OsCPK12-GST與2 mM EDTA孵育時,ATP消耗量比與0.5mM 鈣離子孵育時低(圖1C) ;這一發現與OsCPK12-V/K-GST的結果相一致(圖1D)。 同時研究者們將OsCPK12對syntide 2的活性進行了分析。以syntide 2為受質,OsCPK12的km值為2.97 µM(圖1E)。這一發現表明,OsCPK12和OsCPK12-v/K在添加Ca2+後激酶活性增強。
研究者還從1到30分鐘的Phos-Tag凝膠中分離了用鈣離子或2mM EGTA孵育的OsCPK12蛋白,以檢測OsCPK12是否自動磷酸化。研究者發現磷酸化帶隨著反應時間的延長而變粗(圖1F),表明OsCPK12在體外具有自磷酸化活性。當OsCPK12與2 mM EGTA孵育時,研究者也檢測到一個磷酸化帶(圖1F)。因此,無論有沒有鈣離子的情況下OsCPK12均可以在體外自動磷酸化 。
3 在體外和體內OsCPK12與OsCATA、OsCATB和OsCATC交互作用
為了探究過表達 OsCPK12 提高水稻抗氧化能力的分子機制,研究者利用酵母雙雜交(Y2H)實驗篩選了OsCPK12交互作用蛋白 。研究者將OsCPK12-V/K融合到誘餌載體(BD)的Gal4DNA結合域,分離出幾個交互作用複制,並鑒定出與CAT結構域蛋白相對應的複制(OsCATC)。 OsCATC 是水稻CAT家族的三個基因之一( OsCATA、OsCATB 和 OsCATC )。因此,將全長 OsCATA、OsCATB 和 OsCATC 引入酵母雙雜交獵物載體(AD-O)的Gal4啟用域OsCATC)。 酵母雙雜交實驗的結果表明,OsCPK12與所有三種CATs交互作用,而OsCPK12-K僅含有激酶結構域就足以進行這種交互作用(圖2)。
為了進一步確認OsCPK12和OsCATs之間的交互作用,研究者進行了雙分子熒光互補(BiFC)實驗。 首先, 研究者分析了CATs的亞細胞定位 。有研究表明,OsCATA主要位於細胞質中,OsCATB和OsCATC則主要位於過氧化體中。與前人研究結果一致, 本研究結果顯示,OsCATA主要定位於細胞質中(圖S3A和S3D), OsCATB和OsCATC主要定位於過氧化體中(圖S3B和S3E)。 然而,OsCATA-GFP、OsCATB-GFP和OsCATC-GFP融合蛋白也表現出明確的細胞核定位(圖S3G-S3I),並且在水稻原生質體和本氏煙草中瞬時表達時均表現出微弱但清晰的質膜定位(圖S3J-S3L)。 為了進一步驗證OsCATA、OsCATB和OsCATC的亞細胞定位,研究者將GFP融合到它們的N端,得到GFP- OsCATA、GFP- OsCATB和GFP-OsCATC融合蛋白。 這些融合蛋白與OsCATA-GFP、OsCATB-GFP和OsCATC-GFP具有相同的熒光訊號結果(圖S3M-S3O)。
為了檢測OsCATs的核定位,研究者利用從ZH8015瞬時轉化的OsCATA-GFP、OsCATB-GFP和OsCATC-GFP的原生質體中提取的總蛋白和核蛋白進行了免疫墨點分析。OsCATA-GFP、OsCATB-GFP和OsCATC-GFP蛋白均存在於總蛋白和核蛋白中,證實了OsCATs的核定位(圖S4)。雙分子熒光互補實驗分析顯示,共表達OsCPK12-HYCE和OsCATs-HYNE的細胞中存在強烈的黃色熒光蛋白(YFP)訊號,這些訊號與Lazy1-mCherry訊號完美融合。而在相同條件下,共表達的OsCPK12-HYCE 和 GST-HYNE細胞中未檢測到訊號,這表明OsCPK12與CATs有特異性交互作用,且OsCPK12/CAT復合物定位於質膜(圖2B和2C圖S5A和S5B)。 先前的研究報道了大多數CPKs主要或部份是膜錨定的。膜結合主要與預測的N端肉豆蔻酰化位點或一些額外的可逆過程有關,如棕櫚酰化、蛋白質交互作用和磷酸化調節的多堿結構域。 因此,研究者預測OsCPK12可能靶向膜參與應激刺激的訊息傳遞。
接下來,研究者進行熒光素酶互補成像(LCI)實驗。結果表明,共表達CATs-NLuc和CLuc-OsCPK12在本氏煙草葉片表現出較強的熒光性,CATA-NLuc和CLuc-OsCPK12的熒光素酶相對活性接近30000,CATB-NLuc和CLuc-OsCPK12l的熒光素酶相對活性為80000,CATC-NLuc和CLuc-OsCPK12共表達細胞熒光素酶相對活性為40000。 相比之下,對照組的共表達僅顯示LUC活性的背景水平(圖2D和2E,圖2F和2G圖S5C和S5D)。 由於在隨後的工作中發現OsCATA和OsCATC被OsCPK12磷酸化(圖S6),研究者透過共免疫沈澱(Co-IP)實驗進一步證實了OsCPK12與OsCATA和OsCATC之間的交互作用。 結果顯示,OsCATA-GFP和OsCATC-GFP融合蛋白與OsCPK12-Myc共免疫沈澱,但不與OsCPK12-L/R-Myc共免疫沈澱(圖2H)。 研究者還使用OsCPK12-Myc與OsCPK12-Myc OsCATC-Ha、OsCATC-Ha和CLuc-Ha、OsCATC-Ha和OsCATC-Ha融合蛋白進行共免疫沈澱,但結果表明OsCPK12-Myc不能共免疫沈澱CLuc-Ha (圖S5E)。同時,將純化的重組His-TF-OsCPK12和GST/OsCATA-GST/OsCATC-GST進行下拉實驗。 正如預期一樣,His-TF-OsCPK12拉低了OsCATA-GST和OsCATC-GST,但GST沒有被拉低 (圖2I)。 綜上所述,這些結果表明OsCPK12與OsCATs交互作用。
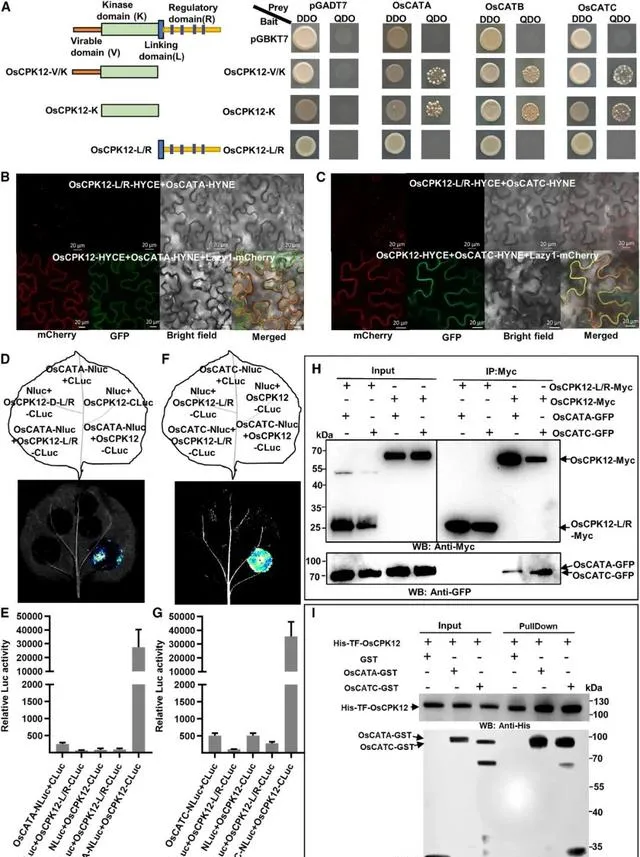
圖2. OsCPK12與OsCATA和OsCATC互動作用。 (A) OsCPK12與OsCATA和OsCATC交互作用的酵母雙雜交實驗。(B-C)雙分子熒光互補(BiFC)實驗表明,OsCPK12與OsCATA和OsCATC之間有交互作用,透過農業滲透法在本氏煙中短暫表達上述結構體,浸潤4 d後使用雷射掃描共聚焦顯微鏡(ZEISS 750)觀察熒光。以OsCPK12-L/R-HYCE為陰性對照。Lazy1-mCherry作為細胞膜標記物。(D) LCI實驗驗證OsCPK12與OsCATA之間的交互作用。OsCPK12-CLuc和NLuc-OsCATA在煙葉共滲中瞬間表達。NLuc和CLuc為陰性對照。在2 DAI時,用低光、冷卻的CCD成像儀監測發光。(E) 葉片中LUC活性的量化如圖(D)所示。數據以mean+SD (n=3)表示。(F)熒光素酶互補成像實驗表明,OsCPK12與OsCATC之間具有交互作用。OsCPK12-CLuc和NLuc-OsCATC透過共浸潤在本氏煙中瞬間表達。NLuc和CLuc為陰性對照。在2 DAI時,用低光、冷卻的CCD成像儀監測發光。(G) F所示葉片中LUC活性的量化。數據以mean+SD(n=3)表示。(H) OsCPK12與OsCATA和OsCATC交互作用的共免疫沈澱測定。用 anti-Myc 瓊脂糖珠免疫沈澱轉染OsCPK12-Myc/OsCPK12-L/R-Myc、OsCATA-GFP和OsCATC-GFP的水稻原生質體總蛋白萃取物。用 anti-GFP 和 anti-Myc 抗體檢測粗裂解物(左,輸入)和免疫沈澱蛋白(右)的蛋白質。(D) OsCPK12與OsCATA和OsCATC交互作用的拉下實驗。從大腸桿菌中表達His-TF- OsCPK12、OsCATA-GST、OsCATC-GST和GST,並進行His下拉實驗。GST作為對照。清洗後的His樹脂用 anti-GST 和 anti-His 抗體免疫墨點法分別檢測固定化蛋白和拉下蛋白。用指定抗體免疫墨點法檢測輸入蛋白。
4 OsCPK12磷酸化OsCATA和OsCATC
為了檢測OsCPK12是否能磷酸化水稻原生質體中的CATs,研究者進行了體內磷酸化實驗。 如圖S6所示,Phos-Tag免疫墨點實驗在ZH8015中檢測到OsCATC-myc和OsCATC-myc的較高條帶。而OsCATB-myc並沒有磷酸化差異。 這些結果表明,OsCPK12可以在體內磷酸化OsCATA和OsCATC。為了進一步研究OsCATA和OsCATC是否可以被OsCPK12磷酸化,研究者使用重組OsCATA-GST、OsCATC-GST和His-TF-OsCPK12或His-TF-OsCPK12(變性His-TF-OsCPK12)進行了體外磷酸化實驗 。如圖3A和3B所示,當OsCATA-GST和OsCATC-GST與His-TF-OsCPK12孵育時,Phos-Tag免疫墨點上檢測到兩條條帶,隨著反應時間的延長,高遷移率的條帶變粗。然而,當OsCATA-GST和OsCATC-GST與變性的OsCPK12孵育時,沒有出現差異條帶(圖S7A), 這表明OsCATA-GST和OsCATC-GST在OsCPK12存在下可以被體外磷酸化。為了更好地區分磷酸化和非磷酸化的條帶,研究者還使用截斷的OsCATA(1-403 aa)( OsCATA-N-GST)、OsCATC(1-403 aa)( OsCATC-N-GST)、OsCATA(404-493 aa)( OsCATA-C-GST)和OsCATC(404-493 aa)( OsCATC-C-GST)進行體外磷酸化測定 。 研究者觀察到OsCPK12可以磷酸化OsCATA-N-GST和OsCATC-N-GST(圖S7C和S7D),但不磷酸化OsCATA-C-GST和OsCATC-C-GST(圖S7E和S7F);OsCATA-N-GST和OsCATC-N-GST不被His-TF-OsCPK12-Dead磷酸化(圖S7B)。上述結果表明,OsCATA和OsCATC是OsCPK12的候選受質,OsCPK12可以磷酸化OsCATA和OsCATC的N端。
為了確定OsCATA和OsCATC的磷酸化位點,研究者從含有磷酸化的OsCATA和OsCATC的凝膠(GST-OsCATA和GST-OsCATC經His-TF-OsCPK12孵育)和OsCATA-CK和OsCATC-CK (OsCATA-GST和OsCATC-GST經His-TF孵育)中剪下條帶,從條帶中提取蛋白質,並使用液相色譜-串聯質譜(LC-MS/MS)搜尋其磷酸化位點 。 最終,研究者在His-TF-OsCPK12孵育的OsCATC樣品中檢測到7個磷酸化位點(Ser10、Ser11、Ser104、Thr105、Ser164、Thr105和Ser437),在His-TF-OsCPK12孵育的OsCATC樣品中檢測到10個磷酸化位點(Ser9、Ser10、Ser11、Ser18、Thr19、Ser21、Ser347、Thr351、Thr412和Thr414) ,但在His-TF孵育的OsCATA-CK和OsCATC-CK樣品中未檢測到磷酸化位點(補充表1)。 研究結果表明,OsCPK12可以磷酸化OsCATA和OsCATC的N端,其中OsCATA和OsCATC分別有6個(Ser10、Ser11、Ser104、Thr105、Ser164和Thr351)和8個(Ser9、Ser10、Ser11、Ser18、Thr19、Ser21、Ser347和Thr351)可能的磷酸化位點。
為了驗證OsCATA和OsCATC的特異性磷酸化位點,研究者用Ala(A)代替了這些Ser(S)和Thr(T)殘基來模擬非磷酸化 。 體外磷酸化實驗結果顯示,OsCATA-NS10A-GST、OsCATA-NS104AS105A-GST、OsCATA-NS164A-GST和OsCATA-NT351A-GST具有與OsCPK12介導的OsCATA-N相似的明顯的磷酸化條帶(圖3C)。但在OsCATA-NS10A/S11A-GST和OsCATA-NS11A-GST中未檢測到磷酸化帶 。 因此,OsCATA的11號絲胺酸位元點是OsCPK12辨識的主要磷酸化殘基 。 OsCATC和OsCPK12之間的體外磷酸化實驗顯示,OsCATC-NS9A/S10A/S11A/S18A/T19A/S21A-GST、OsCATC-NS9AS10AS11A-GST或OsCATC- NS11A-GST幾乎沒有磷酸化 ; 其他單點突變蛋白OsCATC-NS18A/TI9A/S21A-GST、OsCATC-NS9A/S10A-GST、OsCATC-NS347A-GST和OsCATC-NT351A-GST也表現出類似的OsCPK12介導的磷酸化(圖3D )。 這些結果表明,OsCATC的11號絲胺酸位元點是OsCPK12的主要磷酸化位點,OsCPK12可能磷酸化OsCATA和OsCATC的11號絲胺酸位元點。

圖3 . OsCPK12在體外磷酸化OsCATA和OsCATC的絲胺酸11位點。 (A)OsCPK12在體外磷酸化OsCATA。考馬斯亮藍(CBB)染色檢測輸入蛋白OsCATA和OsCPK12。磷酸化活性透過Phos-Tag SDS-PAGE免疫墨點分析檢測。(B)OsCPK12體外磷酸化OsCATC。CBB染色檢測輸入蛋白OsCATC和OsCPK12。磷酸化活性透過Phos-Tag SDS-PAGE免疫墨點分析檢測。(C)OsCPK12在體外磷酸化OsCATA的Ser11。在Phos-Tag SDS-PAGE後用抗gst探針檢測蛋白磷酸化(上),在標準SDS-PAGE凝膠中用CBB染色顯示蛋白負載(下)。(D)OsCPK12在體外磷酸化OsCATC的Ser11位點。Phos-Tag SDS-PAGE後用抗gst探針的免疫墨點檢測蛋白磷酸化(上),用標準SDS-PAGE凝膠染色CBB表示蛋白負載(下)。
5 敲除OsCATA和OsCATC導致CAT活性降低和pO2的累積
研究者利用CRISPR-Cas9技術在ZH8015水稻品系背景下構建了多種 OsCATA ( oscata - cr )和 OsCATC ( oscatc - cr )敲除品系,並研究它們在水稻中的功能 。 研究者總共生成了三個獨立的 oscatc-cr 品系和兩個獨立的 oscatc-cr 品系(圖4A和圖4B)。從三葉期(圖S8A和S8B,圖S8D和S8E)到成熟期(圖4A),所有 oscatc-cr 品系和oscatc-cr品系都表現出明顯的葉片白化和細胞死亡表型。 noel 是OsCATC的一個功能缺失突變,也表現出pO2過度積累並導致葉片細胞死亡。
與野生型ZH8015品系相比, oscata-cr 品系和 oscatc-cr 品系水稻植株高度明顯降低(圖4C) 。 oscatc-cr品系和oscatc-cr品系的單株有效穗數顯著低於野生型(圖4D)。 oscata-cr 品系和 oscatc-cr 品系結實率顯著降低,為20.20-30.49%,僅為野生型ZH8015品系的1/4(圖4E) 。 oscata-cr 和 oscatc-cr 品系水稻千粒重顯著低於ZH8015(圖4F)。研究者還測定了抽穗期 oscata-cr 和 oscatc-cr 品系植株葉片pO2含量和CAT活性。結果發現 oscata-cr 和 oscatc-cr 植株品系葉片中pO2含量也顯著積累(圖4G),CAT活性低於ZH8015(圖4H) ,與 noel 表型一致。 過氧化物酶DAB法染色結果顯示,幼苗期 oscata-cr 品系和 oscatc-cr 品系葉片中pO2積累量較高(圖S8C和S8F)。上述結果表明,敲除OsCATA和OsCATC會導致水稻體內pO2積累,降低CAT酶活性,嚴重影響水稻的生長發育,最終導致水稻產量顯著下降。
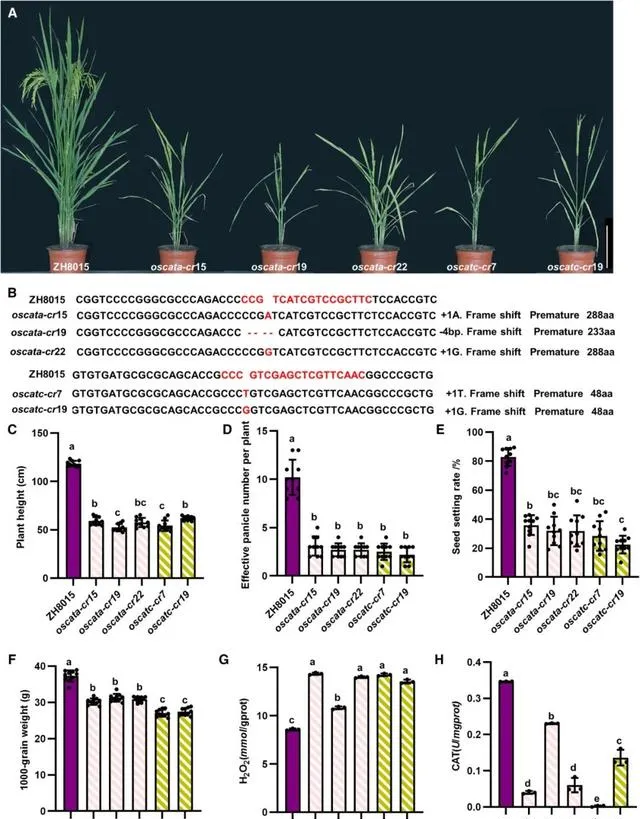
圖4. oscatc-cr 和 oscatc-cr 品系的表型。 (A) oscata-cr 和 oscatc-cr 品系的表型(Bar=20 cm)。 (B) oscata-cr 和 oscatc-cr 品系的基因型。(C) ZH8015、 oscata-cr 和 oscatc-cr 品系植株高度。(D) ZH8015、 oscata-cr 和 oscatc-cr 品系的單株有效穗數(E) ZH8015、 oscata-cr 和 oscatc-cr 品系的結實率(F) ZH8015、 oscata-cr 和 oscatc-cr 品系的千粒重。(C,D,E和F)數據以mean+SD (n 10)表示。柱形以上不同字母表示差異顯著( P <0.05)。P值的確定和分析采用單因素變方分析,然後采用Tukey多重比較。(G) ZH8015、 oscata-cr 和 oscatc-cr 品系植株葉片中H 2O 2含量(H) ZH8015、 oscata-cr 和 oscatc-cr 品系植株葉片中CAT活性。(G和H)數據以mean+SD(n=3)表示。柱形以上不同字母表示差異顯著( P <0.05)。P值的測定和分析采用單因素變方分析,然後采用Tukey多重比較。
6 OsCATA和OsCATC的磷酸化可提高它們的活性
為了研究OsCATA和OsCATC的11號絲胺酸位元點磷酸化在植物中的意義,研究者將OsCATA和OsCATC的11號絲胺酸位元點殘基突變為Ala(A)和Asp(D),分別模擬非磷酸化蛋白(OsCATAS11A和OsCATCS11A)和磷酸化蛋白(OsCATAS11D和OsCATCS11D) 。 OsCATAS11A、OsCATCS11A、OsCATAS11D 和 OsCATCS11D 在 oscpk12-cr 品系中過表達,分別產生 OsCATAS11A -OE、 OsCATCS11A -OE、 OsCATAS11D -OE和 OsCATCS11D -OE( 圖5A和5B)。研究者還測定了正常生長條件下過表達植株和 oscpk12-cr 植株的CAT活性和pO2濃度。 與 OsCATAS11 A-OE植株相比, oscpk12-cr / OsCATAS11D -OE和 oscpk12-cr / OsCATCS11D -OE植株的CAT活性顯著增強,且過表達基因改造植株葉片中pO2積累量較低(圖5C-5F)。然而, oscpk12-cr / OsCATAS11A -OE和 oscpk12-cr / OsCATCS11A -OE的CAT活性和pO2濃度與 oscpk12-cr 植株相似(圖5C-5F)。上述結果表明, OsCATAS11D -OE和 OsCATCS11D -OE能在一定程度上挽救 oscpk12-cr 植株的CAT活性,而 OsCATAS11 A-OE和 OsCATCS11A -OE不能。總之,這些結果表明, OsCATAS11D 和 OsCATCS11D 在植物中表現出更高的CAT活性。
為了證明OsCPK12磷酸化OsCATA和OsCATC確實可以增加過氧化氫酶活性,研究者還使用純化的OsCATA、OsCATAS11A、OsCATAS11D、OsCATC、OsCATCS11A和OsCATCS11D進行了CAT活性體外測定 (圖S9)。 結果顯示,OsCATAS11D和OsCATCS11D的CAT活性高於野生型OsCATA和OsCATC、OsCATAS11A和OsCATCS11A(圖5G)。並在OsCPK12存在的情況下,分析OsCATA和OsCATC的CAT活性。 正如預期的那樣,OsCPK12顯著增強了OsCATA和OsCATC的CAT活性(圖5G)。OsCATB和OsCATC的蛋白質穩定性也會因其搭檔的不同而發生變化。例如,APIP6促進OsCATC的降解,從而減弱OsCATC介導的pO2清除效率。水稻增強型病害易感性1(OsEDS1)與OsCATC交互作用,穩定OsCATC,提高OsCATC介導的pO2清除能力;半卷葉水稻10-SRL10可以穩定OsCATB,增強CAT活性,調節水稻葉片形態和耐熱性。 因此,研究者推測CPK12也可能透過改變CAT的蛋白穩定性來改變CAT的活性。然而,與野生型ZH8015相比,突變型 oscpk12-cr 品系OsCATA和OsCATC的蛋白水平沒有變化(圖5H) 。研究者還觀察到OsCATA和OsCATC在ZH8015和OsCPK12 -cr原生質體中的亞細胞定位是一致的, 這表明OsCPK12介導的磷酸化並不調節OsCATA和OsCATC的蛋白穩定性和亞細胞定位。上述結果表明,OsCPK12磷酸化OsCATA和OsCTAC的11號絲胺酸位元點可增強它們的CAT活性。
圖5. 在體內和體外OsCATA和OsCATC Ser11位點的磷酸化啟用了它們的CAT活性 , 對ZH8015和 oscpk12-cr 品系得OsCATA和OsCATC進行免疫墨點分析。 (A) OsCATA 在過表達 OsCATAS11A 和 OsCATAS11D的oscpk12 - cr 品系 幼苗葉片(T2)中相對表達量。(B) OsCATC 在過表達 OsCATAS11A 和 OsCATAS11D的oscpk12 - cr 品系 幼苗葉片(T2)中相對表達量。 (C) oscpk12-cr 品系過表達 OsCATAS11A 和 OsCATAS11D 的基因改造幼苗(T2)的H 2O 2含量,以ZH8015 (WT)和 oscpk12-cr 為對照。(D) oscpk12-cr 品系過表達 OsCATAS11A 和 OsCATAS11D 的基因改造幼苗(T2) H 2O 2含量。(E)在 oscpk12-cr 品系過表達 OsCATAS11A 和 OsCATAS11D 的基因改造幼苗(T2)的CAT活性。以ZH8015(WT)和 oscpk12-cr 幼苗為對照。(F) oscpk12-cr 品系過表達 OsCATAS11A 和 OsCATAS11D 的基因改造幼苗(T2)的CAT活性。以ZH8015 (WT)和 oscpk12-cr 植株品系幼苗為對照。(G) OsCATA和OsCATC Ser11位點的磷酸化啟用了它們在體外的CAT活性。OsCATA S11A-GST和OsCATC S11A-GST,重組OsCATA和OsCATC的Ser11的突變為Ala,OsCATA S11D-GST和OsCATC S11D-GST,重組OsCATA和OsCATC的Ser11突變為Asp。分別純化OsCATA-GST、OsCATA S11A-GST、OsCATA S11D-GST、OsCATC-GST、OsCATC S11A-GST、OsCATC S11D-GST和His-TF-OsCPK12並測定體外CAT活性。(A-G)數據以mean+SD(n=3)表示。柱形以上不同字母表示差異顯著( P <0.05)。p值的確定和分析采用單因素變方分析,然後采用Tukey多重比較。(H) ZH8015和 oscpk12-cr 植株品系OsCATA、OsCATC和Actin的免疫墨點分析。總蛋白分別從ZH8015和 oscpk12-cr 植株品系葉片中提取。用抗OsCATA、OsCATC和β-actin血清(Anti-OsCATA、Anti-OsCATA和Anti-Actin)進行墨點。上圖數據為OsCATA/Actin與OsCATC/Actin蛋白強度之比。
7 OsCPK12正調控水稻的氧化耐受性
為了研究OsCPK12對氧化耐受性的響應機制,研究者將野生型、過表達的OsCPK12( OsCPK12-OE )基因改造品系和敲除品系( oscpk12-cr )的三葉期幼苗分別用100 mM pO2或100 mM pO2和20uM褪黑激素進行處理。處理6d後,測定幼苗葉綠素含量、pO2含量和CAT活性 。在正常條件下, OsCPK12-OE 品系、基因改造 oscpk12-cr 品系和野生型幼苗的生長無顯著差異。但在pO2處理6d後, oscpk12-cr 品系出現了嚴重的黃變、卷葉和幹燥(圖6A),而ZH8015品系的葉片出現了褪綠、卷曲和幹燥。 OsCPK12-OE 品系的葉片也出現了褪綠和卷曲的現象,但這兩種效應都弱於ZH8015品系(圖S10A和S10B)。
OsCPK12-OE 品系葉片中pO2的積累量較低,而 oscpk12-cr 品系葉片中pO2的積累量較高(圖6B)。與ZH8015和 OsCPK12-OE 品系葉片相比, oscpk12-cr 品系葉片的CAT活性較低(圖6C)。 這些結果表明,水稻中過表達 OsCPK12 可以提高氧化脅迫的耐受性。褪黑素對植物細胞的氧化還原平衡、減少活性氧以及調節生物和非生物脅迫耐受性至關重要。與100 mM pO2脅迫的水稻植株相比,添加20 µM褪黑素顯著緩解了100 mM pO2脅迫引起的水稻葉片衰老表型,減少了葉片中pO2的積累(圖6A和圖6B)。DAB染色結果進一步測定了 oscpk12-cr 品系葉片中pO2的積累情況(圖6D)。這些結果表明,水稻過表達 OsCPK12 可以提高其氧化脅迫的耐受性 。

圖6. OsCPK12正向影響水稻的氧化耐受性。 10 d齡的幼苗移栽到添加了100 mM H 2O 2或100 mM H 2O 2和20 µ M褪黑素的培養基中6 d。(A) H 2O 2脅迫和H 2O 2褪黑素脅迫下水稻植株的表型比較。(B) H 2O 2脅迫和H 2O 2褪黑素脅迫下水稻植株葉片中H 2O 2含量。數據以mean+SD(n =3)表示。采用 Student’s t 檢驗,* P <0.05,** P <0.01。(C) H 2O 2脅迫和H 2O 2褪黑素脅迫下水稻葉片CAT活性變化。數據以mean+SD(n=3)表示。采用 Student’s t 檢驗,* P <0.05,** P <0.01。(D)未處理、H 2O 2處理和H 2O 2+褪黑素處理葉片中H 2O 2的DAB染色。
討論
1 OsCPK12是一種弱Ca2+依賴性蛋白激酶,具有典型的豆蔻酰化位點,定位於膜、細胞質和細胞核中
OsCPK12參與多種訊號通路,參與訊息傳遞通路,參與低氮脅迫響應,參與調節葉片衰老,正調控植株耐鹽性,負調控植株的抗旱性。 oscpk12 通常在播種後60天左右呈現葉片泛黃。 CAT活性和pO2水平在播種後40天和40天後的ZH8015和 oscpk12 品系植株之間存在顯著差異(圖S1A和S1B),而OsCPK12在播種後20天的表達水平較高(圖S1C)。研究者推測,植物出現生理差異可能需要一個特定的時間。
CPKs是植物訊號傳導的關鍵因子,將鈣訊號傳遞到生理反應中,並表現出高度可變的鈣依賴性。越來越多的CDPK酶已經被發現在其體外激酶活性中顯示出較低或甚至不可檢測到的鈣離子依賴性變化,盡管CDPK家族具有保守模結構並能推匯出鈣離子依賴性CDPK啟用模型。一些CPKs需要增加細胞質內的鈣離子,而另一些則在基礎[Ca2+]上活躍和/或可能包含退化的EF手型,這表明參與了磷酸化或結合夥伴等其他調節機制。 本研究表明,加入鈣離子後,重組OsCPK12的激酶活性增強(圖1C和1D)。 先前有研究表明,鈣離子依賴性可以透過故意去除CAD結構域而與激酶活性解耦聯,通常導致CPKs解除調控或不受抑制。然而,一些截斷的變體例如TgCDPK1和OsCPK17完全失活,或者與鈣啟用的全長激酶相比活性降低。 在本研究中,OsCPK12- v/K(沒有CAD結構域的OsCPK12)不是一個組成活性激酶 (圖2A和2B)。 Km 值可用於確定受質與酶的親和力,激酶的 Km 值常隨受質的不同而變化。以syntide 2作為受質,OsCPK12的 Km 值為2.97 μM (圖1E)。OsCPK12對OsCATA(1-40aa)肽和OsCATC(1-40aa)肽的 Km 值分別為57.99 uM和135.3 μM(圖S11A和S11B), 說明OsCPK12對OsCATA(1-40aa)肽的反應速率更為敏感。
亞細胞定位對於CPK的功能也是必不可少的。CPKs表現出不同的亞細胞定位,包括細胞質、細胞核、質膜、內質網、過氧化體、粒線體外膜和植物油體。 在本研究中,結果顯示OsCPK12主要定位於質膜,但也定位於細胞質、細胞核和內質網(圖S2A-S2G) 。Xing等發現OsCPK12僅位於細胞膜上。研究者本次實驗的結果與Xing等人的結果不一致可能是由於OsCPK12-GFP蛋白表達水平的差異。 有研究認為N -豆蔻酰化位點可能與CPKs的膜結合有關。阿拉伯芥CPK4和CPK11缺乏任何酰化基序是可溶的,而其他11個CPKs (CPK2、CPK5、CPK25、CPK3、CPK9、CPK7、CPK8、CPK10、CPK13、CPK30和CPK32)顯示預測的肉豆蔻酰化位點,主要或部份與膜相關。NMT和Myristoylator線上網站預測OsCPK12可以在甘胺酸第2位點發生豆蔻酰化。 在本研究中,OsCPK12-V-GFP定位於質膜(圖S2I和S2J)。 奇怪的是,OsCPK12- v /K和OsCPK12-K的亞細胞定位與全長OsCPK12相似。這可能是因為膜結合不僅與預測的N端豆蔻酰化位點有關,還與一些額外的可逆過程有關,如棕櫚酰化、蛋白質交互作用和由磷酸化調節的多堿結構域。
CDPKs也可在應激刺激下易位。McCDPKI(Mesembryanthemum crystallinum CDPK1)在非脅迫細胞中主要與質膜相關,但在鹽脅迫下,McCDPKI更多地定位於細胞核中與CSP1交互作用。AtCPK10/30/32轉運到細胞核響應硝酸鹽。ETI啟用時,AtCPK5與TF WRKY8、28或48協同啟用防禦基因需要細胞質到細胞核的易位。缺氧時,AtCPK12在Ser-186殘基處被迅速啟用和磷酸化,磷酸化後的CPK12從細胞質穿梭到細胞核,磷酸化ERF-VII以增強其穩定性。 研究者們預測OsCPK12透過允許自身作為膜蛋白或相關膜靶蛋白的調節劑參與響應應激刺激的訊息傳遞來靶向細胞膜。OsCPK12的功能是否受到不同定位模式的影響,需要透過基因互補實驗進一步研究。
2 水稻CAT同工酶協同調節植株發育
植物過氧化氫酶分為三類。 AtCAT1 主要在植物生殖組織和種子中表達,而 AtCAT2 在光合組織中強烈表達, AtCAT3 在根和幼葉中有基本性表達。AtCATI、AtCAT2和AtCAT3分別屬於III類、I類和II類。在水稻中,已經鑒定出三種 CAT 同源物: OsCATA、OsCATB 和 OsCATC 。 OsCATC 屬於I類, OsCATA 屬於II類, OsCATB 屬於III類。
OsCATA在所有器官中均有表達,在葉片中表達量最高;OsCATB主要在根中表達;OsCATC主要在葉片中表達。 本研究結果顯示,OsCATA和OsCATC在葉、莖和鞘等綠色組織中高表達(圖S12A和圖S12C),與OsCPK12的表達模式一致,而OsCATB在莖、根和穗中高表達 (圖S12B)。CATs的功能不僅與其時空表達有關,還與其亞細胞定位有關。以往研究表明,OsCATA主要定位於細胞質,而OsCATB和OsCATC主要定位於過氧化體。 研究者還在細胞核和細胞膜中檢測到了OsCATA、OsCATB和OsCATC的GFP熒光訊號 (圖S2和補充圖S3)。先前的研究表明,OsCATA、OsCATB和OsCATC與水稻膜上的STRKI交互作用。CAT3定位於阿拉伯芥的過氧化體、細胞質和細胞膜,並與細胞膜上的CPK8交互作用。 因此,CAT可以與細胞膜上的一些激酶交互作用並被啟用。OsCATB-GFP也透過PM處的弱熒光訊號被檢測到, OsCATC被發現定位於間斷的細胞隔室 。然而, 本研究結果不僅證實了OsCATs確實定位在細胞膜上,而且還表明OsCATA、OsCATB和OsCATC定位在細胞核中 。
不同的CAT同工酶可能協同參與植物的生長發育。對阿拉伯芥葉片CAT同工酶譜分析表明,光呼吸主要與CAT2相關,CAT3波段也逐漸明顯。此外,在阿拉伯芥的生長和衰老過程中發現了一些雜交CAT全酶帶,這表明阿拉伯芥葉片中的CAT全酶不僅涉及CAT2,還涉及CAT3。CAT全酶為四聚體形式,分子量約為220 kD,主要由阿拉伯芥葉片中的CAT2和CAT3編碼。水稻CAT可能是水稻葉片中主要CAT酶的同源或異源復合物,主要來源於OsCATC低聚物。最近有相關研究還表明,OsCATA、OsCATB和OsCATC可能參與AvrPiz-t-ROD1-CATs-APIP6/RIP1分層調節免疫網路,這表明水稻過氧化氫酶可能作為同源或異源復合物發揮作用。 本研究結果表明,OsCATA、OsCATB和OsCATC以Serll磷酸化不依賴的方式交互作用,OsCATA和OsCATC的Serl1磷酸化缺失也不影響它們與OsCPK12的交互作用 (圖S13和圖S14)。
noel 是OsCATC的一個功能缺失突變,也表現出pO2過度積累會導致葉片細胞死亡。 在本研究結果中, oscata-cr 和 oscatc-cr 品系表現出相似的光呼吸缺陷表型(圖4和圖S8),而 oscatb-cr 品系植株沒有表現出明顯的早衰表型。 大量研究表明,CAT不僅是一種關鍵的pO2清除酶,而且在葉片形態中也起著重要作用。阿拉伯芥CAT2突變由於生長素水平的變化導致葉片變暗。水稻中OsCATB功能的喪失導致旗葉反向卷曲。 因此,研究者推測O sCATB 主要參與水稻葉片形態的發育,而 OsCATA 和 OsCATC 可能直接參與水稻的光呼吸過程。
3 OsCPK12與OsCATA和OsCATC交互作用並磷酸化以調節體內過氧化氫平衡
pO2作為氧化還原訊號的主要傳遞者,直接參與衰老等多種生物過程。植物體內pO2的濃度通常維持在較低水平,以避免細胞毒性作用。過氧化體中的pO2濃度可低至10 μM,正常條件下水稻葉片中的pO2濃度約為253 μM。所需和適當的pO2水平由CAT、抗壞血酸過氧化物酶(APX)、谷胱甘肽過氧化物酶(GPX)和苯酚過氧化物酶控制。CAT是pO2的主要清除劑,將pO2降解為氧氣和水,主要存在於過氧化體中。CATs具有非常快的周轉率,但與APX和過氧化物氧還蛋白(PRX)等酶相比,其對pO2的親和力非常低。據報道,不同生物中pO2 CAT的表觀 Km 值從38到600 mM不等。因此,植物需要機制來增強CAT對它們通常維持的低濃度pO2的更高畫質除效率。
大量研究表明,CAT的磷酸化可能導致活性增加,不同的磷酸化位點可能與不同的刺激有關。例如,內皮素-1透過蛋白激酶C (PKCS)介導的絲胺酸167號位點磷酸化刺激CAT活性。CPK8可以磷酸化CAT3的Ser261,調節阿拉伯芥CAT的活性。STRKI透過磷酸化水稻中的Tyr210啟用OsCatC。 在本研究中, OsCPK12- OE品系 植株葉片中的CAT活性高於ZH8015、oscpk12和oscpk12-cr品系植株(圖1D)。OsCPK12主要在OsCATA和OsCATC的Ser11位點發生磷酸化。OsCATA/OsCATC的Ser11在OsCATB中不保守(圖S12D), CATB中的胺基酸為Gly11。此外,過表達持續磷酸化的OsCATAS11D-OE和OsCATCS11D-OE可以提高 oscpk12-cr 品系植物的CAT活性,降低pO2含量,而未磷酸化的 Os CATA S11A -OE 和 OsCATCS11A -OE則沒有作用。在體外,OsCATAS11D、OsCATCS11D、OsCPK12介導的預磷酸化OsCATA和OsCATC均表現出比野生型OsCATA和OsCATC、OsCATAS11A和OsCATCS11A更高的CAT活性(圖5E) 。 本研究結果表明,OsCATA和OsCATC在絲胺酸11號位點的磷酸化提高了它們的CAT活性,從而改善了水稻的氧化耐受性。 先前的研究也表明,大多數野生型CAT以單體和二聚體的混合形式存在,但S167D型CAT主要是四聚體,這是最大活性所必需的, 這表明特定位點的磷酸化可以透過影響CAT的聚合物形式來影響CAT的活性。本研究結果表明,OsCATA和OsCATC在絲胺酸11號位點的磷酸化提高了它們的CAT活性,從而提高了水稻的氧化耐受性
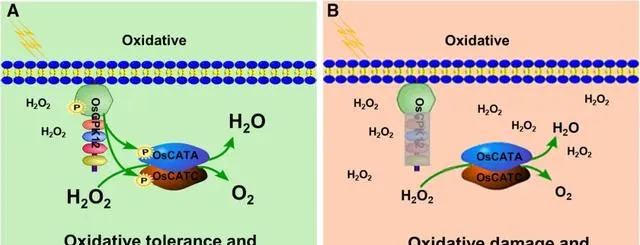
圖7. OsCPK12調控水稻氧化耐受性模型。 在野生型植株中,OsCPK12的磷酸化主要透過在Ser11位點磷酸化來增加OsCATA和OsCATC的活性,從而抑制H 2O 2的積累。然而,在突變植株中,OsCPK12的功能喪失不能磷酸化OsCATA和OsCATC,未磷酸化的OsCATA和OsCATC具有較低的CAT活性。低CAT酶活性導致H 2O 2積累,使植株處於氧化應激狀態。綜上所述,OsCPK12磷酸化OsCATA和OsCATC的Serl1位點,增加其維持H 2O 2穩態的活性,並且OsCPK12的過表達提高了水稻對氧化脅迫的耐受性。綠色背景為野生型,粉色背景為突變型;P,磷酸化基團;字型越大,酶活性越強。
如圖7建立的模型所示,在野生型植株中,OsCPK12的磷酸化主要透過在絲胺酸11號位點磷酸化來增加OsCATA和OsCATC的活性,從而抑制pO2的積累。然而,在突變品系中,OsCPK12的功能缺失不能磷酸化OsCATA和OsCATC,未磷酸化的OsCATA和OsCATC具有較低的CAT活性。低CAT酶活性導致pO2積累,使植株處於氧化應激狀態。綜上所述,OsCPK12磷酸化OsCATA和OsCATC的Ser11位點,增加其維持pO2穩態的活性,並且OsCPK12的過表達提高了水稻對氧化脅迫的耐受性。











