一氧化氮(NO)曾普遍被視為一種有毒有害瓦斯,應盡可能遠離。然而,後來的科學研究揭示它在生物體內發揮極為重要的生理作用,NO是第一個被發現在動物體內起到瓦斯訊號分子作用的物質。這項開創性的工作是由美國藥理學家斐瑞德·穆拉德透過實驗闡明的,最初他意外發現了含氮物質能夠啟用特定的酶,進而揭開了硝化甘油治療心絞痛的機理——即一氧化氮分子介導的訊息傳遞能夠促使平滑肌舒張;同時進一步證實了內源性NO的存在。本文將主要介紹穆拉德的科研歷程,展示他如何逐步取得這項重大發現,見證科學與生命的奇妙邂逅。
撰文 | 郭曉強 (河北體育學院)
提到一氧化氮 (Nitric oxide,NO) ,大家第一印象是一種有毒瓦斯和環境汙染物,事實也的確如此,但這種看法忽視了它在人體中的重要作用。
NO無色無味,於1779年由英國著名化學家約瑟夫·普利斯泰瑞 (Joseph Priestley) 首先發現,他還發現一氧化二氮、二氧化氮、氧氣、氨氣、氯化氫等眾多瓦斯。後續研究中,NO都被看作大氣汙染物,是煙草、柴油和汽油等燃燒副產品,經機動車排放、工業排放和微生物釋放等過程產生。毒理學實驗顯示,吸入一定量NO (具體數值可能因條件和個體差異而異) 可導致輕度呼吸急促和咳嗽,一段時間後出現支氣管痙攣和肺水腫;吸入高濃度NO會造成燒傷、痙攣、喉嚨組織腫脹、上呼吸道阻塞甚至死亡。工作場所NO濃度允許上限為8小時內25ppm (part per million,百萬分之一) ,當達到100ppm時對生命和健康造成嚴重危險。
直到20世紀70年代,美國藥理學家斐瑞德·穆拉德 (Ferid Murad) 首先揭示了其有益的一面,並進一步發現它在體內還發揮著至關重要的生理功能,NO這個「百害而無一利」的標簽才被去除。穆拉德也因此與他人共享了1998年的諾貝爾生理學或醫學獎。

斐瑞德·穆拉德(Ferid Murad,1936.9.14—2023.9.4)
一
誌存高遠
1936年9月14日,穆拉德出生於美國印地安納州懷廷市一個移民家庭。父親來自艾爾巴尼亞,以經營小雜貨店為生,因此經濟條件有限,全家五口擠在一個不滿50平米的小房間。父母辛苦勞作維持生計,每日工作很長時間,這為穆拉德帶來很大影響,他從小就下定決心努力學習,以不再像父母這樣辛勞。穆拉德在12歲時就樹立成為一名醫生的理想,但「事與願違」的是,穆拉德後來的工作比父母時間更長且更努力,區別在於不再是僅僅為了生計。
高中畢業後,穆拉德面臨一大抉擇。由於家庭難以承擔高額學費,因此他需要尋找一所能夠提供高額獎學金的大學。穆拉德最初決定考取免費的海軍學院或西點軍校,但這些學校不講授醫學課程,畢業後的四年兵役會耽擱醫學深造。他最終選擇迪堡大學 (DePauw University) 。迪堡大學是一所小型而優秀的文理大學,學校為穆拉德提供一份獎學金保障其完成學業,這裏開設生物學和化學等醫學相關課程,為他進一步醫學深造提供了便利。
1957年,大四的穆拉德準備申請醫學院,最初決定去位於聖路易的華盛頓大學醫學院,隨後兩個人的建議讓他徹底改變了主意。一位是穆拉德大學期間選修科研時的導師福斯特·富勒 (Forst Fuller) ,建議他考慮西儲大學 (Case Western Reserve University) 新開設的基礎和臨床聯合七年制醫學博士課程;另一位是摯友比爾·蘇德蘭 (Bill Sutherland) 的父親厄爾·蘇德蘭 (Earl Wilbur Sutherland) ,他是該課程的發起人和負責人,為穆拉德更詳細地介紹了課程優點,包括免除學費外加每月2000美元津貼,誘人條件使穆拉德最終選擇西儲大學。
二
師出無名
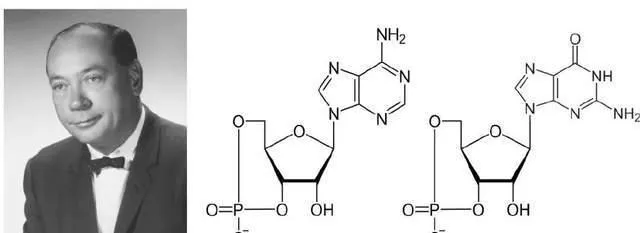
在穆拉德進入西儲大學前,厄爾·蘇德蘭已取得一項重大發現。1957年,蘇德蘭和助手狄奧多·拉爾 (Theodore Rall) 研究腎上腺素促進糖原分解機制時發現,把腎上腺素添加到完整肝勻漿可促進糖原分解;然後將肝勻漿離心分離成上清液 (細胞質部份) 和沈澱 (細胞膜部份) 兩部份後,僅將腎上腺素再次加入上清液中,未發現肝糖原分解明顯增加,但重新加入沈澱後,糖原分解活性恢復,這一結果表明細胞膜是腎上腺素發揮生理活性所必備的。他們進一步使用腎上腺素處理細胞膜沈澱,同時補充能量分子ATP後生成一種耐熱小分子物質,將該物質直接加入 (不使用腎上腺素) 上清部份也可增加糖原分解,最終確定該物質為環腺苷酸 (cyclic adenosine 3'5'-monophosphate,cAMP) 。蘇德蘭在此發現基礎上提出著名的「第二信使假說」,即激素作用於細胞膜特定受體並啟用腺苷酸環化酶 (adenylate cyclase,AC) 生成cAMP,cAMP進一步發揮活性實作生理效應;在這裏激素是第一信使,cAMP為第二信使。蘇德蘭因這一貢獻獲得1971年諾貝爾生理學或醫學獎。
蘇德蘭的重大發現
蘇德蘭和拉爾聯合指導穆拉德從事cAMP研究。穆拉德任務是探索兒茶酚胺對cAMP形成的影響。在此過程中,他發現乙酰膽堿可抑制腺苷酸環化酶,從而減少cAMP生成,這是首次描述激素對cAMP的負調控,第二信使假說內容更為豐富了。當時,第二信使假說領域快速發展,穆拉德作為見證者幾乎每天能看到新進展和新發現;他也是參與者,並激發出巨大科研興趣,最終放棄了原本的醫生夢。另一方面,從這些研究中,他熟練掌握了cAMP及其他相似化合物的檢測方法,為將來科研打下了良好基礎。
1963年,蘇德蘭在尿液中發現一種和cAMP結構高度相似的小分子cGMP (環鳥苷酸) ,隨後發現其廣泛存在。蘇德蘭最初推測二者同樣重要,但事實並非如此:用作研究的激素都透過cAMP介導反應,均不依賴cGMP,這便留下一個重要的未解之謎——cGMP的功能是什麽?這一問題成為穆拉德將來的科研方向。
1965年,穆拉德獲得博士學位後進入麻省總醫院完成2年的實習工作,隨後加入國立健康研究院從事三年多博士後工作。1970年,維吉尼亞大學醫學系新建一個臨床藥理部門,穆拉德加入並組建自己的科研小團隊,開啟獨立研究。
三
平淡無奇
選擇一個合適研究方向是穆拉德首先需要解決的問題,當時可選cAMP和cGMP兩種分子,二者雖然結構極為相似,境遇卻大相徑庭——一個大紅大紫、一個默默無聞;一個風光正盛、一個少人問津。穆拉德不想隨波逐流,他秉持「天生我才」理念,既然細胞可產生cGMP,那cGMP就應有獨特作用,只是目前尚未發現而已。
當時已知細胞有兩類催化cGMP生成的鳥苷酸環化酶 (GC) ,一類位於細胞膜,另一類位於細胞質。穆拉德選擇位於細胞質的GC,實驗設計較為簡單,他將細胞進行破碎,離心去掉沈澱保留上清,然後觀察不同物質對鳥苷酸環化酶活性的影響,方法是檢測cGMP生成量 (穆拉德已熟練掌握) 。穆拉德短期內也不準備對酶進行純化 (較為耗時) ,因此使用粗制品進行研究,但需要將大量制備出的剩余樣品及時儲存。當時實驗室最常用的蛋白保存試劑為疊氮化鈉,對保存後的樣品進行檢測時,穆拉德意外發現鳥苷酸環化酶活性大振幅增加,cGMP生成量顯著升高。這一意外發現使穆拉德十分驚訝,就把實驗室可用的試劑依次進行測試,結果發現多種化合物如羥胺、苯肼和亞硝酸鹽等也顯著啟用酶活性,它們擁有一個共同特征,那就是都含氮元素,深入分析發現它們啟用鳥苷酸環化酶原因在於反應中生成了NO。
穆拉德還發現,這些物質不僅增加粗制品鳥苷酸環化酶活性,而且對完整細胞也具有活性。當使用這些化合物處理平滑肌細胞,可明顯增加細胞內cGMP含量;重要的是,能進一步引起肌細胞舒張,而這是血管擴張的基本原理。因此,穆拉德決定進一步測試有實用價值的化合物,這些化合物要含氮並具有血管舒張活性,在此標準下他釘選治療心絞痛的藥物——硝化甘油。
四
意外之喜
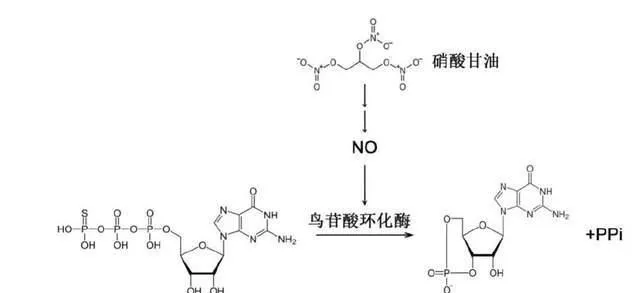
1847年,義大利化學家阿斯卡尼奧·索布雷洛 (Ascanio Sobrero) 首次在實驗室制備出硝化甘油 (許多人都錯誤認為硝化甘油由諾貝爾首先發現) ,這是一種揮發性極強且極易爆炸的液體 (索布雷洛本人實驗過程中傷痕累累) ;19世紀60年代,諾貝爾將硝化甘油進行改進研制出固態炸藥。令人意想不到的是,不久人們發現硝化甘油可用於治療心絞痛,後續又成功開發出單硝酸異山梨醇酯、硝普鈉等多種藥物,統稱硝酸鹽血管舒張劑,但藥理一直不詳。
1977年,穆拉德測試硝化甘油,發現可增加血管平滑肌cGMP含量並引起肌肉松弛,原因在於它也可產生NO。這項研究有效解釋了硝化甘油等藥物治療心絞痛的藥理機制,那就是生成NO生成後,由NO提升cGMP含量,從而實作平滑肌舒張。這一發現直接為新藥研發指明方向。1986年,輝瑞公司設立研發小組篩選治療心絞痛新藥,原理是尋找磷脂酶5 (該酶降解cGMP) 抑制劑,最終得到西地那非。該藥可有效增加cGMP濃度,具有擴張冠狀動脈和抑制血栓形成的作用。隨後臨床試驗卻發現西地那非對心絞痛緩解作用非常有限,而意外觀察到對男性勃起功能障礙有奇效,這一偶然發現促使神藥「偉哥」誕生,穆拉德也因此獲得「偉哥之父」的美譽。
硝化甘油、NO和cGMP
穆拉德的思想並未簡單停留在硝化甘油藥理機制,而是進一步提出存在內源性NO,即正常細胞可在激素和神經傳導物質等刺激下由自身含氮化合物產生NO,進而透過誘導cGMP生成發揮生理作用。按照推測,內源性NO含量既低,存在時間又短 (這一特性避免其毒性發揮) 。當時最先進技術都很難直接檢測NO,一些證據間接證實內源NO存在,但並不太令人信服,因此遲遲未獲科學界普遍接受,直到另一個偶然發現。
五
最佳助攻
20世紀50年代,紐約州立大學藥理學家勞勃·弗奇戈特 (Robert Furchgott) 研究血管擴張的原因,關註點是神經傳導物質乙酰膽堿。將乙酰膽堿註射到動物體內可引起血管擴張和血壓下降現象,因此他推測乙酰膽堿可引起血管中肌細胞舒張,從而增加血管直徑。弗奇戈特讓學生用體外實驗驗證這一推測,他們制備出一系列血管條,然後使用乙酰膽堿處理;如果血管條變長則意味著肌細胞舒張,奇怪的是結果重復性極差,更多情況下出現血管條變短現象,和預期完全相反,對這一現象一直無法解釋。
1978年,弗奇戈特決定重新研究這個問題,這次實驗者選擇使用血管環,結果發現乙酰膽堿處理造成血管擴張,而且結果非常穩定。進一步分析發現,兩次實驗的差別就在使用的材料上,血管環不影響血管內部的內皮細胞,而血管條制備過程通常會破壞內皮細胞。對此,他們將血管環內部也去掉內皮細胞,結果用乙酰膽堿處理後,血管也不再擴張;制備保留內皮細胞的血管條用乙酰膽堿處理後則血管舒張,與之前的結果一致;甚至他們制備出三明治結構,那就是一條血管保留內皮,另一條去除,然後放置於一起 (內皮細胞居中) ,用乙酰膽堿處理可造成兩條血管均舒張。這一系列結果表明乙酰膽堿作用於肌細胞需內皮細胞生成一種特定中介物,弗奇戈特將其稱為內皮來源舒張因子 (EDRF) 。弗奇戈特無法分離和確定EDRF是何種物質,但它的功能引起穆拉德的巨大興趣,因此與弗奇戈特溝通準備合作研究,但由於其他原因而被耽擱。
六
殊途同歸
EDRF的發現引起許多研究人員巨大興趣,世界各地多家實驗室都在嘗試確定EDRF本質,後續研究驚奇地發現EDRF與NO具有極大相似性。
首先,EDRF和NO生理功能相似性。二者都會導致血管擴張,並且都透過啟用鳥苷酸環化酶生成cGMP實作。這一點和其他證據促使穆拉德於1986年提出,EDRF就是內源NO。
其次,EDRF和NO化學性質相似性。兩種物質半衰期都極短,並且都可影響血紅素光譜吸收,且影響結果分毫不差,而測試的其他任何分子都不具備如此神奇效果。基於此,穆拉德認定EDRF就是NO。
1986年,弗奇戈特和加州大學洛杉磯分校的路易士·伊格納羅 (Louis Ignarro) 在第四屆舒張血管機制國際研討會上同時報道這項發現,遺憾的是大多數人並不相信他們的結果。但隨後越來越多的證據支持EDRF和NO二者的一致性,科學界逐漸接受了這一事實。
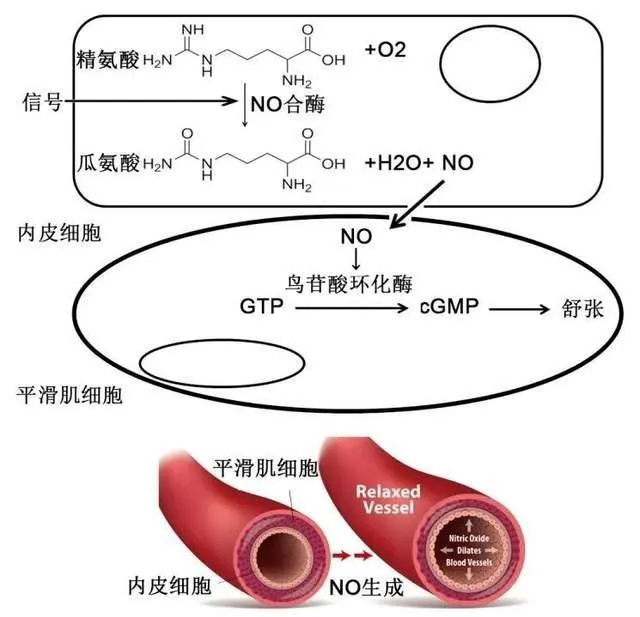
1988年,研究人員證明精胺酸是體內NO生成的原料;1990年,研究人員在大腦中獲得催化NO生成的酶,稱為大腦NO合酶 (bNOS) ,又稱NOS-1;1991年,進一步發現內皮細胞NO合酶 (eNOS) ,又稱NOS-3;在巨噬細胞中發現誘導型NOS (iNOS) ,又稱NOS-2。至此,三種NOS鑒定完畢,它們發揮不同生理功能,分別為舒張血管、抵抗感染和神經保護。至此,體記憶體在NO已成科學事實。
體內NO生成
七
功成名就
後續研究發現NO遠比想象中更為重要,它參與了廣泛的生物學過程,特別是作為動物體內第一種瓦斯訊號分子,為其他瓦斯訊號分子如CO、pS等發現和研究提供重要思路,1992年,NO被【科學】雜誌評為年度明星分子。
隨著NO重要性日益顯現,穆拉德也開始獲得一系列科學獎勵。1996年,穆拉德和弗奇戈特分享拉斯克基礎醫學獎;1998年,他們又和伊格納羅分享諾貝爾生理學或醫學獎。諾貝爾評獎委員會認為,穆拉德有關NO和cGMP的研究發現不僅詮釋了一類古老藥物的工作原理,而且還為許多生理現象理解和疾病治療提供新思路。現在已知,NO在炎癥形成、血液迴圈、組織發育、平滑肌舒張和長期記憶等過程均發揮重要作用,在心臟病、中風、癌癥、肺部高血壓等臨床套用方面也具有重要潛力,如吸入NO治療患有持續性肺動脈高壓的早產兒。
八
老而彌堅
穆拉德一直摯愛著自己的科研事業,執著於揭示生命奧秘並期望能造福於人類。
1970年到1981年間,穆拉德在維吉尼亞大學工作,於1975年成為學校最年輕教授之一,1971年成為臨床研究中心主任和1973年臨床藥理學主任;他建立了一個臨床和基礎相結合的研究團隊,取得科研成果的同時還培養了一大批青年人,他們成為科學發展的後備力量。1981年,穆拉德加入史丹佛大學,直到1989年。
為了能將科研成果更好轉化,穆拉德於1988年加入雅培公司,擔任副總裁,在隨後的4年間開展新藥研發和臨床試驗工作,大膽嘗試一些疾病新療法,遺憾的是未達自己預期而離職。1993年,穆拉德親自成立一家生物技術公司,擔任總裁兼執行長,在未能籌備到足夠資金而自己的投入又花費殆盡的情況下,創業中道崩殂。
1997年,穆拉德重回學術界,加入德克薩斯大學休士頓分校,再次開展基礎研究。獲得諾貝爾獎後,穆拉德日程變得繁忙起來,需要參與多種社交活動,因此有機會推廣自己的學術理念。穆拉德精力旺盛,在多家單位開展廣泛的研究,2011年時仍加入華盛頓大學工作。
2023年9月4日,穆拉德在加利福尼亞州門洛公園去世,享年86歲。
穆拉德科研生涯完美詮釋了生命過程需要「NO (一氧化氮) 」,而科研過程更需要 「NO (不) 」。不拘泥傳統思維、勇於向陳舊觀念挑戰應是偉大科學家的先天因素。
主要參考文獻
[1] 郭曉強.內皮細胞舒血管因子的發現者——弗奇戈特.科學(上海), 2010, 62(3):45-48.
[2] Sharina I, Martin E. Ferid Murad (1936-2023).Science, 2023, 382(6670):519.
[3] Murad F. Some highlights of a 47 year career in research. Cell Mol Life Sci, 2005, 62(1):1-3.
[4] Murad F. Discovery of some of the biological effects of nitric oxide and its role in cell signaling. Biosci Rep, 2004, 24(4-5):452-474.
[5] Steinhorn BS, Loscalzo J, Michel T. Nitroglycerin and Nitric Oxide--A Rondo of Themes in Cardiovascular Therapeutics. N Engl J Med, 2015, 373(3):277-280.
[6] Mittal CK, Kimura H, Murad F. Requirement for a macromolecular factor for sodium azide activation of guanulate cyclase. J Cyclic Nucleotide Res, 1975, 1(6):261-269.
[7] Kimura H, Mittal CK, Murad F. Activation of guanylate cyclase from rat liver and other tissues by sodium azide. J Biol Chem, 1975, 250(20):8016-8022.
[8] Katsuki S, Arnold W, Mittal C, Murad F. Stimulation of guanylate cyclase by sodium nitroprusside, nitroglycerin and nitric oxide in various tissue preparations and comparison to the effects of sodium azide and hydroxylamine. J Cyclic Nucleotide Res, 1977, 3(1):23-35.
[9] Katsuki S, Arnold WP, Murad F. Effects of sodium nitroprusside, nitroglycerin, and sodium azide on levels of cyclic nucleotides and mechanical activity of various tissues. J Cyclic Nucleotide Res, 1977, 3(4):239-247.
[10] Murad F. Cyclic guanosine monophosphate as a mediator of vasodilation. J Clin Invest, 1986, 78(1):1-5.