鈉元素在自然界中都以化合態形式存在,如以NaCl、Na2 CO3 、Na2 SO4 等鹽的形式存在於海水、鹽湖、地殼的巖層中,自然界中沒有遊離態的鈉元素。
鈉單質的工業制法:
2NaCl =(熔融電解)2Na + Cl2 ↑
一、活潑的金屬單質——鈉
鈉原子的結構:

鈉原子的結構示意圖
鈉原子的最外層只有一個電子 ,且鈉原子半徑較大,易失去最外層的一個電子 ,成為8e-的穩定結構,即帶一個單位正電荷的鈉離子Na+。
鈉元素是典型的金屬元素,有很強的金內容;鈉單質性質活潑,是強還原劑,有很強的還原性。
實驗:鈉與氧氣在常溫下的反應

鈉的取用方法
|
操作 |
觀察廣口瓶中的鈉,用鑷子從煤油中取出一塊金屬鈉,用濾紙吸幹表面的煤油,在幹燥玻璃片上用小刀切下一小塊金屬鈉,觀察鈉塊的切面 |
|
結論 |
鈉的性質活潑,需隔絕空氣和水保存,所以保存在煤油或石蠟油中 。鈉有銀白色的金屬光澤,質地很軟,硬度很小, ρ (煤油)﹤ ρ (鈉)﹤ ρ (水) |
|
分析 |
鈉的表面變暗,生成了氧化鈉: 4Na+O2 = 2Na2 O |
實驗:鈉與氧氣在加熱時反應
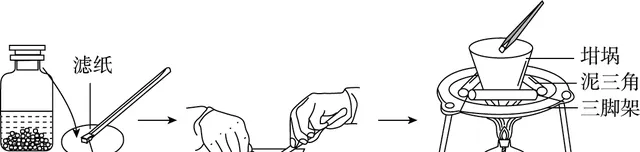
鈉在空氣中的燃燒
|
操作 |
加熱幹燥的坩堝,加入綠豆大的一塊鈉,等鈉塊熔化後撤掉酒精燈 |
|
現象 |
鈉先熔化成一個金屬小球,然後劇烈燃燒,發出黃色火焰,生成淡黃色固體 |
|
結論 |
鈉與在高溫下反應生成過氧化鈉: 2Na+O2 = Na2 O2 |
同樣的反應物,反應條件不同,發生的反應不一樣,產物也不一樣。利用這一點,可以透過控制反應條件,得到所需要的產物。
鈉與其它非金屬單質反應:
2Na+Cl2 =(點燃)2NaCl
2Na+S =(研磨)Na2 S
實驗:在燒杯中加入適量的蒸餾水,滴入幾滴酚酞,用鑷子加入綠豆大一塊鈉,並蓋上玻璃片
|
現象 |
分析 |
|
鈉浮在水面上,熔化成一個金屬小球 |
鈉的密度比水小,熔點低,反應放熱 |
|
小球在水面上四處遊動,發出「嘶嘶」的聲音,逐漸變小,最後消失 |
鈉與水劇烈反應,產生瓦斯推動小球運動 |
|
向燒杯中滴入酚酞液體變紅色 |
有堿性物質(NaOH)生成 |
|
實驗結論: 2Na+2p O = 2NaOH+p ↑ 2Na+2p O = 2Na+ +2OH- +p ↑ |
|
分析反應中得失電子的情況,思考下面的問題:
(1)將酚酞換成石蕊試液 ,現象有什麽不同?
燒杯中的液體會變藍色 。
(2)將水換成CuSO 4 溶液 、稀鹽酸等溶液,現象有什麽不同?為什麽?
鈉會先與溶液中的水反應生成NaOH和p ,生成的NaOH再與CuSO4 反應生成Cu(OH)2 沈澱,所以會有藍色沈澱 出現,不會置換出紅色的金屬Cu 。
2Na+CuSO4 +2p O = Cu(OH)2 +Na2 SO4 +p ↑
鈉與鹽酸反應更劇烈,因為鹽酸中H+ 的濃度更大。
2Na+2H+ = 2Na+ +p ↑
(3)實驗室中鈉怎樣保存?為什麽?
鈉保存在石蠟油或煤油中,以隔絕空氣,防止鈉與
空氣中的O2 、p O反應。
4Na+O2 = 2Na2 O
Na2 O+p O = 2NaOH
2NaOH+CO2 +9p O = Na2 CO3 ·10p O
Na2 CO3 ·10p O = Na2 CO3 +10p O
(4)鈉著火能不能用水滅火?
不能用水滅火,是因為鈉與水反應產生p ,用水滅火易發生爆炸。可用幹燥的沙土蓋滅。
鈉的重要用途:
(1)鉀鈉合金用於原子反應爐的導熱劑。
(2)作電光源:高壓鈉燈。
(3)冶煉某些金屬,如冶煉金屬鈦。
4Na+TiCl4 =(熔融)Ti+4NaC l
小結:
金屬鈉有強還原性,是一種強還原劑,是活潑的金屬。鈉元素是典型的金屬元素,有很強的金內容。
聲明:原創不易,不得用於商業用途











