前言:间充质干细胞(MSC)来源的细胞外囊泡(EV)是调节周围组织微环境的重要信号分子,内含多种信号物质,如信号蛋白、miRNA、RNA和DNA等。近年来,EV在抗衰和临床治疗中表现出显著效果,而且可以避免干细胞治疗可能引发的炎症反应、血管堵塞和疾病传播的风险,备受业界青睐。但如何获取高质量的EV是临床应用和产业化生产中亟需突破的瓶颈问题,值得深入探究。
传统获取MSCs-EVs的主要方法是血清饥饿培养(SC),但SC可能存在减缓细胞增殖、诱导细胞凋亡和囊泡质量不高等局限,减弱EVs的治疗效果。因此, 科研人员提出了一种连续营养供应培养(CC)的新策略来获取EVs,通过使用化学成分确定的培养基持续给MSCs提供各种营养物质和生长因子,改善EVs的生长条件。 通过与SC策略比较,发现CC策略可以有效地抑制MSCs的自噬和凋亡,提高EVs产量;通过小鼠UVB光老化实验,证明CC-EVs可促进细胞增殖,抑制慢性炎症反应,抗衰老作用更佳。
1.CC策略带来高产量、高质量的EVs
本研究CC策略采用Regenα-Geek的UltraMedia®无血清培养基,SC策略则选择Gibco的DMEM/F12培养基。脐带来源的组织长出原代MSCs后,置于含有5%CO2的培养箱中于37℃中传代培养,并于细胞融合至80%时获取细胞上清液,采用超速离心法收集EVs(图1a)。通过电镜发现,颗粒呈圆形具有双层膜结构(图1b),尺寸多数为30-150 nm(图1c),另外,蛋白质印迹法确认这些颗粒存在典型外泌体标记物(图1d),最终确认收集到的颗粒为MSCs来源的EV。在同体积细胞上清液和分离方法下,CC-EVs的蛋白质含量明显较高(图1e)。另外,每个CC-MSC衍生的EVs数量约为2.4 × 105个颗粒,约为SC-MSC的1.4倍(图1f)。 CC-EVs的浓度约为1.4×1012个粒子/mL,产量显著提高,特别在30–150nm尺寸范围内,其数量差异最明显(图1g/h)。
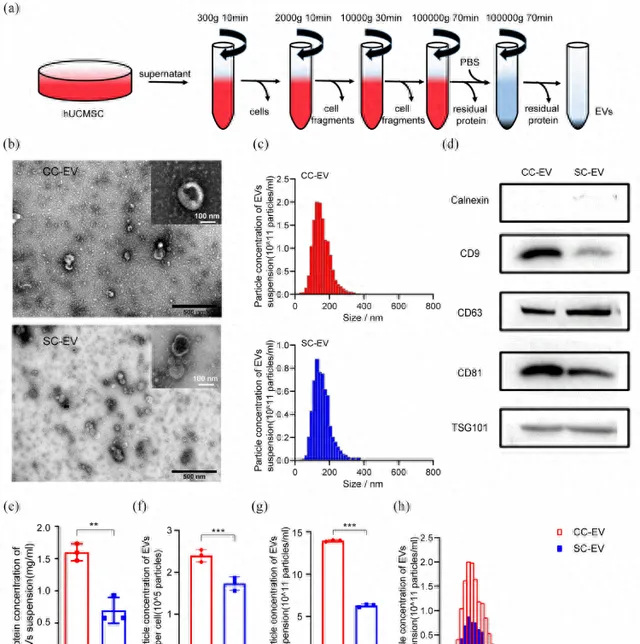
图1:CC-EVs和SC-EVs的表征及产量情况
探究CC策略促进EVs形成的机制,首先检测MSCs的状态差异。CC-MSCs自噬标志物LC3 II(图2a/b)和凋亡重要标志物PARP(图2a/c)表达较SC策略均降低;流式细胞术结果显示,CC-MSCs总细胞凋亡率与SC-MSCs相比下降了2.85%(图2d)。其次,对参与EVs形成与释放的蛋白质进行了分析,发现CC策略可上调内吞体分选转运复合体(ESCRT)的重要蛋白表达,如HRS和TSG101,并加速MSCs的膜转运和EVs的形成,此外,CC-MSCs还表达更高水平的Rab27a和Rab27b蛋白(图2e/f/g), 表明CC策略刺激Rab27蛋白的合成,以加速EVs前体向质膜(PM)转运。
图2:CC-MSCs和SC-MSCs的状态差异
最后,对细胞膜融合过程进行探讨。CC-MSCs膜表面的四跨膜蛋白(CD81、CD9和CD63)强阳性细胞百分比更低(图3a/b),胞内四跨膜蛋白的含量更高(图3c/d),证明CC-MSCs有更多含有四跨膜蛋白的PM被内吞形成EVs前体。通过电镜捕获的图像可看出, CC-MSCs内的多囊泡体(MVE)数量多且形态更加成熟 (图3e/f)。
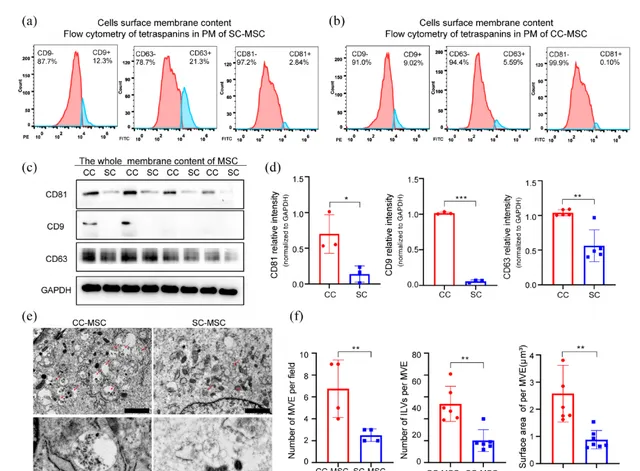
图3:CC-MSCs和SC-MSCs的膜融合分析
由此可见,CC策略可以抑制MSCs的自噬和凋亡状态,上调EVs相关膜转运蛋白的表达,加速MSCs内小分子信号物质的转运和对外释放,促进MSCs释放更多的EVs。
2.CC策略来源的EVs具有更强的抗衰老能力
UVB光损伤的皮肤修复主要涉及人上皮成纤维细胞(HEF)的再生和迁移。将HEFs与红色荧光示踪剂PKp6标记的EVs孵育24小时后,检测到HEFs核周围含有红色荧光颗粒(图4a)。CCK-8法显示CC-EVs改善光损伤的细胞增殖的效果更好(图4b),并采用BrdU ELISA试验再次验证,CC-EVs促进衰老的HEFs进入S期合成DNA,表现出更强的增殖能力(图4c)。划痕愈合测试显示,用CC-EVs处理老化细胞,其伤口愈合速度更快(图4d/e)。
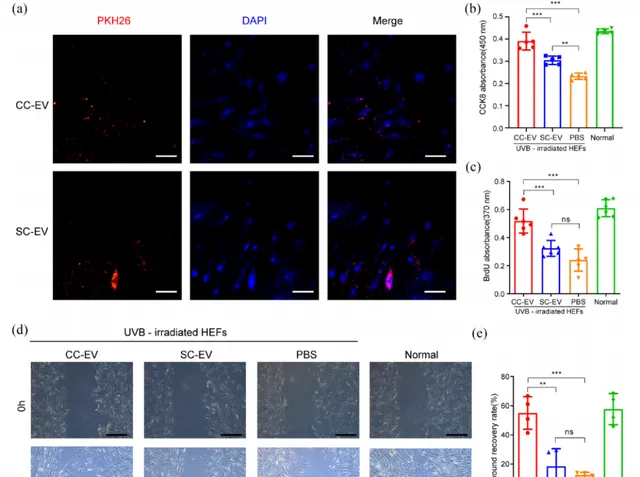
图4:EVs对HEFs的再生和迁移影响
β-半乳糖苷酶(β-gal)染色显示,UVB照射诱导HEFs衰老(图5a)。EVs与衰老HEFs 共培养48小时后,细胞中的β-gal活性显著降低(图5b),导致胶原蛋白和弹性蛋白分解的基质金属蛋白酶(MMP1)表达下调(图5c),I型胶原合成增加(图5d),并且衰老细胞中p53的表达水平降低(图5e/f),受损的DNA得到修复。 这说明EVs具备抗衰能力且CC-EVs表现更佳。
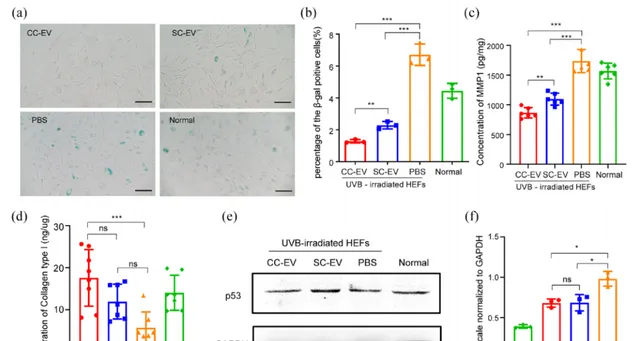
图5:EVs改善HEFs的衰老状态
动物实验中,光损伤的KM小鼠上皮明显增厚粗糙,真皮纤维分布紊乱,皮肤附属器减少,经CC-EVs和SC- EVs治疗后皮肤均变得明显光滑,晒伤瘢痕得到有效修复(图6a/b)。Masson染色显示,CC-EVs治疗组的小鼠上皮厚度显著减少,胶原纤维再生,皮肤附属器再生并均匀排列(图6c/d)。为研究EVs在皮肤老化和胶原再生方面的分子机制,对皮肤蛋白质样品进行了分析,结果发现,CC-EVs显著抑制组织中MMP1合成,下调肿瘤坏死因子-α(TNF-α)和磷酸化蛋白激酶B(p-AKT)的表达,激活NF-κB信号转导通路,减轻慢性炎症反应。此外,CC-EVs显著上调转化生长因子(TGF-β)的表达,促进皮肤组织中I型胶原蛋白(COL I)再生(图6e/f)。

图6:CC-EVs和SC- EVs在KM小鼠实验中的表现
miRNA在许多生理和病理状态的调控中发挥关键作用。对CC-EVs与SC- EVs的miRNA进行多方位分析比较:主成分分析(PCA)因子显示,PC1和PC2清楚地分离两组EVs的miRNA表达谱(图7a);Venn图显示CC-EVs有663个miRNA,SC- EVs有552个miRNA(图7b);通过热图揭示两组EVs的miRNA差异情况,共有125个miRNA表达显著差异,55个miRNA在差异倍数分析显示CC-EVs中有46个上调(83.6%),9个下调(17.4%)(图7c/e)。 由此可见,CC-EVs与SC- EVs存在差异表达的miRNA。

图7:CC-EVs与SC- EVs的miRNA分析
另外,miRNA相互作用网络图(图7d)中显示,CC-EVs中有多个miRNA靶向NF-κB信号通路下调衰老相关因子MMP1和β-gal;同时,miR-493等作用于靶基因TNF-α38,抑制NF-κB信号通路,下调核内炎症因子的转录,降低机体氧化应激水平。 结果表明,CC策略可以改变细胞囊泡携带的信号物质,使EVs含有更多的抗衰老因子,并抑制NF-κB信号通路激活引起的慢性炎症(图7f)。
相关研究内容以 Continuous nutrient supply culture strategy controls multivesicular endosomes pathway and anti-photo-aging miRNA cargo loading of extracellular vesicles 为题发表在杂志 Journal of Tissue Engineering (JTE) 。研究者希望通过优化EVs培养策略来缩短获取MSCs上清液的时间和降低成本,为大规模生产EVs提供方向,推进EVs在动物实验以及临床治疗中的应用。











