编译:微科盟 雨,编辑:微科盟 景行、江舜尧。
微科盟原创微文,欢迎转发转载,转载请注明来源于【转录组】公众号。
导读
花青素是一类重要的次生代谢产物,决定了菊花(一种著名的切花)五颜六色的花瓣。「Arctic Queen」是一种白菊花品种,在开花阶段不会积累花青素。在开花后阶段,「Arctic Queen」的花瓣会积聚花青素并变成红色。然而,这种花色变化背后的分子机制仍不清楚。 本研究通过转录组分析,鉴定出 CmNAC25 是促进「Arctic Queen」开花后阶段花青素积累的候选基因。CmNAC25直接与 CmMYB6 的启动子结合,CmMYB6是促进菊花青素生物合成的MBW蛋白复合物的核心成员,以激活其表达。CmNAC25还直接激活 CmDFR 的启动子, CmDFR 编码花青素生物合成中的关键酶 。 CmNAC25 在开花后阶段高表达,而 CmMYB#7 (一种已知的R3 MYB转录因子)的表达水平显著降低,该转录因子干扰了CmMYB6-CmbHLp复合物的形成。菊花和烟草( Nicotiana tabacum )的遗传转化证实,CmNAC25是花青素生物合成的正调节因子。另外两个在开花后阶段变红的品种也表现出类似的机制。 综上所述,CmNAC25通过直接激活 CmMYB6 和 CmDFR ,在开花后阶段正向调控菊花花瓣中花青素的生物合成。 本研究结果揭示了CmNAC25在调控花瓣衰老过程中花色变化的关键作用,为菊花花色的分子设计育种提供了靶基因。
论文ID
原名: CmNAC25 targets CmMYB6 to positively regulate anthocyanin biosynthesis during the post-flowering stage in chrysanthemum
译名: CmNAC25靶向 CmMYB6 正向调控菊花开花后阶段花青素的生物合成
期刊: BMC Biology
IF: 5.4
发表时间: 2023年10月
通讯作者: 陈发棣
通讯作者单位: 南京农业大学
DOI号: 10.1186/s12915-023-01719-7
实验设计
结果
1 菊花「Arctic Queen」的花色在花后阶段由于花瓣中花青素的积累而变红
本研究使用了切花品种「Arctic Queen」 (图1)。 为了分析菊花花瓣在开花后阶段的颜色变化,研究者将花序完全开放后的开花过程分为S1(全花期)、S2(盛花后10 d)和S3(盛花后20 d)3个阶段(图1A) 。如图1A所示,最外层射线小花的花瓣颜色在S1处为白色,在S2处变为浅红色,在S3处变为更红。花瓣颜色的CIE L*a*b* 分析显示,花瓣的 a* (红度)和 C* (色度)值逐渐增加,而 L* (亮度)和 b* (黄蓝色)值从S1到S3逐渐降低(图1B)。 色素定量分析表明,S1处花瓣未检测到花青素,S2-S3花瓣中花青素含量增加 ,与表型一致(图1C、D)。 这些结果表明,由于花青素的积累,「Arctic Queen」花瓣的品种在开花后阶段逐渐变红 。
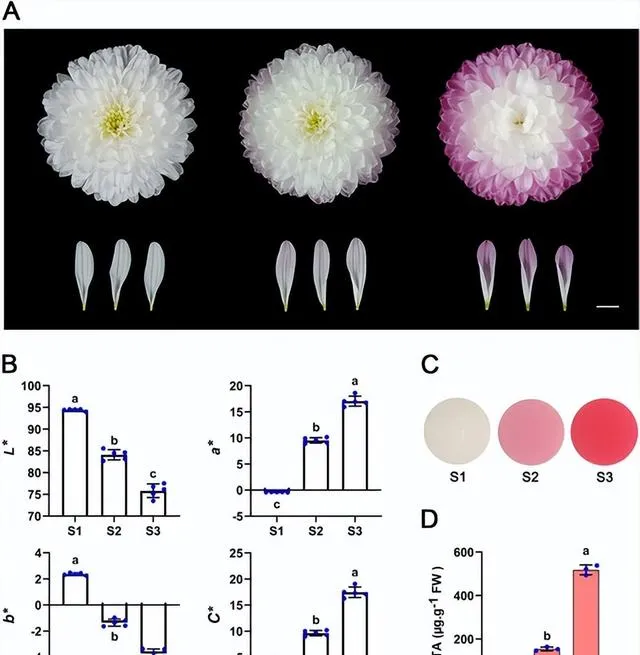
图1.菊花「Arctic Queen」花瓣中的花青素积累在开花后阶段诱导花色。 比例尺= 1cm。 A 花后阶段花色的变化。S1(白色),S2(略带红色),S3(明显红色)。 B CIE L*a*b* 花瓣在3个开花期的颜色参数。误差线表示五个生物学重复的SD。 C 从三个花期的花瓣中提取花青素。 D 3个花期花瓣中总花青素含量(TA)。误差线表示三个生物学重复的 SD。B和D中的不同小写字母表示差异显著( p <0.05,方差分析,Tukey校正)。
2 菊花花瓣3个花期的转录组学分析
研究者从S1、S2和S3阶段采样的「Arctic Queen」最外层射线小花中提取的总RNA进行为RNA-Seq分析。共获得9个样品(三个阶段中每个阶段进行3次生物学重复)。组装过程的结果是一组139,504个单基因序列,平均长度为1138 bp,N50为1773 bp,GC含量为39.09%(表S1)。
研究者通过对不同开花期(S1、S2和S3)的转录组进行成对比较,分析了差异表达基因(DEG) (图2)。有4955个基因在S2中的表达明显高于S1,3721个基因在S3中的表达高于S2。然而,有5058个基因在 S2 中的表达量明显低于 S1,6837 个基因在 S3 中的表达量低于 S2 中的表达量(图 2A)。 在S1 vs S2和S2 vs S3的成对比较中,共有2819个DEGs(图2B),其中483个和911个DEGs同时上调和下调(图2C,D)。

图2.不同阶段「Arctic Queen」花瓣转录组的DEG分析。A S1 vs S2 和 S2 vs S3 中上调和下调的 DEG 数量。 B S1 vs S2 和 S2 vs S3 中总 DEG 的韦恩图。 C,D S1 vs S2 和 S2 vs S3 中上调和下调 DEG 的韦恩图。
3 花青素生物合成途径中的DEGs
为了探究花青素积累导致「Arctic Queen」花瓣在花后阶段着色的分子机制,研究者进一步分析了与花青素生物合成相关的DEGs的表达谱 (图3)。如图3A所示, 在S1到S2期间,花青素生物合成途径中结构基因的直系同源物(包括 CHS 、 CHI 、 F3H 、 F3'H 、 DFR 、 UF3GT 、 3MaT1 和 3MaT2 )同时上调,与花瓣中花青素的积累相关 (图1)。这一结果表明,潜在的上游转录因子可能在转录上调控花青素积累的多个结构基因。
因此, 研究者鉴定了多个编码 MYB-like、bHLH 和 WD40 转录因子的 DEG。 图3B显示了代表性 MYBs 、 bHLHs 和 WD40s 的表达谱。从S1到S2, MYBs 的几个直系同源物上调表达,包括CL13157.Contig2_All,CL1880.Contig1_All,CL4147.Contig2_All,CL4673.Contig1_All,Unigene1242_All,Unigene18139_All和Unigene42407_All(图3B)。在图3B中 bHLHs 的直系同源物中,只有CL5776.Contig3_All上调, WD40 (Unigene39656_All)的直系同源物上调。在这些基因中, CmMYB6( CL4673.Contig1_All同源物)和 CmbHLp( CL5776.据报道Contig3_All同系物)通过在菊花中形成复合物来促进花青素的生物合成 。此外,与其他调控基因相比, CmMYB6 上调具有较高的FPKM值(图3B),表明其在衰老花瓣中花青素的积累中起着关键作用。
花青素的生物合成受经典MBW复合物的调控。根据上述DEGs分析, 研究人员推测 CmMYB6 (CL4673.Contig1_All同源), CmbHLp (CL5776.Contig3_All同源)和 CmTTG1 (Unigene39656_All同源)是MBW复合物的候选成员,在开花后阶段调节花色 。因此, 参考先前的研究,研究者进行了Y2H测定和BiFC测定以检测CmTTG1和CmMYB6/CmbHLp之间的相互作用 。 结果,CmTTG1 与 CmMYB6 和 CmbHLp 相互作用 (图 S1A 和 B)。由于 CmMYB6 和 CmbHLp 形成蛋白质复合物,这提出了一个问题, 即 CmTTG1 是否消除了 CmMYB6 和 CmbHLp 之间的相互作用 。为此,按照Schwenk等的描述, 研究者进行了Y3H测定 (图S1C)。与CmMYB6和CmbHLp共表达的酵母细胞可以在所选培养基上生长,但AD-T+BD-Lam组合不能生长。同时,添加CmTTG1对所选培养基上共表达CmMYB6和CmbHLp的酵母细胞的生长没有影响(图S1C), 表明CmTTG1不影响CmMYB6和CmbHLp之间的相互作用。因此,研究人员推断 CmMYB6、CmbHLp 和 CmTTG1 在菊花中形成蛋白质复合物。
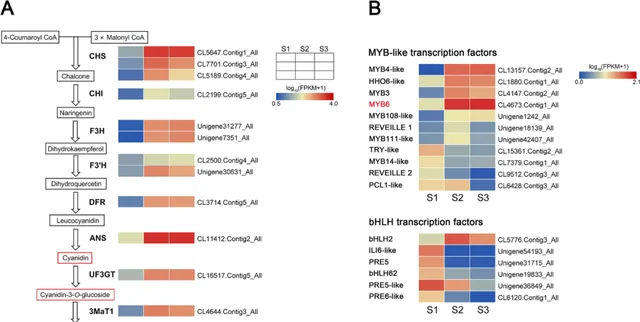
图3.「Arctic Queen」花瓣中花青素生物合成途径基因在3个花期的差异表达。A 菊花花秦素生物合成途径中结构基因的表达模式。 B 编码 MYB-like、bHLH 和 WD40 转录因子的基因的差异表达。热图描绘了归一化的基因表达值(log10[FPKM + 1]),其中FPKM值代表了三个生物学重复的平均值。
4 酵母单杂交筛选和 CmNAC25 的分离
既往研究发现,由于 CmMYB#7 的表达变化,「Jimba」在自然栽培下偶尔会自发产生红色的花瓣,即「 Turning red Jimba」。 在本研究中,研究者着重于「Arctic Queen」在开花后阶段逐渐变成红色的花瓣 。研究者验证了 CmMYB#7 的表达,结果表明,CmMYB#7也参与了白菊花品种花后花瓣颜色变化的调控(图S2)。 CmMYB#7 在盛花期(S1)表达量较高,进入花后期(S2–S3)后显著下降(图S2),初步说明了花青素在花后阶段开始积累的原因 。然而,MBW蛋白复合物成员在花后阶段表达逐渐增加和花青素积累的分子机制有待进一步探索。
为了探究菊花花瓣花后花青素生物合成的上游调控机制,研究者利用菊花MBW复合体核心成员 CmMYB6 的启动子进行酵母单杂交(Y1H)筛选 。从菊花基因组DNA中分离出1219 bp长的 CmMYB6 启动子,作为诱饵插入pHIS2载体中,筛选「Arctic Queen」花瓣的cDNA文库,并在转录组数据中通过原始细胞鉴定出几个阳性克隆(表S2)。在这些基因中, 只有1个NAC转录因子(Unigene39896_All)在S1到S2期间上调表达,与CmMYB6和花青素积累的上调相关 。因此,从「Arctic Queen」中克隆了该基因的全长cDNA序列,称为 CmNAC25 ,以供进一步鉴定。扩增后, CmNAC25 的 ORF 为 921 bp,编码由 307 个氨基酸组成的蛋白质,预测分子量为 33.77 kDa,等电点(pI)为 5.10。
研究者进行了CmNAC25 的亚细胞定位分析 ,将 35S::GFP-CmNAC25 和 35S::D53-RFP 构建体(细胞核标记物)瞬时共转化到本氏烟草叶片的表皮细胞中。空载体35S::GFP 和 35S::D53-RFP 结构作为对照。图4A显示,在细胞质和细胞核中均检测到对照的GFP信号,而仅在细胞核中检测到35S::GFP-CmNAC25的GFP信号。 结果表明,CmNA25位于细胞核内 。 序列比对分析表明,CmNAC25 在其 N 末端有一个保守的 NAM 结构域 (图 4B), 这是 NAC (NAM/ATAF/CUC)转录因子家族中众所周知的特定结构域 。 研究者在酵母系统中进行CmNAC25的转录活性分析,以pCL1的转化为阳性对照,空载体pGBKT7为阴性对照。酵母细胞在SD/-H/A培养基中的生长表明CmNAC25(CmNAC25-FL,1-307aa)的全长具有转录活性。 相反,没有硫解酶活性位点的截短CmNAC25(CmNAC25-S,1-275aa)没有转录激活活性(图4C)。 为了分析其他植物物种中CmNAC25与NAC转录因子的系统发育关系,研究者构建了邻接系统发育树。 如图4D所示,NAC家族分为几组,与之前的研究相似。此外,CmNAC25与AtNAC25的亲缘关系最为密切,属于II组(图4D)。 这些结果表明,属于NAC家族的CmNAC25可能是一种转录激活因子。

图4. CmNAC25 的亚细胞定位、多序列比对、转录活性和系统发育分析。A CmNAC25在本氏烟草( Nicotiana benthamiana )叶片表皮细胞中的亚细胞定位分析。比例尺= 50 μm。 B 拟南芥CmNAC25及其同系物的序列比对(AtNAC018,AT1G52880;ATNAC025,AT1G61110;ATNAC029,AT1G60490;ATNAC047,AT3G04070;AtNAC056, AT3G15510)、甘蓝( Brassica oleracea )(BoNAC019,Bol039157)和苹果( Malus domestica Borkh )(MdNAC42,MDP0000173636)。绿色框表示保守的 NAM 结构域。 C 酵母系统中 CmNAC25 的转录活性分析。用pCL1构建体转化的酵母细胞作为阳性对照,用空载体pGBKT7转化的酵母细胞作为阴性对照。SD/-H/A 表示 His 和 Ade 的合成营养缺陷型培养基。 D 不同物种NAC蛋白的系统发育分析。比例尺(1)表示分支长度。
5 CmNAC25 直接结合并激活 CmMYB6 和 CmDFR 的启动子
为了进一步探究CmNAC25在花色中的作用 , 研究者采用Y1H法对CmNAC25与 CmMYB6 启动子或关键结构基因的相互作用进行了研究 ,结果表明, CmNAC25可以直接与 CmMYB6 的启动子或关键结构基因 CmDFR 结合 (图5A,B),而不是其他结构基因(图 S3A)。如图5A所示,与pGADT7-CmNAC25 构建体共转化的酵母细胞和pHIS2-CmMYB6pro(−1219 bp)在含有或不含 50 mM 3-AT 的SD/-L/T/H 培养基上生长。然而,具有 CmMYB6 pro-1 (−1219 ~−400 bp) 或 CmMYB6 pro-2(−1219 ~−800 bp)插入的 pHIS2 载体的转化体在提供 50 mM 3-AT 的 SD/-L/T/H 培养基上无法生长。 结果表明,CmNAC25与 CmMYB6 启动子−400 ~ 0 bp区域结合 。根据先前的研究,具有CGT序列的NAC结构域蛋白的DNA结合基序是NAC结合序列的重要核心,其反向补体是ACG。 研究人员在 CmMYB6 的启动子区−400 ~ 0 bp区域发现了两个ACGT元件。接下来,电泳迁移率位移试验(EMSA)表明,第一个突变ACGT元件的结合探针仍然存在。相反,当第二个或两个ACGT元件发生突变时,结合的探针消失,表明CmNAC25直接结合位于-89~-85 bp的第二个ACGT元件上的 CmMYB6 启动子 (图5C)。图5B 显示,与 pGADT7-CmNAC25 构建体和 pHIS2-CmDFR pro (−1829 bp)、 pHIS2-CmDFR pro-1 (−1826 ~−400 bp)或 pHIS2-CmDFR pro-2(− 1826 ~ − 800 bp) 共转化的酵母细胞无论是否含有50 mM 3-AT均能够在SD/-L/T/H 培养基上生长。而含有 pHIS2-CmDFR pro-3(−1826 ~− 1300 bp)的转化体的构建体在提供 50 mM 3-AT 的 SD/-L/T/H 培养基上无法生长。结果表明, CmNAC25在−1300 ~−800 bp 区域与 CmDFR 启动子结合,该区域也含有一个 ACGT 元件,EMSA 表明 CmNAC25 可以直接在位于−839 ~−835 bp的第二个ACGT元件处结合 CmDFR 启动子 (图 S4)。由CmMYB6-CmbHLp蛋白复合物形成的MBW复合物对激活菊花青素的积累至关重要,通过上述结果知道CmNAC25直接与 CmMYB6 的启动子结合;此外, Y2H和BiFC测定结果表明 CmNAC25 不与 CmMYB6 或 CmbHLp 相互作用 (图 S3B 和 C)。同时,当用CmNAC25代替CmTTG1时,Y3H测定显示出类似的结果(图S1C),结果进一步表明 CmNAC25和CmTTG1都不会影响CmMYB6和CmbHLp之间的相互作用 。
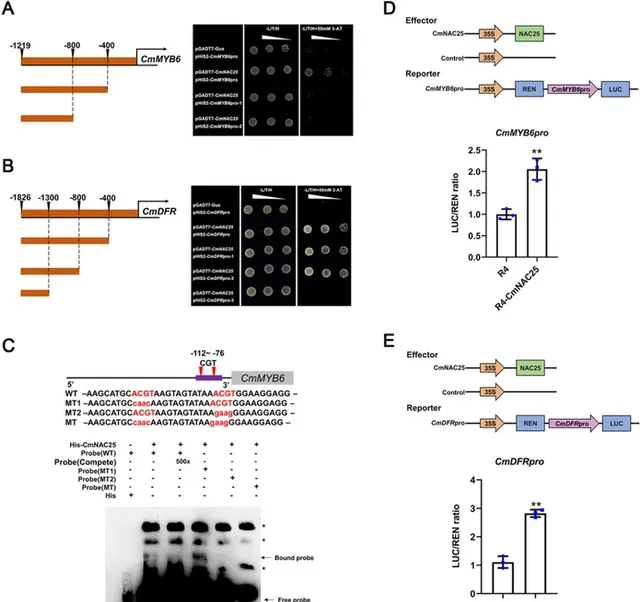
图5. CmNAC25 激活 CmMYB6 和 CmDFR 的启动子。A,B Y1H 测定CmNAC25与 CmMYB6 或 CmDFR 启动子不同片段之间的相互作用。使用与 pGADT7-Gus 和 pHIS2 构建体共转化的酵母细胞作为阴性对照。SD/-L/T/H 表示 Leu、Trp 和 His 合成营养缺陷型培养基。 C EMSA测定表明,CmNAC25直接与位于-89~−85bp的ACGT元件处的 CmMYB6 启动子结合。 *表示非特异性结合带。 D,E 双荧光素酶实验表明,CmNAC25 激活了 CmMYB6 和 CmDFR 的启动子活性,以 CmMYB6 或 CmDFR 启动子驱动的 LUC 作为报告基因。pORE-R4-35S::NAC25载体是效应子,空载体(pORE-R4)作为对照。对照组的LUC/REN比率设置为1。误差线表示三个生物学重复的 SD。用星号表示的样本表示显著差异( p <0.05,t 检验)。
研究者对菊花原生质体进行双荧光素酶测定,以进一步研究CmNAC25如何调控 CmMYB6 或 CmDFR 的表达。与对照组相比,35S::CmNAC25共表达的CmMYB6pro::Luc或CmDFRpro::Luc的LUC/REN比值显著增加(图5D,E)。这些结果表明,CmNAC25通过激活 CmMYB6 和 CmDFR 的表达来正向调节花青素的生物合成。
6 CmNAC25的表达模式与不同菊花品种衰老花瓣中花青素的积累有关
为了探究CmNAC25是否通过促进 CmMYB6 和 CmDFR 在不同菊花品种中的表达来调控花青素的积累 ,研究者 以「Nannong Lvdong」和「Ibis Sunny」为研究对象 。与「Arctic Queen」类似,这两个品种的花瓣在开花后阶段也逐渐变红(图6A),花青素增加(图6B)。 qRT-PCR分析显示, CmNAC25 在「Nannong Lvdong」、「Ibis Sunny」和「Arctic Queen」花瓣中S1-S3的表达水平上调(图6C),与表型一致。 此外, CmMYB6 和 CmDFR 的表达模式在开花后也呈上调趋势(图6D,E)。 这些结果进一步表明,CmNAC25作为花青素生物合成的正调节因子,在不同菊花品种中具有相似的分子调控机制,菊花在开花后逐渐变红 。
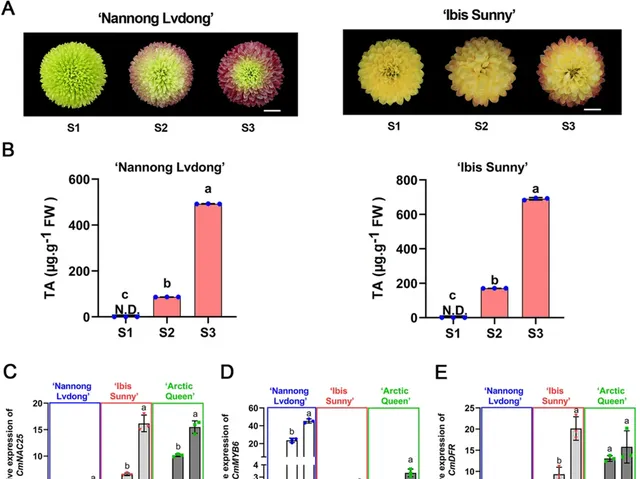
图6. 不同品种花后花瓣中 CmNAC25 、 CmMYB6 和 CmDFR 的含量及表达模式。A 「Nannong Lvdong」和「Ibis Sunny」花瓣在开花后阶段的表型。比例尺= 1cm。 B 「Nannong Lvdong」和「Ibis Sunny」花瓣中三个花期的总花青素含量(TA)。 C-E 「Nannong Lvdong」、「Ibis Sunny」和「Arctic Queen」花瓣中 CmNAC25 、 CmMYB6 和 CmDFR 的表达水平。误差线表示三个生物学重复的 SD。小写字母表示显著差异( p <0.05,方差分析,Tukey校正)。
7 CmNAC25的过表达促进烟草花瓣中花青素的积累
为了证实CmNAC25在调节花青素生物合成中的作用,研究者使用农杆菌介导的方法将pORE-R4-CmNAC25载体转化烟草( Nicotiana tabacum ) 。 T1代为4个过表达 CmNAC25 的转基因品系,其中3个(21#、40#和45#)的花色比WT更红 ,而其中一个的花色与WT相似(图7和图S5)。与WT相比,3个转基因品系花色更红(图7A),花瓣中花青素含量增加,转基因品系21#、40#和45#的花青素含量分别比WT高约72%、80%和54%(图7B)。 qRT-PCR分析表明, CmNAC25 转录本仅在转基因系中表达 (图7C)。此外, 内源基因中 NtDFR 的表达水平在转基因株系中诱导最为显著(图7D)。这些结果表明,CmNAC25是植物花青素生物合成的正调节因子。
图7. CmNAC25 的过表达诱导烟草中的花色和花青素积累。A CmNAC25 过表达品系和WT植株的表型。 B WT和转基因植物花瓣中的总花青素(TA)。 C 转基因系和WT的转录本 CmNAC25。 N.D.代表未检测。 D WT和转基因植株花瓣中 NtCHS 、 NtCHI 、 NtF3H 、 NtDFR 和 NtANS 的表达水平。误差线表示三个生物学重复的 SD。用星号表示的样本表示显著差异( p <0.05,t 检验)。
8 CmNAC25调控菊花花瓣中花青素的生物合成
为了进一步表征CmNAC25在菊花中的功能,研究者选择具有可用遗传转化系统的菊花品种「Jinba」获得过表达的 CmNAC25 和 RNAi-CmNAC25 转基因株系 (图8A)。如图8A所示, 与WT相比,两个 OE-CmNAC25 系4#和9#的花瓣呈现出更红的颜色。 相比之下, 在 RNAi-CmNAC25 的两个品系(23#和25#)中,在初始衰老阶段(完全开花后10天)观察到较浅的花瓣阴影。 此外,在过表达的 CmNAC25 植株的花瓣中检测到的花青素含量显著增加。相比之下, RNAi-CmNAC25 转基因株系的花瓣中花青素含量低于WT的花瓣,这与表型一致(图8B)。
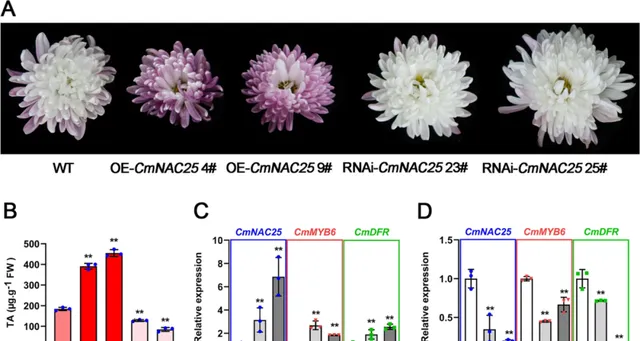
图8. CmNAC25 的过表达和抑制影响了转基因菊花「Jinba」的花瓣着色和花青素的生物合成。A WT和转基因品系 OE-CmNAC25 4#、9#和 RNAi-CmNAC25 23#、25#在衰老初期的花表型。 B WT和转基因植物花瓣中总花青素含量(TA)。 C CmNAC25 、 CmMYB6 和 CmDFR 在 OE-CmNAC25 转基因株系和WT中的表达。 D CmNAC25 、 CmMYB6 和 CmDFR 在 RNAi-CmNAC25 转基因株系和WT中的表达。 误差线表示3个生物学重复的SD。用星号表示的样品表示WT和转基因品系之间的显著差异( p <0.05,t检验)。
qRT-PCR分析表明 , 与WT相比, CmMYB6 和 CmDFR 的表达水平与 CmNAC25 表达一致,在两个过表达的 CmNAC25 品系中显著升高(图8C) 。相比之下,这三个基因的表达水平在两个 RNAi-CmNAC25 系中显著下调(图8D)。以上结果进一步表明, CmNAC25在花后阶段通过促进菊花花瓣中 CmMYB6 和 CmDFR 的表达来正向调控花青素的生物合成。 此外,CmNAC25介导的转基因「Jinba」中花青素的积累只发生在开花后阶段。 完全开花阶段过表达的 CmNAC25 品系仍为白色;这应归因于 CmMYB #7的高表达在开花期破坏了CmMYB6-CmbHLp蛋白复合物,破坏了花青素的生物合成 。
此外,为 了获得更多关于CmNAC25潜在下游调控网络的信息,研究者使用WT和 RNAi-CmNAC25 转基因株系23#( RNAi23# )在初始衰老阶段的花瓣进行RNA-Seq分析 (图S6)。 在WT和 RNAi23# 花瓣之间的转录组成对比较中检测到8120个DEGs。与WT相比, RNAi23# 中上调了5149个DEGs,下调了2971个DEGs(图S6A) 。在花青素生物合成途径中,包括 CmDFR 在内的大多数结构基因在 RNAi23# 中下调, RNAi23# 花瓣中的花青素少于WT(图S6B)。 RNAi23# 花瓣中 MYB6 、 MYB114 、 MYB111 、 bHLH63 等多个转录因子编码基因下调, EGL3 (bHLH)上调。然而,WT和 RNAi23# 之间 MYB#7 的表达水平没有显著差异(图S6C)。 这些结果表明,在转基因株系中,CmNAC25通过调控 CmMYB6 、 CmDFR 和其他基因来调控花青素的生物合成,而不是 MYB#7 。
讨论
菊花作为一种重要的切花材料,其颜色具有很高的经济价值。研究表明,菊花的粉红色、红色和紫色花瓣由不同含量的花青素提供。在一些菊花品种中,花瓣颜色在开花过程中发生变化,包括花瓣颜色的加深和花瓣颜色的褪色,这是由于花青素含量的变化而引起的,极大地影响了菊花的经济价值。了解上述变化过程的分子机理对菊花的分子育种非常重要。
在花瓣衰老的过程中,会发生一系列生理指标的变化,以及花瓣颜色的变化。 对于一些观赏植物,花药开裂,花瓣颜色褪色;例如,芍药「Coral Sunset」和「Pink Hawaiian Coral」的花色在开花后阶段由粉红色变为淡黄色,在湖北海棠Rehder的发育过程中,花朵由红色变为白色。在现代月季中,花衰老伴随颜色褪色,观赏价值丧失。当菊花花瓣在开花后进入衰老阶段时,发生的颜色变化分为两类。一是花青素含量降低,花瓣颜色褪色;花青素的生物合成是一个耗能的过程,因为涉及的氧化还原过程需要高能量,在花后减少其生物合成可能是为了节省能源和延长开花期;另一种是花青素开始积累,花色逐渐变红,如本研究选择的植物材料,即「Arctic Queen」「Nannong Lvdong」,「Ibis Sunny」。研究人员发现花青素的逐渐积累导致了上述表型。花药裂开决定了觅食者可以收集的可用花粉,因此蜜蜂等昆虫的授粉发生在花药裂开之后。这意味着花青素在开花后阶段开始积累,花瓣逐渐变红可能对吸引昆虫传粉者具有重要意义。此外, 植物衰老时会产生大量的活性氧(ROS),已知花青素可以清除自由基,因此花后阶段花青素的积累也可能参与花瓣中ROS的清除 。
花青素是类黄酮生物合成途径的产物,在该途径中一系列结构基因的持续催化下产生 。先前的研究表明, 该通路受到经典MBW复合物的正调控,其特征是菊花中的MYB6-bHLp 。 MYB TFs(转录因子)是类黄酮生物合成途径中结构基因的关键调节剂 。 不同阶段对「Arctic Queen」样品的转录组分析表明,与花青素生物合成和MBW复合物成员相关的结构基因的表达水平与花青素积累的增加一致 (图1和图3)。这表明,上游潜在转录因子可能通过MBW复合物和一系列结构基因发挥作用。先前的研究表明,TFs通过MBW复合物调节花青素的生物合成;例如,HAT1与MYB75相互作用并干扰MBW蛋白复合物,以抑制拟南芥中 pap1-D 植物丰富的花青素表型。此外,PpMYB18是花青素和PA积累的负调节因子,可以与MYB激活剂竞争与bHLHs结合,从而干扰MBW蛋白复合物。然而,到目前为止,通过MBW复合物起作用的TF在菊花中几乎没有特征。
研究人员表征了 CmMYB6 上游的转录因子 CmNAC25 , 它可以通过促进 CmMYB6 和 CmDFR 的表达来作为花青素生物合成的正调节因子 。此外, 还对转基因「Jinba」和WT进行了转录组分析。 在 RNAi-CmNAC25 转基因株系中, CmNAC25 的表达显著低于WT,不仅 CmMYB6 和 CmDFR 的表达水平显著降低,而且其他花青素生物合成基因的表达水平也显著降低(图S6),因为CmMYB6-CmbHLp是花青素生物合成途径的上游正调节因子。同时,研究人员发现 RNAi-CmNAC25 转基因株系中存在一些与WT相比差异表达的候选TFs,如几种MYB TFs和bHLH TFs(图S6)。这表明,尽管CmNAC25不与其他结构基因的启动子结合,但它可能通过调节这些潜在的转录因子来影响这些基因的表达。
NAC(NAM、ATAF1/2和CUC2)蛋白是最突出的植物特异性TF家族之一,具有保守的N端NAM结构域。NAC TF已被证明可以调节多种生物学过程,包括枝条顶端分生组织的形成和维持、花的发育、对应激诱导开花诱导的控制、胚胎发育、激素信号传导和次级细胞壁合成的调节。CmNAC25 属于 NAC 基因家族,其 N 末端具有保守的 NAM 结构域(图 4B)。先前的研究表明,转录激活结构域存在于C末端区域,而不是NAM结构域。研究人员的结果也说明了相同的事实,即截断 C 末端 (CmNAC25-S) 后的 CmNAC25 序列没有转录激活活性(图 4C)。系统发育分析表明,NAC TF家族规模庞大,包含若干亚群,如图4D所示,其中CmNAC25属于II组,与AtNAC25亲缘关系最为密切。另外还有两个基因 BoNAC19 和 MdNAC42 ,它们被表征为花青素生物合成的调节因子,并且也属于II组,它们与CmNAC25密切相关。在苹果中,MdNAC42是控制红肉苹果花青素色素沉着的调控网络的重要正调节因子。然而, BoNAC019 的过表达通过降低拟南芥中花青素基因的表达水平来减少花青素的积累。这表明,即使在同一组系统发育树中, NAC基因作为花青素生物合成调节因子的功能也发生了分歧。在本研究中,CmNAC25 被表征为花青素生物合成的正调节因子。
在以往的研究中,Xiang等人发现「Jinba」在开花期出现白色的原因是R3 MYB转录因子CmMYB#7与CmbHLp相互作用,破坏了菊花花青素生物合成所必需的MBW蛋白复合物CmMYB6-CmbHLp,从而阻断了白色花瓣中花青素的生物合成。 在开花后阶段, CmMYB#7 的表达降低,CmbHLp被释放形成CmMYB6-CmbHLp复合物,花瓣开始积累花青素,揭示了CmMYB#7在菊花蛋白水平上负调控MBW复合物形成的分子机制。 在本研究中, 研究者还发现,在「Arctic Queen」中,花青素积累的开始也可能是由 CmMYB#7 表达降低(图 S2)和 MBW 蛋白复合物中 CmbHLp 成员的释放引起的 (图 9)。此外, 本研究首次表征了 CmMYB6 上游的正调节因子 CmNAC25,并揭示了菊花开花后花瓣中花青素逐渐积累过程中转录水平的调控。 在 RNAi-CmNAC25 转基因系中,与 WT 相比, CmMYB#7 没有差异表达(图 S6),这表明 CmNAC25 可能不是 CmMYB#7 的上游。因此, 本研究阐明了激活因子 CmNAC25 和阻遏蛋白 CmMYB#7 在花青素积累的协调调控中发挥不同的作用,诱导菊花在开花后阶段变红(图 9)。

图9. CmNAC25调控的花青素在花后阶段的生物合成模型。 虚线框表示 CmNAC25 、 CmMYB6 、 CmbHLp 和 CmDFR 在盛花期的表达水平相对较低,而 CmMYB#7 在花后阶段的表达水平相对较低。实心框表示 CmMYB#7 在盛花期高表达, CmNAC25 、 CmMYB6 、 CmbHLp 和 CmDFR 在开花后表达水平上调。
综上所述,本研究探究了菊花后花瓣着色的分子机制。开花后阶段花青素的逐渐积累表现为花瓣逐渐变红。在开花后花瓣中上调的转录因子 CmNAC25 被证实位于 MBW 复合物成员 CmMYB6 和关键花青素生物合成基因 CmDFR 的上游 。此外, 它通过直接或间接调控多个基因作为花青素生物合成的正调节因子 ,这被转基因植物(包括烟草和菊花)的表型所认可。综上所述,CmNAC25在花青素诱导的菊花花瓣着色中起着至关重要的作用。











