编译:微科盟土豆炖豆角,编辑:微科盟居居、江舜尧。
微科盟原创微文,欢迎转发转载,转载须注明来源【微生态】公众号。
导读
抗生素在 自然环境中的积累会破坏微生物种群动态。然而,人们对地下水生态系统中微生物群落如何适应抗生素胁迫的了解仍然有限。通过从66个地下水样本中恢复2675个宏基因组组装基因组(MAGs),探讨了抗生素对细菌、古菌和真菌群落的影响,并揭示了应对抗生素胁迫的关键微生物及其机制。结果表明, 抗生素对细菌和古菌群落的影响最为显著,而对真菌群落的影响较小。 抗生素-微生物共现网络分析揭示了CPR细菌和DPANN古菌(地下水生态系统中的两个代表性微生物类群)在应对抗生素耐药性、增强网络连通性和复杂性方面的关键作用。进一步的基因组分析表明,CPR细菌携带了约6%的已鉴定的抗生素耐药基因(ARGs),表明它们具有独自抵抗抗生素的潜力。同时,研究还发现CPR细菌和DPANN古菌的基因组编码多种负责产生抗菌代谢物的生物合成基因簇(BGCs),不仅可以帮助CPR和DPANN生物,还有利于周围微生物对抗抗生素胁迫。这些 结果强调了抗生素对地下水原核微生物群落的显著影响,并强调了CPR细菌和DPANN古菌在增强微生物群落在抗生素胁迫下的整体恢复力和功能方面的重要性。
图文摘要
论文ID
原名: CPR bacteria and DPANN archaea play pivotal roles in response of microbial community to antibiotic stress in groundwater
译名: CPR细菌和DPANN古菌在地下水微生物群落对抗生素胁迫的响应中发挥关键作用
期刊: Water Research
IF: 12.8
发表时间: 2024.1
通讯作者: 孙卫玲,陈倩
通讯作者单位: 北京大学环境科学与工程学院
DOI号: 10.1016/j.watres.2024.121137
实验设计
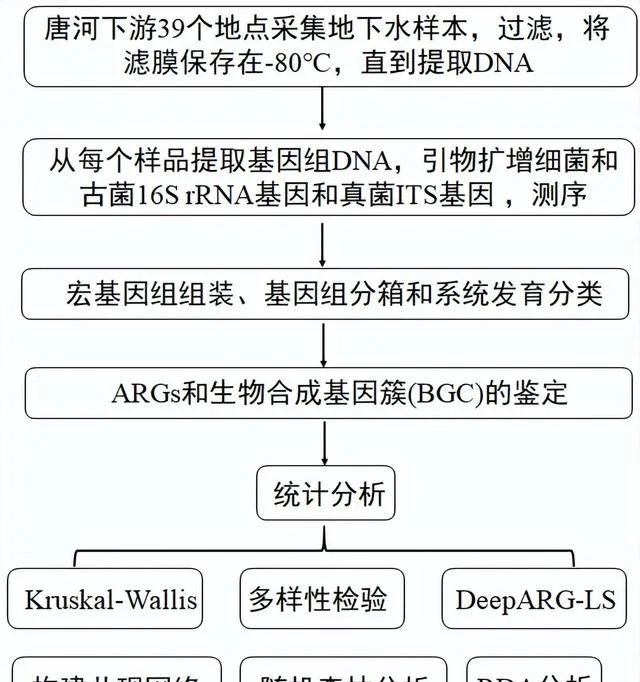
结果与讨论
1.抗生素的出现与分布
在83种目标抗生素中,共有39种在样品中被检出(图1A),检出频率为1.06%-87.2%。地下水中抗生素总浓度从未检出(ND)到466 ng/L不等。相比之下,本研究观察到的抗生素浓度低于西班牙巴塞罗那(水平达到1000 ng/L)和罗马尼亚克卢日-纳波卡(ND-917 ng/L)的城市地下水,高于中国洪湖地下水(低于200 ng/L)。与地表水相比,地下水中某些抗生素的浓度超过了五大洲河水中32种代表性抗生素的浓度中值(ND-286 ng/L)。这可能归因于工业污水库和附近畜牧活动排放的废水,这些废水可能随后被运输或渗入地下水。具体而言,在不同类别的抗生素中,磺胺甲恶唑(SMX)、磺胺二甲嘧啶(SMZ)、磺胺嘧啶(SDZ)、磺胺脒(SGD)、磺胺吡啶(SPD)和磺胺噻唑(STZ)均属于磺胺(SAs)类抗生素,其检出频率均超过50%,单个浓度为ND-384 ng/L。SAs在各种水生系统中占据主导地位。这种优势地位可归因于它们在人类和动物中的广泛使用、高溶解度和在地表水中的伪持久性。主要用于畜牧业的林可霉素(LCM,ND-167 ng/L)和莫能菌素(MON,ND-31.0 ng/L)在部分采样点也显示出较高的浓度,原因是附近广泛分布着农田。此外,还计算了风险熵(RQ)值来评估抗生素残留的潜在风险。结果表明,这些抗生素对人类健康或抗菌素耐药性选择的发展无显著风险。
此外,在雨季和旱季,抗生素的浓度和组成也有明显的季节性变化( p < 0.05,图1B-C)。雨季的抗生素总浓度(ND-342 ng/L,中位数49.2 ng/L)显著高于旱季(ND-384 ng/L,中位数24.4 ng/L)。对于不同类别的抗生素,雨季以SAs(88.3%)和LMs(7.6%)为主,而旱季则以SAs(92.6%)为主,表明抗生素组成在 不同季节之间存在差异(图1D)。由于SAs具有弱土壤吸附性、强亲水性和快速流动性,雨季的大量降雨和地表径流可促进其迁移并导致其在地下水中积累。这 可能是观测到季节变化的主要原因。

图1.抗生素在旱季和雨季的分布模式。抗生素类别和类型的堆叠面积图和气泡图(A);两个季节抗生素总量和不同种类抗生素的 箱线 图(B)(***表示差异显著, p < 0.001,Mann-Whitney U检验);非计量多维标度(NMDS)分析显示两个季节 抗生素的组成变化(C);桑基图显示不同季节抗生素的相对浓度(D)。
2.抗生素是塑造原核生物谱的主要因素
从77份样品中鉴定出62种细菌的16278个OTUs,16种古菌的4833个OTUs,15种真菌门的4683个OTUs(图S5A)。共检测到1319个细菌属、80个古菌属和837个真菌属。其中,细菌的Proteobacteria(10.3-84.8%)、Chloroflexi(0.79-45.3%)和Nitrospirae(0.06-48.7%),古菌的Thaumarchaeota(1.27-95.0%)、Marine_Benthic_Group_E(0.66-95.3%)和Aenigmarchaeota(0.36-70.6%),真菌的Ascomycota(2.59%-93.4%)、Basidiomycota(2.06-62.9%)和未分类真菌门(0.63-90.7%)是三个微生物界的优势门。Shannon和Simpson多样性指数以及基于群落Bray-Curtis相异性的β-多样性指数依次为:细菌>古菌>真菌( p <0.05),表明地下水微生物群落中细菌的丰富度、均匀度和总体多样性最高(图S5B-C)。这可能是由于细菌在自然环境中拥有最大的原核生物多样性。
RDA分析显示,环境因素和抗生素可以解释细菌、古菌和真菌群落变异的48.3%(图2A)。此外,古菌和细菌聚集在一起,并与抗生素呈正相关,而真菌则形成一个远离抗生素和环境因素的独立群体(图2A)。随机森林模型和线性回归分析进一步证明,以SAs为主的抗生素在塑造古菌和细菌群落谱方面起着至关重要的作用(图2B-C,图S6)。然而,它们对真菌群落的影响很小,只解释了9.21%的方差。SAs作为人类和动物细菌感染常用的合成广谱抗菌抗生素,不仅通过folicase的竞争性抑制剂作用于细菌,还通过抑制碳酸酐酶的合成作用于古菌,从而影响原核微生物。
Pearson相关性分析表明,许多细菌和古菌类群与抗生素和环境因素均显著相关。具体而言,某些细菌门,如绿弯菌门(Pearson’s r = 0.23)、Parcubacteria(CPR, Pearson’s r = 0.29)、Omnitrophica(Pearson’s r = 0.23)和厚壁菌门(Pearson’s r = 0.26),与抗生素呈显著正相关,而浮霉菌门(Pearson’s r = -0.25)和放线菌门(Pearson’s r = -0.41)与抗生素呈显著负相关。正相关可能反映了抗生素耐药能力,而抗生素产生的负面影响可能归因于微生物的易感性和脆弱性。这表明抗生素可能对微生物群落产生抑制或刺激作用。在古菌群落中,优势DPANN门Aenigmarchaeota(Pearson’s r = 0.48)和Parvarchaeota(Pearson’s r = 0.26)与抗生素呈显著正相关。这表明这些古菌可能对抗生素的影响表现出抗性,DPANN古菌基因组中存在五种能够抵抗lobophorin的KijX同源物可以进一步证实这一点。
相比之下,前3个真菌类群仅受环境因素(而非抗生素)的影响,其余真菌与检测到的任何环境因素均无显著相关性(图S7)。这一发现与真菌通常较少受选择限制的理解相一致,与原核生物类群相比,真菌对环境过滤的敏感性较低。先前的研究还表明,确定性过程主要决定原核生物群落的组装,而随机性过程在真菌群落组装中的作用更为突出,尤其是在地下水环境中。原核生物群落和真菌群落之间影响因素的差异可归因于它们不同的生理特征,包括碳利用效率和胁迫耐受机制。这些固有的差异可能导致原核生物和真菌对环境因素和抗生素的不同反应。

图2.基于Bray-Curtis距离的冗余分析(RDA)显示抗生素和环境因素与细菌、古菌和真菌群落的关系(A)。随机森林模型确定抗生素和环境因素对细菌、古菌和真菌群落的重要性(B),EV:解释方差。各因素的均方误差增加百分比(%IncMSE)用于评估这些预测因子的重要性,%IncMSE值越高,说明其重要性越高。线性回归模型显示了抗生素总浓度与基于细菌、古菌和真菌群落Bray-Curtis差异的β多样性指数之间的相关性(C)。
3.CPR细菌和DPANN古菌在应对抗生素胁迫方面发挥关键作用
为了探索地下水中原核生物和抗生素之间的非随机共现模式,从宏基因组学数据中重建了2675个MAGs,并建立了一个多域网络(图3A)。在分析的所有MAGs中,分别有399、191、2007和78个MAGs被分配给CPR、DPANN、其他细菌和其他古菌。在9种抗生素与370个CPR MAGs、182个DPANN MAGs、1965个其他细菌MAGs和77个其他古菌MAGs之间,共鉴定出140667对显著且强相关性( p <0.01且 ρ >0.6)。值得注意的是,CPR和DPANN生物在网络中表现出比其他细菌显著更高的节点度和传递性值(图3B),表明它们与其他微生物有很强的连接性和关联性。这可能是由于它们的共生特性,导致共生体之间的密切交流和代谢联系。共鉴定出480个MAGs与抗生素有显著相关性,其中79个MAGs属于CPR生物,88个MAGs属于DPANN生物。这些CPR和DPANN生物在网络中分别被分配到11095对和3141对显著相关性,分别占其总相关性的28.3%和85.3%。基于观察-期望比(O/R)分析,发现生物和抗生素之间的关联是非随机的(表S6)。与其他细菌(O/R=1.32)相比,CPR、DPANN和其他古菌的O/R值(2.22、4.56和3.20)更高,表明它们更容易与抗生素共存或在地下水中具有抗生素敏感性。

图3.抗生素与宏基因组组装基因组(MAGs)(有/无CPR和DPANN生物)的共现网络(A)。箱形图显示了网络中多域群落之间节点级拓扑特性的差异(B)。直方图显示了有和没有CPR和DPANN生物的网络之间网络拓扑特性的差异(C)。鲁棒性分析显示了微生物自然连通性与去除CPR和DPANN节点的比例之间的关系(D)。随机森林模型用于评估地下水中优势门子网络对元群落网络的定量贡献(E)。
为了探究CPR和DPANN生物在地下水微生物群落中的作用,构建了一个不包含它们的共现网络,并比较网络拓扑特性(图3A)。在没有CPR和DPANN生物的情况下,网络中包含2015个MAGs,占 CPR和DPANN生物 网络中节点的77.4%。然而,边的数量减少到78115个,仅占CPR和DPANN生物网络中边的44.5%。这突出了超门类微生物在增强地下水微生物网络连接性方面的重要作用(表S7)。相应地,在没有CPR和DPANN生物的情况下,网络的聚类系数、图密度和网络直径值较低,但模块化程度较高(图3C),表明网络复杂性降低。较高的模块化程度和较低的复杂性表明,CPR和DPANN生物的存在促进了地下水中微生物生态位的重叠。这可能会促进不同群落之间更强的协同作用,从而增强其对外部压力的抵抗力。通过移除CPR和DPANN节点来操纵自然连接幅度,评估了有或无CPR和DPANN生物的微生物网络的鲁棒性(图3D)。结果一致显示,与有超门类节点的网络(平均值为1.17)相比,没有CPR和DPANN生物的网络的自然连通性较低(平均值为0.04)。此外,根据相应子网络的网络级和节点级拓扑特征,采用随机森林模型定量评估优势门对元群落网络的贡献(图S6。值得注意的是,CPR和DPANN生物被识别为构建元群落网络的最重要贡献者,超过其他主要的细菌和古菌门,其%IncMSE为12.0(图3E)。这些发现突出了CPR和DPANN生物在增强地下水生态网络的连通性和复杂性方面的关键作用。这些生物的存在可能有助于形成一个具有共享生态位的更紧密相连的网络。
CPR和DPANN生物网络的模块性为0.45(>0.40,表明存在模块化结构),可分为七个模块(图4A)。同一模块中的节点相比不同模块中的节点表现出更强的相互连接,反映了占据不同生态位的微生物集群之间的功能差异。值得注意的是,网络中的所有抗生素都聚集在模块II中,该模块的节点度和传递性值最高。这表明模块II中的微生物具有最强的相关性,并在抗生素压力下形成了复杂的聚集(图4B)。抗生素的存在可能会影响该模块内的群落组成和动态。这些结果表明,地下水中与抗生素有显著相关性的微生物可能具有特定的代谢功能,以缓解抗生素胁迫。此外,与其他微生物相比,CPR和DPANN生物的丰度最高(分别占模块II中细菌和古菌总丰度的32.3%和75.2%,图4C-D,图S8-9),并且它们在模块II中的丰度超过了其他模块(占总丰度的41.1%和60.4%),表明它们对抗生素的强烈反应。Chloroflexota、Omnitrophota和Desulfobacterota被鉴定为模块II中的优势细菌(图S9)。鉴于CPR和DPANN基因组一直缺乏核苷酸、脂质、脂肪酸和多种氨基酸的完整核心生物合成潜力,这些微生物可能通过提供必要的基因和副产物,在填补CPR和DPANN生物的代谢空白方面发挥重要作用。
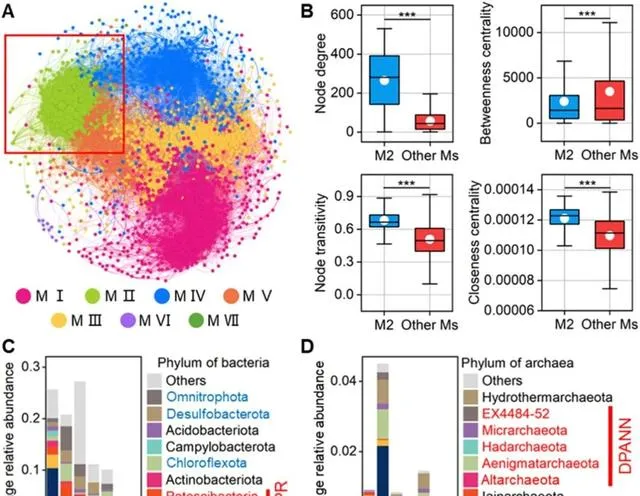
图4.根据模块特性对CPR、DPANN、其他细菌、其他古菌MAGs与抗生素的模块化网络进行着色(A)。箱形图显示了模块II和其他模块之间节点级拓扑特性的差异(B,Mann-Whitney U检验:*** p <0.001,** p <0.01和* p <0.05)。堆积柱状图显示了不同模块中CPR和其他细菌(C)以及DPANN和其他古菌(D)的相对丰度。
4.抗菌素耐药性潜力和次生代谢物合成以应对抗生素胁迫
为了评估CPR和DPANN生物的抗生素抗性潜力,使用深度学习方法(DeepARG)预测了2675个MAGs的ARGs。在这些MAGs中,共鉴定出16种ARG类型(133个亚型),其中最常见的是多药类(46%)、氨基糖苷类(17%)和杆菌肽类(10%) ARGs。相应的抗生素抗性机制是抗生素外排(38.1%)、靶标改变(20.5%)和靶标替代(13.7%,图5)。值得注意的是,鉴定出的ARGs宿主都是细菌,这表明细菌是地下水中ARGs的主要储存库和载体。古菌具有不同于细菌的独特细胞壁组成和结构,这可能有助于它们对许多抗生素产生天然抗性。
变形菌门(细菌门)在ARGs宿主中所占比例最大(56%),其次是Desulfobacterota(11%)和Chloroflexota(10%)。在属水平上,未分类类群占总ARG丰度的比例最高(30.1%)。其他的ARGs优势宿主包括 Gallionella (4.82%)、 Rhodoferax (2.20%)、 Sulfuritalea (2.15%)、 Ramlibacter (1.65%)和 Pseudomonas_E (1.64%)(表S8)。这种分布与在长江中观察到的分布不同,长江中的大多数ARGs宿主隶属于 Limnohabitans、Acidimicrobium 和 Candidatus Methylopumilus 。
图5.利用DeepARG预测地下水中多个宏基因组组装基因组(MAGs)中ARGs的相对丰度及其对应的抗性机制和宿主。
CPR细菌含有检测到的ARGs的6%,包括多药(5.22%)、MLS(0.54%)、QN(0.30%)、未分类(0.06%)和利福霉素(0.02%)耐药基因(图5)。在鉴定出的ARG-宿主CPR细菌中, UBA10151 (1.49%)、 2-02-FULL-42-16 (0.28%)和 02-FULL-45-10c (0.24%)的ARGs相对丰度最高(图S10)。最近一项基于4062个CPR基因组的调查也强调了13个CPR超门类中存在多种抗生素耐药样基因。这些基因编码了与14种抗菌类相关的89种不同类型的酶。ARGs在CPR中的广泛存在表明,尽管它们体型超小、基因组减少,但仍有能力适应抗生素胁迫下的地下水环境并存活下来。特别是,Chloroflexota和CPR微生物主要通过靶向修饰、影响抗生素结合和通过膜蛋白外排抗生素来对抗抗生素。Chloroflexota和CPR之间在ARGs和抗性机制方面的相似性可能归因于这两个类群之间的微生物相互作用。它们在抗生素-微生物网络中的密切关系及其在系统发育上的姊妹谱系表明了水平基因转移和共享与抗生素抗性相关的遗传元件的可能性。
通过使用AntiSMASH预测MAGs中生物合成基因簇(BGCs)的存在,评估了地下水微生物产生次生代谢物的遗传潜力。从1906个去重复基因组中共鉴定出6751个BGCs(48种类型)。其中,在CPR和DPANN基因组中发现了156个BGCs(21种类型)(图6A-B)。在已鉴定的48种BGCs类型中,据报道有21种具有编码各种抗菌次级代谢物的能力。具体而言,在CPR生物的基因组中,观察到10种BGC类型,而DPANN生物则发现含有7种BGC类型(表S9)。地下水中CPR和DNANN生物基因组主要含有萜类和非核糖体肽合成酶样(NRPS-like)基因簇(图6B)。萜类基因簇广泛分布在细菌中,也是古菌基因组中的第二大BGCs,可以通过这些基因簇编码各种抗生素。另一方面,NRPS基因簇是BGCs中最大的类别之一,负责合成多种抗生素,如青霉素、万古霉素和粘菌素。微生物通常产生抗生素来干扰它们附近的生物,或将其用作低浓度的信号化合物。在这种情况下,BGCs通常通过提供对自身产生的抗生素的抗性来发挥关键作用。这种保护机制有助于在高抗生素条件下保护宿主细胞。微生物编码多种抗菌次生代谢物的能力可能对其自我保护以及与其他微生物的相互作用至关重要。
与其他细菌相比,环二肽合成酶(CDPS)和线性含唑肽(LAP)基因簇在CPR基因组中显著更高,分别占已鉴定基因簇的16%和12%( p <0.05,图6C)。在DPANN古菌中,这两种BGCs共占已鉴定基因簇的10%。CDPS基因簇编码依赖tRNA的肽键形成酶,即环二肽。环二肽是一类具有多种细胞保护作用的小型环肽,包括抗细菌、抗真菌、抗病毒和免疫抑制活性。CDPS基因簇还包含大量的LuxR和MarR转录因子,这些转录因子参与调节对环境刺激(如有毒化学物质和抗生素)的反应过程。该基因簇有助于CPR和DPANN生物应对地下水中的抗生素胁迫。LAP基因簇作为核糖体合成的翻译后修饰肽(RiPPs)的一个亚家族,负责编码phazolicin,phazolicin靶向细菌核糖体并上调多药耐药外排泵以实现抗菌活性。LAP基因簇的这种独特能力可能有利于其他微生物适应高水平的抗生素胁迫。因此,CPR细菌和DPANN古菌具有相似的固有抗性能力和产生次生代谢物的潜力。它们的共生生活方式和微生物-抗生素网络中的广泛连接表明,它们可能通过共享这些代谢物来支持其他微生物,从而提高对抗生素胁迫的整体恢复能力。这种利他行为确保了它们在抗生素存在下的集体生存,并有助于维持整个微生物群落的平衡。
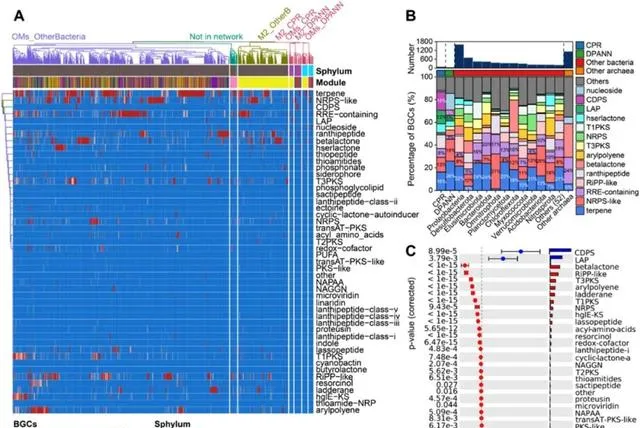
图6. MAGs中古菌和细菌生物合成基因簇(BGCs)归一化数量的分层聚类图(A)。地下水中不同分类群BGCs的数量和组成(B)。扩展误差条形图显示了CPR(蓝色)和其他细菌(红色) MAGs中BGCs的平均比例之间的显著差异(C)。
结论
抗生素的广泛使用和释放对群落组装过程产生了重大而复杂的影响。本研究探讨了抗生素和其他环境因素对细菌、古菌和真菌群落的影响。结果表明, 抗生素对细菌和古菌群落的影响最大,而对真菌群落的影响则很小。这表明真菌与原核微生物在地下水环境中具有不同的分布特征。在未来探索原核微生物和真菌之间的生物地理特征的研究中,考虑抗生素等污染物所产生的全面影响是很重要的。
CPR细菌和DPANN古菌作为两个新的超级类群, 在地下水等缺氧或厌氧环境中表现出显著的多样性 。该研究揭示了这些生物在增强地下水生态网络的连通性和复杂性方面发挥了关键作用。值得注意的是,CPR细菌和DPANN古菌不仅具有抗菌耐药能力,而且具有产生次生代谢物的潜力。这些次生代谢物可能有助于其他微生物适应抗生素胁迫,从而有利于维持微生物群落的整体平衡。
该研究对于理解地下水如何蕴藏出与地表水不同的特定功能微生物具有重要意义。这些独特的微生物,如CPR细菌和DPANN古菌,在抵御微生物群落中污染物引起的干扰方面可能发挥重要作用。它们的代谢能力和与其他微生物的相互作用有助于地下水生态系统的恢复力和稳定性。考虑这些本土生化条件和微生物对于地下水系统的有效和可持续管理实践至关重要。未来的地下水管理策略应该考虑到这些特定微生物的存在和功能,以确保地下水质量和生态平衡的保护和恢复。











