一. 单细胞筛选的意义
(1)生物药开发是一个非常复杂的过程,而构建适用于工业生产的高表达的稳定细胞株是生物药工艺开发的起点和基础,后续开发、临床前和临床工作都是基于某一确定的细胞株进行开展的。
(2)用于表达治疗性蛋白的工程细胞需要来源于同一原始细胞,原因在于工程细胞的单克隆源性是产品的质量、表达量稳定性的必要条件。
(3)食品药品监督管理局(FDA)的政策和法规都强制要求生物制药企业提供清晰图片证据以证明单克隆抗体研发过程中的单克隆源性。
(4)减少细胞库的异质性,减少单克隆细胞筛选的复杂流程,保持生产过程的一致性和可预见性,确保最终产品的产量和质量在预设的范围内。
二. 细胞株构建
细胞株构建包含转染、筛选细胞群、单克隆化、筛选单克隆等步骤。
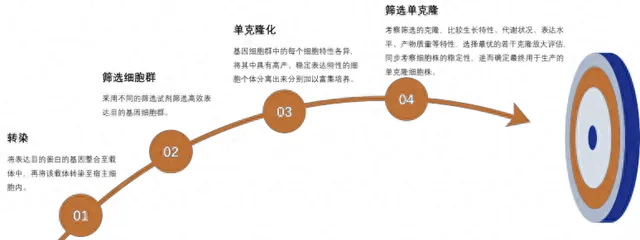
细胞株构建流程
三. 单克隆成像
在提供单克隆证据方面,单克隆成像技术的出现具有重要意义。不同于概率计算和统计,单克隆成像系统提供直接的影像证据,是目前可以确定单克隆的可靠方法。
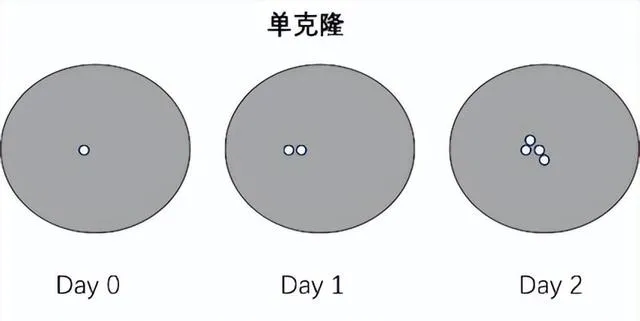
单克隆成像技术
但还存在着一些问题:成像系统的清晰度,能不能全孔清晰成像,尤其是边缘细胞不能清晰成像是一个问题;其次是液面高度,成像系统一般是对底面成像,所以细胞只有在底面才可能清晰成像;另外孔板间差异也对成像系统提出挑战,微孔板不是一个绝对的平面,为了能够拍清楚微孔板底部的细胞,成像系统最好能够进行逐孔聚焦成像。
四. 单细胞筛选方法
单细胞筛选方法主要有7种,包括有限稀释法、高通量细胞克隆筛选系统、流式细胞荧光分选技术、单细胞打印技术、口吸管技术、激光捕获显微切割技术、MACS磁珠分选技术。
单细胞筛选方法
有限稀释法是常用的筛选方法,这是一种比较难给出一个通用的单克隆形成率,需多轮实验获得高单克隆率的方法。
优势:低成本、易于操作,对仪器设备的需求比较少,与成像系统关联使用
劣势:效率较低,对人工依赖较高,实验结果差异大,需大量实验筛选
注意事项:
① 细胞聚团情况, 细胞聚团会降低单克隆的概率。
② 0.5cells/孔铺板, 按泊松分布可计算细胞数为0的孔比例应该是 61%, 但事实上克隆的长出率变动很大, 其比例可从10%到98%, 这主要和细胞活率、筛选压力及培养条件等因素有关。
③ 若需检查细胞数目, 可在铺板第0天1~2 h细胞自然沉降 (也可通过离心微孔板加速此过程) 后镜检微孔板, 采用自动成像设备记录孔内的细胞数目, 分析其泊松分布的适合度。
④ 可连续多天检查孔中细胞的生长和倍增情况, 并进行比对分析; 必要时应检查铺板前的空板, 以排除假信号。
五. 单克隆源性验证
在申报IND的时候需要提交关于细胞株克隆过程的描述以及单克隆源性证据。
(1)High probability:一轮细胞克隆加孔板照相可以满足单克隆源性要求。
铺板方法可以是有限稀释(铺板密度≤0.5cell/well,实际操作中,考虑操作误差一般低于0.5cell/well)。孔板照相需要在第0天,拍摄清晰的单个细胞存在,在第1天和第2天再次拍照捕捉细胞分裂过程。
(2)Low probability + High Assurance:根据克隆细胞独特的遗传学特征分析外源基因整合位点。整合位点的分析方法主要有如下几种:
(a) 荧光原位杂交技术(Fluorescence in situ hybridization,FISH)
(b) Southern Blot:kb级DNA检测水平
(c) Junction PCR:bp级DNA检测水平
(d) 下一代测序技术(next-generation sequencing technology,NGS)

作者:海星生物
公众号:海星生物科技
以上内容由海星生物(//www.hycyte.com)提供
我们的服务:CRISPR/Cas9细胞基因编辑、载体构建/病毒包装、分子诊断标准品/突变基因标准品/融合基因标准品、细胞稳转/细胞干扰
我们的产品:HyCyte干细胞/原代细胞/细胞株、三系诱导培养试剂、ClonePlus 专用培养基、基因编辑试盒、病毒现货、细胞专用血清











