引言
星形胶质细胞是哺乳动物大脑中数量最多的细胞类型,具有为神经元提供结构支持、维持代谢平衡、调节突触功能等重要作用 。此外,星形胶质细胞在大脑受损或疾病状态下会发生反应性变化。然而,有一小部分星形胶质细胞位于成年大脑的特定区域,如侧脑室下区(ventricular–subventricular zone, vSVZ),这些星形胶质细胞表现出类似神经干细胞(neural stem cells, NSCs)的能力,能够分化为神经元和胶质细胞。这一现象表明, 星形胶质细胞在某些条件下具有可塑性,可被重新编程为具有干性(stemness)的细胞 。然而,普通实质星形胶质细胞与静止神经干细胞在转录组上高度相似,尽管它们的功能截然不同。如何通过分子机制对干性进行编码,仍是未解之谜。
9月4日 Nature 的研究报道「 DNA methylation controls stemness of astrocytes in health and ischaemia 」,通过单细胞RNA测序(single-cell RNA sequencing, scRNA-seq)和单细胞甲基化组测序(scNMT-seq)等技术,对健康和缺血状态下成年小鼠纹状体和皮质的星形胶质细胞、神经干细胞及其后代进行了深入分析, 揭示了DNA甲基化在星形胶质细胞向干性转变中的核心作用 。研究发现, 神经干细胞的功能依赖于星形胶质细胞基因的甲基化,以及干细胞相关基因的去甲基化。这一过程尤其在大脑受缺血损伤时表现明显,缺血会诱导纹状体星形胶质细胞获得干性,而这一转变需要甲基转移酶DNMT3A的介导 。如果缺乏DNMT3A,缺血性损伤将无法触发星形胶质细胞的干性激活,进一步证明DNA甲基化在干性调控中的关键作用。
研究表明,DNA甲基化的动态变化不仅在胚胎发育中发挥重要作用,同样也是成年神经干细胞分化过程中的重要调节机制。这一发现为再生医学提供了新视角,表明通过调控DNA甲基化,可以促进神经再生,进而为大脑损伤后的修复提供潜在治疗手段。

星形胶质细胞是中枢神经系统中最丰富的细胞类型,尽管它们长期以来被认为主要负责结构性支持和代谢功能,但近年来的研究揭示了它们在神经再生中的潜在作用,尤其是在受到损伤时。这些胶质细胞具备一定的可塑性,能够在特定条件下转变为神经干细胞(neural stem cells, NSCs),这种转化过程与表观遗传调控密切相关,特别是DNA甲基化(DNA methylation)在其中发挥了关键作用。
哺乳动物成年大脑中存在有限的神经生成(neurogenesis)区域,主要包括侧脑室下区(ventricular–subventricular zone, vSVZ)和齿状回(dentate gyrus)。在vSVZ区域,星形胶质细胞不仅可以在健康状态下表现为支持性细胞,还可以在损伤条件下获得神经干性(stemness),成为神经生成的主力军。然而,大多数实质性的星形胶质细胞,如位于纹状体(striatum)和皮质中的细胞,通常不具备这种能力,如何通过表观遗传机制调控这一过程成为研究的重点。
为了深入研究DNA甲基化在星形胶质细胞干性中的作用,研究团队采用了单细胞核小体、甲基化组和转录组联合测序技术(single-cell nucleosome, methylome and transcriptome sequencing, scNMT-seq )。这种技术可以同时捕获单个细胞的基因表达、DNA甲基化以及染色质可及性(chromatin accessibility),为深入分析细胞命运的表观遗传调控提供了强有力的工具。研究对象为成年小鼠纹状体和vSVZ区域的GLAST+星形胶质细胞以及神经元前体(neuroblasts),这些细胞被分离并进行单细胞测序分析。
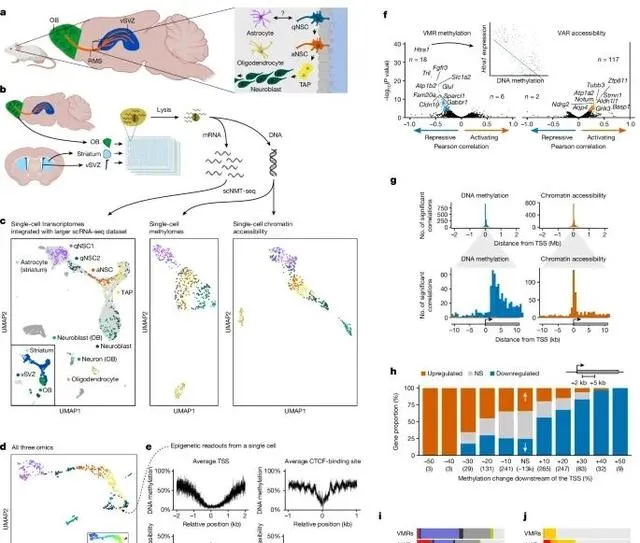
神经干细胞谱系中的转录组、甲基化组和染色质可及性之间的相互关系,揭示了这些分子层面的变化在神经干细胞分化过程中的作用 (Credit: Nature )
成年NSC谱系的示意图: 图a展示了位于侧脑室下区(vSVZ)的神经干细胞谱系,显示了神经干细胞如何从静止状态转变为活跃状态,并进一步分化为中间放大祖细胞(TAPs)、神经母细胞(neuroblasts)以及神经元。
实验流程和分析的脑区: 图b展示了实验流程,研究通过scNMT-seq(单细胞核小体、甲基化组和转录组联合测序)技术从vSVZ、嗅球(olfactory bulb)和纹状体中获取三组学数据,分析这些脑区中的不同细胞类型。
分子层面的单细胞聚类结果: 图c通过UMAP降维分析显示了不同细胞类型在转录组、甲基化组和染色质可及性三层数据中的分布,分别标记了静止神经干细胞(qNSCs)、活跃神经干细胞(aNSCs)、TAPs、神经母细胞和神经元。
不同细胞类型的谱系顺序: 图d展示了细胞沿着谱系的伪时序排序,显示了从静止神经干细胞到神经元分化的动态过程,并结合了三层分子数据对细胞状态的区分。
启动子和CTCF结合位点的甲基化与染色质可及性: 图e展示了在一个典型神经母细胞中,基因启动子和CTCF结合位点附近的甲基化和染色质可及性水平,显示了在这些区域甲基化降低且染色质开放。
基因表达与表观遗传特征的相关性: 图f显示了基因表达与变异甲基化区域(VMRs)和变异可及性区域(VARs)之间的相关性,发现基因表达通常与其下游区域的甲基化水平相关联,说明了这些表观遗传特征在基因调控中的作用。
DNA甲基化与神经干性相关基因的调控
研究表明,在健康状态下,星形胶质细胞中的DNA甲基化会抑制与神经生成相关的基因表达,维持其胶质细胞的特性。然而, 在缺血性损伤(ischemic injury)发生时,DNA甲基转移酶DNMT3A的表达增加,导致神经生成相关基因去甲基化(demethylation),从而激活这些基因,促进星形胶质细胞向神经干细胞的转化 。
DNMT3A缺失的星形胶质细胞在缺血性损伤下未能有效激活神经生成过程,表明DNMT3A在损伤修复和干性激活中的关键作用。研究还发现,与神经生成相关的基因去甲基化显著增强,DNA甲基化在控制星形胶质细胞命运转换中的作用得到了进一步证实。
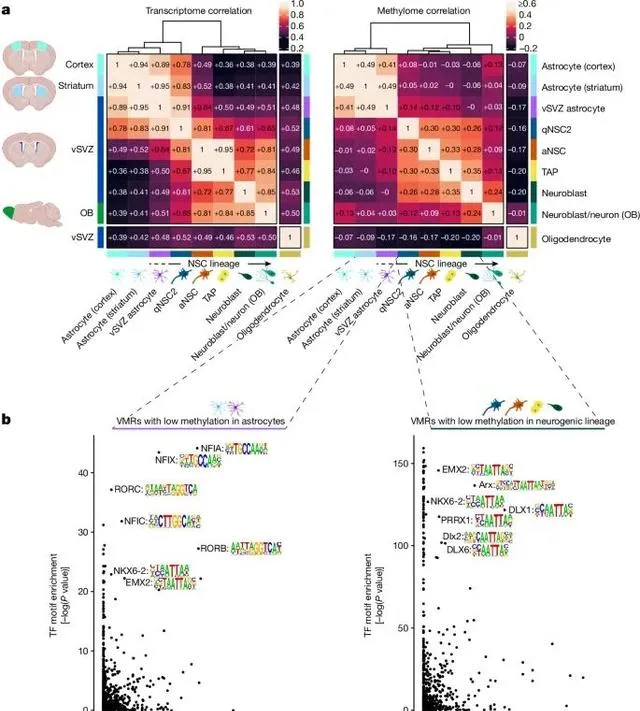
尽管神经干细胞与普通星形胶质细胞在基因表达上相似,但它们通过独特的DNA甲基化模式实现了功能上的区分 (Credit: Nature )
基因表达与DNA甲基化的差异: 图a展示了不同细胞类型(包括vSVZ区域的星形胶质细胞、纹状体的星形胶质细胞和神经干细胞)的基因表达和DNA甲基化的相关性矩阵和层次聚类分析。尽管神经干细胞和星形胶质细胞在基因表达方面高度相似,但它们在DNA甲基化模式上存在明显差异,尤其是qNSC1阶段(静止神经干细胞)与普通星形胶质细胞的DNA甲基化模式相似,而qNSC2阶段(活跃神经干细胞)则与神经干细胞谱系的其他细胞更加接近。
VMR(变异甲基化区域)的转录因子结合位点富集: 图b展示了在星形胶质细胞和神经干细胞中,低甲基化区域(VMRs)与转录因子结合位点的富集情况。研究发现,在星形胶质细胞中,这些区域富集了NFIA和NFIX等转录因子的结合位点,这些因子已知与星形胶质细胞的分化有关;而在神经干细胞中,OLIG2等转录因子的结合位点则更为富集,这些因子与神经干细胞的分化和谱系决定密切相关。
DNA甲基化与细胞状态的关联: 图a中的层次聚类分析揭示了尽管神经干细胞与星形胶质细胞的基因表达相似,但在DNA甲基化层面,神经干细胞表现出独特的甲基化模式,这种差异主要出现在qNSC2阶段,表明该阶段的细胞正在经历表观遗传重塑,逐步从星形胶质细胞转变为神经干细胞。
特异性甲基化的作用: 图中还展示了不同细胞类型特异性低甲基化区域(VMRs)的分布,发现神经干细胞中的这些低甲基化区域与神经元生成相关基因如Ascl1和Dlx1等密切相关,而星形胶质细胞中的低甲基化区域则与细胞代谢和离子运输相关基因如Slc1a2和Glul等相关。这些结果表明,DNA甲基化在细胞命运决定和功能差异中起着关键作用。
神经干细胞和星形胶质细胞的表观遗传差异
研究通过单细胞多组学技术分析了神经干细胞和星形胶质细胞的转录组、DNA甲基化组和染色质可及性。结果显示,神经干细胞的DNA甲基化水平与星形胶质细胞显著不同,神经干细胞中的去甲基化过程特别活跃,与其干性相关基因的表达增强密切相关。
此外,研究发现缺血性损伤显著改变了纹状体中星形胶质细胞的DNA甲基化模式,特别是与神经生成相关的基因区域。去甲基化的增强使得这些细胞能够进入神经生成途径,而这一过程依赖于DNMT3A。
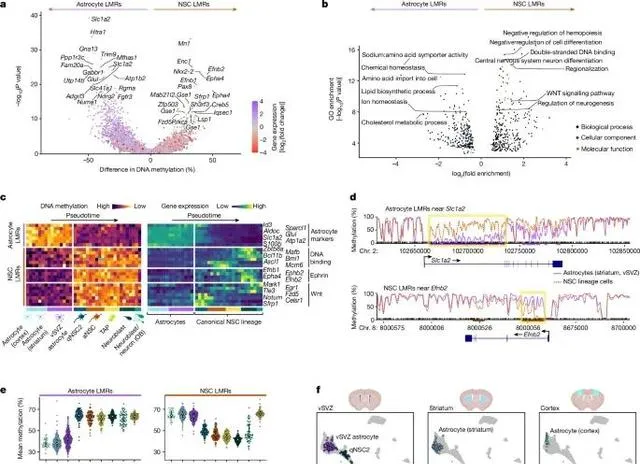
神经干细胞通过特异性DNA去甲基化,激活了神经生成相关基因,形成了促神经生成的甲基化组,这一表观遗传特征将它们与普通星形胶质细胞明显区分开来 (Credit: Nature )
神经干细胞与星形胶质细胞的DNA甲基化差异: 图a通过DNA甲基化组分析显示,神经干细胞和普通星形胶质细胞在特定基因区域的甲基化模式存在显著差异。神经干细胞的低甲基化区域主要集中在与神经生成相关的基因上,而星形胶质细胞则在非神经生成基因区域保持高甲基化。这些差异表明,神经干细胞的DNA甲基化组特征为其神经生成功能提供了基础。
特定基因的DNA甲基化状态分析: 图b展示了多个与神经生成密切相关的基因,如Neurog2和Ascl1,在神经干细胞中的DNA甲基化水平显著降低,表明这些基因的去甲基化与神经干细胞的活化和神经生成能力相关。同时,图中还展示了这些基因在普通星形胶质细胞中的高度甲基化状态,暗示这些细胞无法激活神经生成通路。
甲基化差异区域(DMRs)分析: 图c进一步分析了神经干细胞与星形胶质细胞之间的甲基化差异区域,发现神经干细胞中特异性低甲基化区域与神经生成和神经发育相关基因密切相关。这些低甲基化区域包括与神经元分化、轴突生长和神经突触形成相关的基因,如Dlx2和Mapt,而星形胶质细胞则表现出这些基因的高甲基化状态。
DNA甲基化与细胞功能的关联: 图d展示了神经干细胞和星形胶质细胞的基因表达与DNA甲基化之间的关联,显示出神经干细胞中低甲基化的基因通常与神经元生成和分化相关。这些基因在星形胶质细胞中被甲基化抑制,进一步说明了DNA甲基化在细胞命运决定中的重要作用。
促神经生成的DNA甲基化模式: 图e强调了神经干细胞中富集的低甲基化区域,特别是在神经干细胞活化阶段,DNA去甲基化促进了神经生成相关基因的表达。与此同时,星形胶质细胞的甲基化模式则维持了其支持性细胞的功能,未表现出神经生成的潜力。
不同状态下星形胶质细胞的转录组和DNA甲基化模式
通过对健康与缺血状态下的细胞进行比较,研究揭示了星形胶质细胞和神经干细胞在不同状态下的表观遗传特征。特别是,DNA甲基化在静止状态下能够锁定星形胶质细胞的胶质细胞命运,抑制神经生成相关基因的表达;而在缺血性损伤时,去甲基化则解除了这种锁定,使得细胞能够转变为神经干细胞,参与损伤修复。
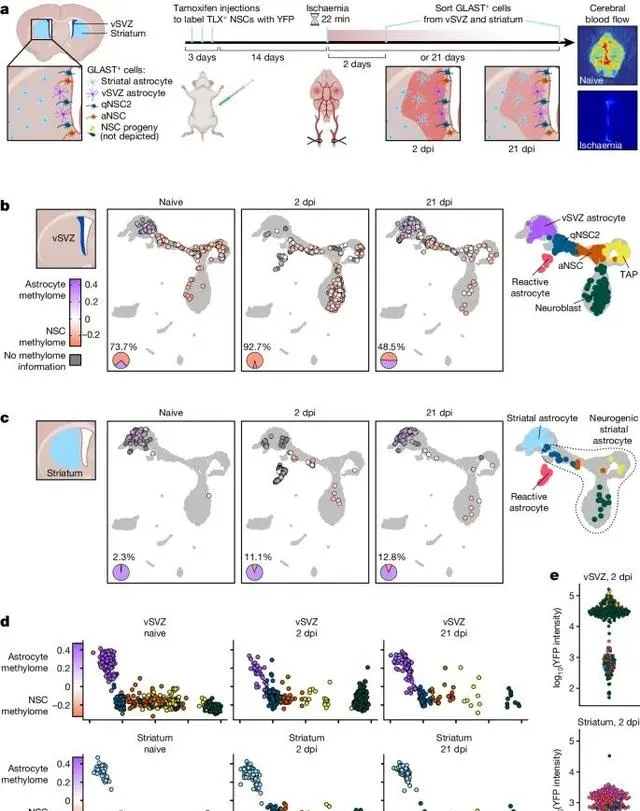
缺血性损伤能够在纹状体星形胶质细胞中诱导出类似神经干细胞的DNA甲基化组,促使这些细胞获得神经生成的能力 (Credit: Nature )
缺血性损伤后的DNA甲基化变化: 图a展示了在缺血性损伤后,纹状体星形胶质细胞的DNA甲基化模式发生显著变化,逐渐趋向于神经干细胞特有的甲基化组。这表明,缺血性损伤能够激活纹状体星形胶质细胞的可塑性,使其具备类似神经干细胞的潜力。
伪时序分析揭示星形胶质细胞向神经干细胞的转变: 图b通过伪时序分析(pseudotime analysis)展示了缺血损伤诱导下星形胶质细胞的逐步转变过程。该图显示,随着伪时序的推进,星形胶质细胞的表观遗传特征逐渐向神经干细胞靠拢,标志着其获得了干性特征。
神经干细胞相关基因的去甲基化: 图c展示了在缺血性损伤后,纹状体星形胶质细胞中的神经生成相关基因(如Ascl1、Dlx2)的去甲基化水平显著升高。这些基因的去甲基化与其表达的上调一致,说明DNA去甲基化在神经生成过程中起到了至关重要的作用。
DNMT3A在损伤修复中的作用: 图d探讨了甲基转移酶DNMT3A在这一过程中扮演的关键角色。研究发现,缺乏DNMT3A的纹状体星形胶质细胞在缺血性损伤后未能有效激活神经干细胞特征的DNA去甲基化,这表明DNMT3A是损伤诱导神经干细胞表观遗传变化的必要条件。
DNA甲基化的动态变化: 图e展示了不同基因在损伤后DNA甲基化的动态变化,神经生成相关基因的甲基化水平在缺血后明显降低,而与星形胶质细胞功能相关的基因仍然维持较高的甲基化状态,进一步证明了DNA甲基化在细胞命运决定中的重要调控作用。
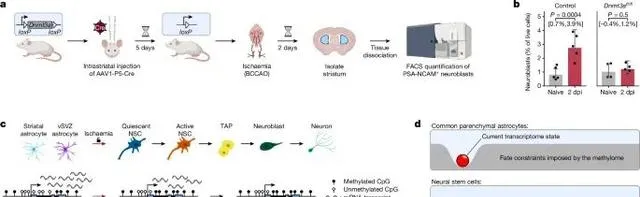
在Dnmt3a缺失的小鼠中,尽管发生了缺血性损伤,神经生成过程未能启动 (Credit: Nature )
DNMT3A缺失对神经生成的影响: 图a展示了在野生型(WT)小鼠和Dnmt3a缺失小鼠中,缺血性损伤后神经生成的情况。研究发现,在野生型小鼠中,缺血性损伤能够有效诱导纹状体星形胶质细胞转变为神经母细胞(neuroblasts)并最终生成神经元。然而,在Dnmt3a缺失的小鼠中,这一过程被显著抑制,显示出DNMT3A的缺失阻碍了神经生成的发生。
神经母细胞和神经元标记物的表达: 图b通过免疫染色分析了神经母细胞标记物(如DCX)和神经元标记物(如NeuN)的表达水平。结果显示,在野生型小鼠中,这些标记物在缺血损伤后显著增加,表明有更多的神经母细胞和新生神经元生成;而在Dnmt3a缺失小鼠中,这些标记物的表达几乎没有增加,进一步支持了神经生成未能有效发生的结论。
细胞谱系的变化分析: 图c通过细胞谱系追踪分析(lineage tracing)展示了缺血损伤后不同细胞类型的变化。在野生型小鼠中,纹状体星形胶质细胞逐步转变为神经干细胞,并进一步分化为神经母细胞和神经元;但在Dnmt3a缺失小鼠中,这种细胞命运转变显著受阻,星形胶质细胞未能成功激活神经干细胞谱系。
损伤修复中的DNA甲基化作用: 图d分析了DNMT3A在DNA甲基化调控中的作用,结果显示,DNMT3A缺失阻止了与神经生成相关基因的去甲基化,特别是在缺血损伤后,这些基因未能通过DNA去甲基化激活。因此,Dnmt3a缺失小鼠中的神经生成通路被抑制。
这些发现揭示了DNA甲基化在调控星形胶质细胞干性中的核心作用。研究表明,DNA甲基化不仅决定了细胞的当前命运,还可能成为未来细胞命运的「蓝图」,在特定条件下可以通过表观遗传重塑来实现细胞命运的改变。
此外,这一过程的发现为再生医学提供了新的方向。通过调控DNA甲基化,可以在疾病或损伤后激活星形胶质细胞的神经生成能力,从而促进神经再生。这为中风、神经退行性疾病等患者提供了潜在的治疗策略。
尽管研究表明DNA甲基化在星形胶质细胞干性获得中的重要作用,但仍有一些问题值得进一步探讨。例如,DNA甲基化是如何在分子水平上驱动神经干细胞的激活?是否可以通过药物或基因编辑技术干预这一过程,从而提高治疗效果?
未来的研究可以通过使用如dCas9的表观遗传编辑工具来靶向特定基因区域,测试是否可以通过直接调控DNA甲基化来影响细胞的命运转换。这种方法不仅可以用于治疗脑损伤,还可以用于癌症治疗,通过控制星形胶质细胞的命运选择来影响肿瘤的发展。
该研究通过单细胞多组学技术揭示了DNA甲基化在星形胶质细胞向神经干细胞转化中的核心作用。研究表明,DNA甲基化通过调控与神经生成相关基因的表达,决定了细胞的命运转换,并且这一过程在损伤修复中至关重要。未来的研究可以进一步探索如何通过调控DNA甲基化来促进神经再生,为再生医学和神经疾病治疗提供新的方向。
参考文献
Kremer LPM, Cerrizuela S, El-Sammak H, Al Shukairi ME, Ellinger T, Straub J, Korkmaz A, Volk K, Brunken J, Kleber S, Anders S, Martin-Villalba A. DNA methylation controls stemness of astrocytes in health and ischaemia. Nature. 2024 Sep 4. doi: 10.1038/s41586-024-07898-9. Epub ahead of print. PMID: 39232166.
https://www.nature.com/articles/s41586-024-07898-9
责编 |探索君
排版|探索君
转载请注明来源于 【生物探索】
End











