编译:微科盟 月亮鱼,编辑:微科盟 景行、江舜尧。
微科盟原创微文,欢迎转发转载,转载请注明来源于【转录组】公众号。
导读
钙依赖性蛋白激酶(calcium -dependent protein kinase,CPKs)是植物中最具代表性的钙传感器,它参与调节植物生长发育及植物对生物和非生物胁迫的适应机制等多个方面。然而,CPKs如何调节抗氧化防御系统在很大程度上仍然未知。研究者前期实验结果表明, OsCPK12的功能受损会导致水稻氧化胁迫,产生更多的pO2、降低过氧化氢酶(CAT)活性并降低产量。因此,本研究探讨了OsCPK12在水稻氧化耐受性中的作用 。 研究结果表明,OsCPK12与OsCATA和OsCATC的Ser11之间相互作用并磷酸化。敲除 OsCATA 或 OsCATC 都会导致氧化应激,并伴有更高的pO2积累。在 oscpk12-cr 品系中过表达模拟磷酸化的OsCATAS11D和OsCATCS11D降低了pO2的积累水平。此外,OsCATAS11D和OsCATCS11D在体内和体外均显示出CAT活性增强。过表达 OsCPK12 的植株表现出更高的CAT活性以及对氧化胁迫的更高耐受性。综上所述,本研究结果表明,OsCPK12通过磷酸化OsCATA和OsCATC的Ser11位点来影响CAT酶的活性,从而调节pO2的稳态,并介导水稻的氧化耐受机制。
论文ID
原名: OsCPK12 phosphorylates OsCATA and OsCATC to regulate pO2 homeostasis and improve oxidative tolerance in rice
译名: OsCPK12通过磷酸化OsCATA和OsCATC调控pO2稳态从而提高水稻的氧化耐受性
期刊: Plant Communications
IF: 10.5
发表时间: 2023年12月
通讯作者: 曹立勇,刘群恩,程式华
通讯作者单位: 中国水稻研究所
DOI号: 10.1016/j.xplc.2023.100780
实验设计
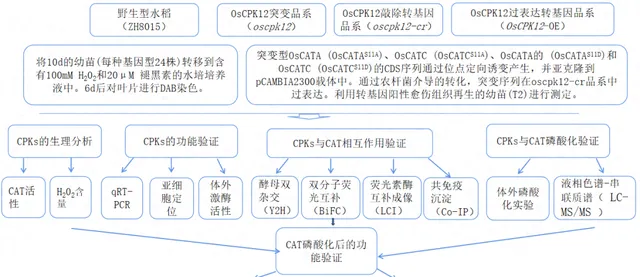
结果
1 OsCPK12 过表达增加了水稻中CAT活性,降低pO2的积累
钙依赖性蛋白激酶(CPKs)在植物的生长发育以及应对生物和非生物胁迫中起着重要的作用。 为了探究水稻中OsCPK12的生物功能,研究人员将中恢8015(ZH8015)品系经甲烷磺酸乙酯(EMS)诱变处理后的突变系群体中鉴定出 oscpk12 突变品系。 此前,课题组此前研究表明oscpk12功能受损导致水稻早衰。 研究者比较了不同阶段ZH8015野生水稻和 oscpk12 突变品系中CAT活性及p02含量 ,结果表明在20天幼苗期,野生品系ZH8015水稻和突变品系叶片中p02含量并无显著差异,然而在 40天之后, oscpk12 突变品系中p02含量显著高于野生品系ZH8015 (图S1A)。 在不同发育阶段 oscpk12 突变品系中CAT活性低于野生品系ZH8015水稻。为了进一步探究 OsCPK12 在水稻中的功能特性,研究者进一步比较了四种水稻品系(野生品系ZH8015, oscpk12 突变品系, OsCPK12-OE 过表达品系, oscpk12-cr 敲除品系)中CAT活性和p02水平 。在抽穗期,在 oscpk12 突变品系和 oscpk12-cr 敲除品系水稻叶中p02水平较高,而CAT活性较低(图1A)。相比之下, OsCPK12-OE 过表达品系表现出CAT活性显著升高和p02积累显著降低(图1B)。 上述结果表明过表达 OsCPK12 可以提高水稻中CAT活性并降低p02的积累。

图1. ZH8015、oscpk12、oscpk12-cr和OsCPK12-OE品系的p02含量和CAT活性,OsCPK12和截断OsCPK12的蛋白特性。 (A) 测定ZH8015、 oscpk12 、 oscpk12-cr 和 OsCPK12-OE 品系叶片中pO2的含量。 数据以mean±SD (n=6)表示。条形上方不同的字母表示显著性 ( P <0.05)。 采用单因素方差分析确定 P 值 并通过Tukey的多重比较。 (B) 测定了ZH8015、 oscpk12 、 oscpk12-cr 和 OsCPK12-OE 品系叶片中CAT的酶活性。数据以mean±SD (n=6)表示。条形上方不同的字母表示显著性 ( P <0.05)。 采用单因素方差分析确定 P 值 并通过Tukey的多重比较。(C)全长OsCPK12的激酶活性。纯化了重组OsCPK12蛋白,在不含(2 mM EGTA)或存在0.5 mM 钙离子的情况下,使用syntide 2作为底物测定了体外激酶活性。变性OsCPK12的活性作为阴性对照。用GloMax®-Multi检测系统测定发光值(相对光单位,RLU)。发光信号与存在的ATP量相关,与激酶活性的量呈负相关。ATP消耗量与激酶活性呈正相关。数据以mean+SD (n=3)表示。(D)截断的OsCPK12的激酶活性。纯化了重组截断的OsCPK12蛋白,在不存在(2 mM EGTA)或存在0.5 mM 钙离子的情况下,使用syntide 2作为底物测定了体外激酶活性。将变性截断的OSCPK12作为阴性对照。用GloMax®-Multi检测系统测定发光值(相对光单位,RLU)。发光信号与存在的ATP量相关,与激酶活性的量呈负相关。ATP消耗量与激酶活性呈正相关。(E)测定OsCPK12对syntide 2的K m值。RLU值代表样品相对于对照的减少,其与激酶活性成正比。数据以mean+SD (n=3)表示。(F)在有或没有钙离子的情况下,OsCPK12在30分钟内的自磷酸化。变性的OsCPK12作为阴性对照。免疫印迹检测的蛋白磷酸化经过Phos-Tag SDS-PAGE(上)后用 anti-GST抗体 探针检测(上),用标准SDS-PAGE凝胶(下)染色考马斯亮蓝(CBB)表示蛋白负载。
2 OsCPK12的表达、亚细胞定位和蛋白特性
已有研究表明, OsCPK12 在所有器官中均能表达,但是绿色组织如叶片,茎和鞘等器官中表达量高。 为了探究OsCPK12在水稻整个生殖生长阶段的转录水平,研究者通过qRT-PCR分析了野生品系水稻ZH8015和 oscpk12 突变品系水稻不同发育阶段中叶片的 OsCPK12 表达情况。 在播种后的20天 OsCPK12 表达水平较高,而在播种后的30天后下降(图S1C)。在 oscpk12 突变品系中 OsCPK12 基因表达水平显著变低,且在不同发育阶段, oscpk12 突变品系中OsCPK12基因表达水平的变化趋势与野生品系ZH8015品系水稻大致相同(图S1C)。 这些结果表明 OsCPK12 在水稻整个生长阶段均能表达,但在播种后20天的表达水平最高。
CPKs由位于n端的V结构域、丝氨酸/苏氨酸蛋白激酶的K结构域、自抑制连接的L结构域和包含4个EF-手型基序的R结构域组成。 为了验证OsCPK12的亚细胞定位及其不同的结构域,研究者首先由CaMV35S启动子驱动将 OsCPK12 的全长编码序列(CDS)融合到绿色荧光蛋白(GFP)的N端,在水稻原生质体中瞬时表达。结果显示,在整个细胞中均能检测到GFP信号,且其能与mCherry(红色荧光蛋白变种)信号完美融合(图S2A-S2C)。OsCPK12全长序列的GFP信号也与细胞核标记蛋白Ghd7-mCherry (图S2D-S2E),膜标记蛋白Lazy1-mCherry(图S2F,S2G)内质网标记蛋白mCherry-HDEL(图S2H)融合。
N-豆蔻酰化是蛋白质中的一种酰化过程,仅在N-末端甘氨酸上发生。经NMT和Myristoylator两个在线网站预测发现OsCPK12可以在glycine2被豆蔻酰化,并参与膜靶向的共翻译修饰。在此基础上, 研究者进一步探究了具有预测肉豆蔻酰基化位点的n端截断V结构域的亚细胞定位情况。正如预期的那样,OsCPK12-V-GFP的GFP信号仅分布在膜内(图S2I和S2J)。为了验证OsCPK12的V结构域是否为全长OsCPK12的细胞膜定位所必需,研究者将N端截断OsCPK12的 V结构域和K结构域与GFP融合,此外将OsCPK12的K结构域单独与GFP融合,形成OsCPK12-V/K-GFP和OsCPK12-K-GFP 。研究者发现OsCPK12- v/K-GFP和OsCPK12-K-GFP中的GFP信号与全长OsCPK12中结果相似(图S2K和S2L,图S2M和S2N)。 上述结果表明,OsCPK12定位于细胞膜、细胞质和细胞核中,且OsCPK12的N端V结构域足以实现其膜定位。
为了验证OsCPK12是否为功能性蛋白激酶,研究者对其进行了体外酶活性测定。 此前有相关研究表明,通过故意去除CPKs的L结构域和R结构域,钙离子依赖性可以从激酶活性中解耦联,并且通常可能导致CPKs不受钙离子的抑制。 研究者将缺失CAD结构域并融合谷胱甘肽s-转移酶(GST)的OsCPK12- v/K和OsCPK12全长进行表达、纯化和考马斯亮蓝(CBB)染色确认,然后用BCA蛋白测定试剂盒测定蛋白浓度,蛋白上清进一步进行体外激酶活性测定和自磷酸化测定 。 结果发现,ATP消耗量与激酶活性呈正相关。这一结果表明,OsCPK12-GST与2 mM EDTA孵育时,ATP消耗量比与0.5mM 钙离子孵育时低(图1C) ;这一发现与OsCPK12-V/K-GST的结果相一致(图1D)。 同时研究者们将OsCPK12对syntide 2的活性进行了分析。以syntide 2为底物,OsCPK12的km值为2.97 µM(图1E)。这一发现表明,OsCPK12和OsCPK12-v/K在添加Ca2+后激酶活性增强。
研究者还从1到30分钟的Phos-Tag凝胶中分离了用钙离子或2mM EGTA孵育的OsCPK12蛋白,以检测OsCPK12是否自动磷酸化。研究者发现磷酸化带随着反应时间的延长而变粗(图1F),表明OsCPK12在体外具有自磷酸化活性。当OsCPK12与2 mM EGTA孵育时,研究者也检测到一个磷酸化带(图1F)。因此,无论有没有钙离子的情况下OsCPK12均可以在体外自动磷酸化 。
3 在体外和体内OsCPK12与OsCATA、OsCATB和OsCATC相互作用
为了探究过表达 OsCPK12 提高水稻抗氧化能力的分子机制,研究者利用酵母双杂交(Y2H)实验筛选了OsCPK12相互作用蛋白 。研究者将OsCPK12-V/K融合到诱饵载体(BD)的Gal4DNA结合域,分离出几个相互作用克隆,并鉴定出与CAT结构域蛋白相对应的克隆(OsCATC)。 OsCATC 是水稻CAT家族的三个基因之一( OsCATA、OsCATB 和 OsCATC )。因此,将全长 OsCATA、OsCATB 和 OsCATC 引入酵母双杂交猎物载体(AD-O)的Gal4激活域OsCATC)。 酵母双杂交实验的结果表明,OsCPK12与所有三种CATs相互作用,而OsCPK12-K仅含有激酶结构域就足以进行这种相互作用(图2)。
为了进一步确认OsCPK12和OsCATs之间的相互作用,研究者进行了双分子荧光互补(BiFC)实验。 首先, 研究者分析了CATs的亚细胞定位 。有研究表明,OsCATA主要位于细胞质中,OsCATB和OsCATC则主要位于过氧化物酶体中。与前人研究结果一致, 本研究结果显示,OsCATA主要定位于细胞质中(图S3A和S3D), OsCATB和OsCATC主要定位于过氧化物酶体中(图S3B和S3E)。 然而,OsCATA-GFP、OsCATB-GFP和OsCATC-GFP融合蛋白也表现出明确的细胞核定位(图S3G-S3I),并且在水稻原生质体和本氏烟草中瞬时表达时均表现出微弱但清晰的质膜定位(图S3J-S3L)。 为了进一步验证OsCATA、OsCATB和OsCATC的亚细胞定位,研究者将GFP融合到它们的N端,得到GFP- OsCATA、GFP- OsCATB和GFP-OsCATC融合蛋白。 这些融合蛋白与OsCATA-GFP、OsCATB-GFP和OsCATC-GFP具有相同的荧光信号结果(图S3M-S3O)。
为了检测OsCATs的核定位,研究者利用从ZH8015瞬时转化的OsCATA-GFP、OsCATB-GFP和OsCATC-GFP的原生质体中提取的总蛋白和核蛋白进行了免疫印迹分析。OsCATA-GFP、OsCATB-GFP和OsCATC-GFP蛋白均存在于总蛋白和核蛋白中,证实了OsCATs的核定位(图S4)。双分子荧光互补实验分析显示,共表达OsCPK12-HYCE和OsCATs-HYNE的细胞中存在强烈的黄色荧光蛋白(YFP)信号,这些信号与Lazy1-mCherry信号完美融合。而在相同条件下,共表达的OsCPK12-HYCE 和 GST-HYNE细胞中未检测到信号,这表明OsCPK12与CATs有特异性相互作用,且OsCPK12/CAT复合物定位于质膜(图2B和2C图S5A和S5B)。 先前的研究报道了大多数CPKs主要或部分是膜锚定的。膜结合主要与预测的N端肉豆蔻酰化位点或一些额外的可逆过程有关,如棕榈酰化、蛋白质相互作用和磷酸化调节的多碱结构域。 因此,研究者预测OsCPK12可能靶向膜参与应激刺激的信号转导。
接下来,研究者进行荧光素酶互补成像(LCI)实验。结果表明,共表达CATs-NLuc和CLuc-OsCPK12在本氏烟草叶片表现出较强的荧光性,CATA-NLuc和CLuc-OsCPK12的荧光素酶相对活性接近30000,CATB-NLuc和CLuc-OsCPK12l的荧光素酶相对活性为80000,CATC-NLuc和CLuc-OsCPK12共表达细胞荧光素酶相对活性为40000。 相比之下,对照组的共表达仅显示LUC活性的背景水平(图2D和2E,图2F和2G图S5C和S5D)。 由于在随后的工作中发现OsCATA和OsCATC被OsCPK12磷酸化(图S6),研究者通过共免疫沉淀(Co-IP)实验进一步证实了OsCPK12与OsCATA和OsCATC之间的相互作用。 结果显示,OsCATA-GFP和OsCATC-GFP融合蛋白与OsCPK12-Myc共免疫沉淀,但不与OsCPK12-L/R-Myc共免疫沉淀(图2H)。 研究者还使用OsCPK12-Myc与OsCPK12-Myc OsCATC-Ha、OsCATC-Ha和CLuc-Ha、OsCATC-Ha和OsCATC-Ha融合蛋白进行共免疫沉淀,但结果表明OsCPK12-Myc不能共免疫沉淀CLuc-Ha (图S5E)。同时,将纯化的重组His-TF-OsCPK12和GST/OsCATA-GST/OsCATC-GST进行下拉实验。 正如预期一样,His-TF-OsCPK12拉低了OsCATA-GST和OsCATC-GST,但GST没有被拉低 (图2I)。 综上所述,这些结果表明OsCPK12与OsCATs相互作用。
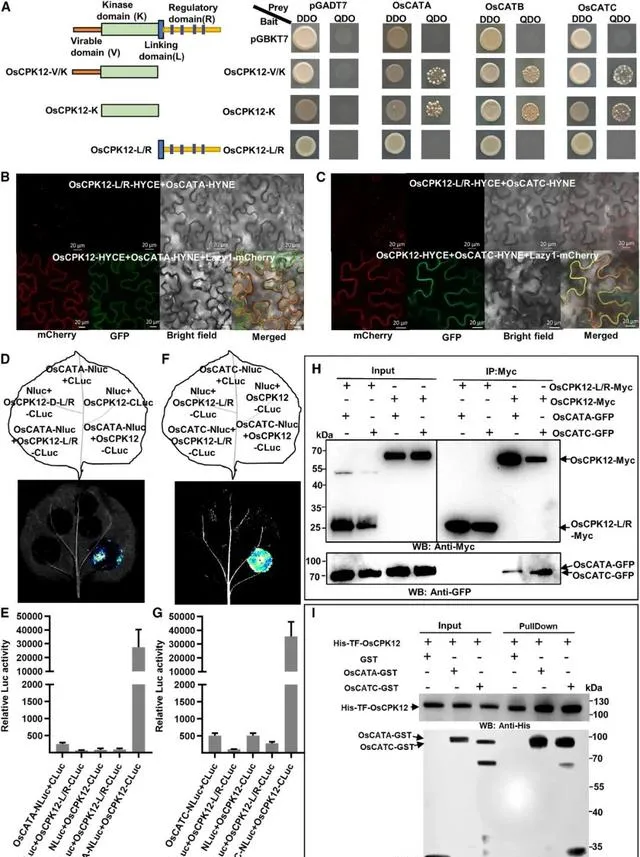
图2. OsCPK12与OsCATA和OsCATC交互作用。 (A) OsCPK12与OsCATA和OsCATC相互作用的酵母双杂交实验。(B-C)双分子荧光互补(BiFC)实验表明,OsCPK12与OsCATA和OsCATC之间有相互作用,通过农业渗透法在本氏烟中短暂表达上述结构体,浸润4 d后使用激光扫描共聚焦显微镜(ZEISS 750)观察荧光。以OsCPK12-L/R-HYCE为阴性对照。Lazy1-mCherry作为细胞膜标记物。(D) LCI实验验证OsCPK12与OsCATA之间的相互作用。OsCPK12-CLuc和NLuc-OsCATA在烟叶共渗中瞬间表达。NLuc和CLuc为阴性对照。在2 DAI时,用低光、冷却的CCD成像仪监测发光。(E) 叶片中LUC活性的量化如图(D)所示。数据以mean+SD (n=3)表示。(F)荧光素酶互补成像实验表明,OsCPK12与OsCATC之间具有相互作用。OsCPK12-CLuc和NLuc-OsCATC通过共浸润在本氏烟中瞬间表达。NLuc和CLuc为阴性对照。在2 DAI时,用低光、冷却的CCD成像仪监测发光。(G) F所示叶片中LUC活性的量化。数据以mean+SD(n=3)表示。(H) OsCPK12与OsCATA和OsCATC相互作用的共免疫沉淀测定。用 anti-Myc 琼脂糖珠免疫沉淀转染OsCPK12-Myc/OsCPK12-L/R-Myc、OsCATA-GFP和OsCATC-GFP的水稻原生质体总蛋白提取物。用 anti-GFP 和 anti-Myc 抗体检测粗裂解物(左,输入)和免疫沉淀蛋白(右)的蛋白质。(D) OsCPK12与OsCATA和OsCATC相互作用的拉下实验。从大肠杆菌中表达His-TF- OsCPK12、OsCATA-GST、OsCATC-GST和GST,并进行His下拉实验。GST作为对照。清洗后的His树脂用 anti-GST 和 anti-His 抗体免疫印迹法分别检测固定化蛋白和拉下蛋白。用指定抗体免疫印迹法检测输入蛋白。
4 OsCPK12磷酸化OsCATA和OsCATC
为了检测OsCPK12是否能磷酸化水稻原生质体中的CATs,研究者进行了体内磷酸化实验。 如图S6所示,Phos-Tag免疫印迹实验在ZH8015中检测到OsCATC-myc和OsCATC-myc的较高条带。而OsCATB-myc并没有磷酸化差异。 这些结果表明,OsCPK12可以在体内磷酸化OsCATA和OsCATC。为了进一步研究OsCATA和OsCATC是否可以被OsCPK12磷酸化,研究者使用重组OsCATA-GST、OsCATC-GST和His-TF-OsCPK12或His-TF-OsCPK12(变性His-TF-OsCPK12)进行了体外磷酸化实验 。如图3A和3B所示,当OsCATA-GST和OsCATC-GST与His-TF-OsCPK12孵育时,Phos-Tag免疫印迹上检测到两条条带,随着反应时间的延长,高迁移率的条带变粗。然而,当OsCATA-GST和OsCATC-GST与变性的OsCPK12孵育时,没有出现差异条带(图S7A), 这表明OsCATA-GST和OsCATC-GST在OsCPK12存在下可以被体外磷酸化。为了更好地区分磷酸化和非磷酸化的条带,研究者还使用截断的OsCATA(1-403 aa)( OsCATA-N-GST)、OsCATC(1-403 aa)( OsCATC-N-GST)、OsCATA(404-493 aa)( OsCATA-C-GST)和OsCATC(404-493 aa)( OsCATC-C-GST)进行体外磷酸化测定 。 研究者观察到OsCPK12可以磷酸化OsCATA-N-GST和OsCATC-N-GST(图S7C和S7D),但不磷酸化OsCATA-C-GST和OsCATC-C-GST(图S7E和S7F);OsCATA-N-GST和OsCATC-N-GST不被His-TF-OsCPK12-Dead磷酸化(图S7B)。上述结果表明,OsCATA和OsCATC是OsCPK12的候选底物,OsCPK12可以磷酸化OsCATA和OsCATC的N端。
为了确定OsCATA和OsCATC的磷酸化位点,研究者从含有磷酸化的OsCATA和OsCATC的凝胶(GST-OsCATA和GST-OsCATC经His-TF-OsCPK12孵育)和OsCATA-CK和OsCATC-CK (OsCATA-GST和OsCATC-GST经His-TF孵育)中剪切条带,从条带中提取蛋白质,并使用液相色谱-串联质谱(LC-MS/MS)搜索其磷酸化位点 。 最终,研究者在His-TF-OsCPK12孵育的OsCATC样品中检测到7个磷酸化位点(Ser10、Ser11、Ser104、Thr105、Ser164、Thr105和Ser437),在His-TF-OsCPK12孵育的OsCATC样品中检测到10个磷酸化位点(Ser9、Ser10、Ser11、Ser18、Thr19、Ser21、Ser347、Thr351、Thr412和Thr414) ,但在His-TF孵育的OsCATA-CK和OsCATC-CK样品中未检测到磷酸化位点(补充表1)。 研究结果表明,OsCPK12可以磷酸化OsCATA和OsCATC的N端,其中OsCATA和OsCATC分别有6个(Ser10、Ser11、Ser104、Thr105、Ser164和Thr351)和8个(Ser9、Ser10、Ser11、Ser18、Thr19、Ser21、Ser347和Thr351)可能的磷酸化位点。
为了验证OsCATA和OsCATC的特异性磷酸化位点,研究者用Ala(A)代替了这些Ser(S)和Thr(T)残基来模拟非磷酸化 。 体外磷酸化实验结果显示,OsCATA-NS10A-GST、OsCATA-NS104AS105A-GST、OsCATA-NS164A-GST和OsCATA-NT351A-GST具有与OsCPK12介导的OsCATA-N相似的明显的磷酸化条带(图3C)。但在OsCATA-NS10A/S11A-GST和OsCATA-NS11A-GST中未检测到磷酸化带 。 因此,OsCATA的11号丝氨酸位点是OsCPK12识别的主要磷酸化残基 。 OsCATC和OsCPK12之间的体外磷酸化实验显示,OsCATC-NS9A/S10A/S11A/S18A/T19A/S21A-GST、OsCATC-NS9AS10AS11A-GST或OsCATC- NS11A-GST几乎没有磷酸化 ; 其他单点突变蛋白OsCATC-NS18A/TI9A/S21A-GST、OsCATC-NS9A/S10A-GST、OsCATC-NS347A-GST和OsCATC-NT351A-GST也表现出类似的OsCPK12介导的磷酸化(图3D )。 这些结果表明,OsCATC的11号丝氨酸位点是OsCPK12的主要磷酸化位点,OsCPK12可能磷酸化OsCATA和OsCATC的11号丝氨酸位点。

图3 . OsCPK12在体外磷酸化OsCATA和OsCATC的丝氨酸11位点。 (A)OsCPK12在体外磷酸化OsCATA。考马斯亮蓝(CBB)染色检测输入蛋白OsCATA和OsCPK12。磷酸化活性通过Phos-Tag SDS-PAGE免疫印迹分析检测。(B)OsCPK12体外磷酸化OsCATC。CBB染色检测输入蛋白OsCATC和OsCPK12。磷酸化活性通过Phos-Tag SDS-PAGE免疫印迹分析检测。(C)OsCPK12在体外磷酸化OsCATA的Ser11。在Phos-Tag SDS-PAGE后用抗gst探针检测蛋白磷酸化(上),在标准SDS-PAGE凝胶中用CBB染色显示蛋白负载(下)。(D)OsCPK12在体外磷酸化OsCATC的Ser11位点。Phos-Tag SDS-PAGE后用抗gst探针的免疫印迹检测蛋白磷酸化(上),用标准SDS-PAGE凝胶染色CBB表示蛋白负载(下)。
5 敲除OsCATA和OsCATC导致CAT活性降低和pO2的累积
研究者利用CRISPR-Cas9技术在ZH8015水稻品系背景下构建了多种 OsCATA ( oscata - cr )和 OsCATC ( oscatc - cr )敲除品系,并研究它们在水稻中的功能 。 研究者总共生成了三个独立的 oscatc-cr 品系和两个独立的 oscatc-cr 品系(图4A和图4B)。从三叶期(图S8A和S8B,图S8D和S8E)到成熟期(图4A),所有 oscatc-cr 品系和oscatc-cr品系都表现出明显的叶片白化和细胞死亡表型。 noel 是OsCATC的一个功能缺失突变,也表现出pO2过度积累并导致叶片细胞死亡。
与野生型ZH8015品系相比, oscata-cr 品系和 oscatc-cr 品系水稻植株高度明显降低(图4C) 。 oscatc-cr品系和oscatc-cr品系的单株有效穗数显著低于野生型(图4D)。 oscata-cr 品系和 oscatc-cr 品系结实率显著降低,为20.20-30.49%,仅为野生型ZH8015品系的1/4(图4E) 。 oscata-cr 和 oscatc-cr 品系水稻千粒重显著低于ZH8015(图4F)。研究者还测定了抽穗期 oscata-cr 和 oscatc-cr 品系植株叶片pO2含量和CAT活性。结果发现 oscata-cr 和 oscatc-cr 植株品系叶片中pO2含量也显著积累(图4G),CAT活性低于ZH8015(图4H) ,与 noel 表型一致。 过氧化物酶DAB法染色结果显示,幼苗期 oscata-cr 品系和 oscatc-cr 品系叶片中pO2积累量较高(图S8C和S8F)。上述结果表明,敲除OsCATA和OsCATC会导致水稻体内pO2积累,降低CAT酶活性,严重影响水稻的生长发育,最终导致水稻产量显著下降。
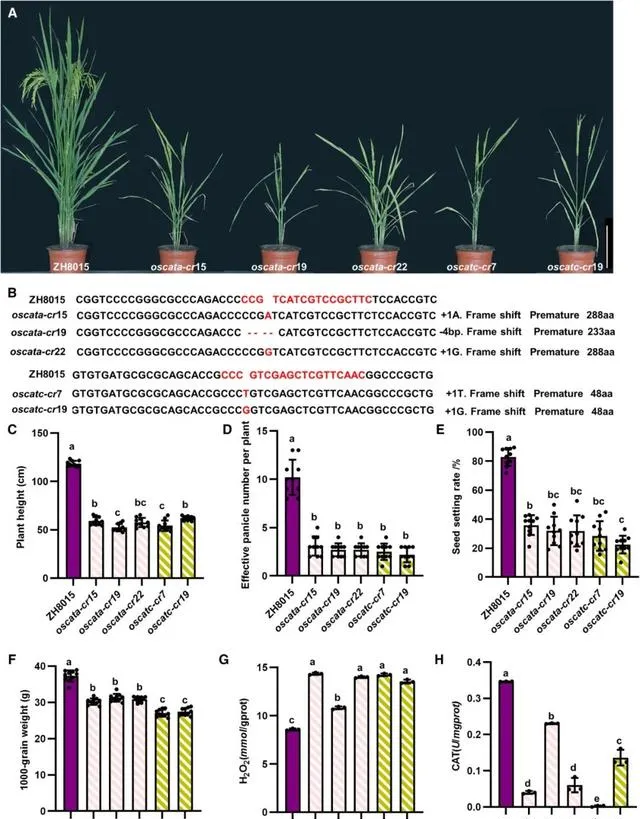
图4. oscatc-cr 和 oscatc-cr 品系的表型。 (A) oscata-cr 和 oscatc-cr 品系的表型(Bar=20 cm)。 (B) oscata-cr 和 oscatc-cr 品系的基因型。(C) ZH8015、 oscata-cr 和 oscatc-cr 品系植株高度。(D) ZH8015、 oscata-cr 和 oscatc-cr 品系的单株有效穗数(E) ZH8015、 oscata-cr 和 oscatc-cr 品系的结实率(F) ZH8015、 oscata-cr 和 oscatc-cr 品系的千粒重。(C,D,E和F)数据以mean+SD (n 10)表示。柱形以上不同字母表示差异显著( P <0.05)。P值的确定和分析采用单因素方差分析,然后采用Tukey多重比较。(G) ZH8015、 oscata-cr 和 oscatc-cr 品系植株叶片中H 2O 2含量(H) ZH8015、 oscata-cr 和 oscatc-cr 品系植株叶片中CAT活性。(G和H)数据以mean+SD(n=3)表示。柱形以上不同字母表示差异显著( P <0.05)。P值的测定和分析采用单因素方差分析,然后采用Tukey多重比较。
6 OsCATA和OsCATC的磷酸化可提高它们的活性
为了研究OsCATA和OsCATC的11号丝氨酸位点磷酸化在植物中的意义,研究者将OsCATA和OsCATC的11号丝氨酸位点残基突变为Ala(A)和Asp(D),分别模拟非磷酸化蛋白(OsCATAS11A和OsCATCS11A)和磷酸化蛋白(OsCATAS11D和OsCATCS11D) 。 OsCATAS11A、OsCATCS11A、OsCATAS11D 和 OsCATCS11D 在 oscpk12-cr 品系中过表达,分别产生 OsCATAS11A -OE、 OsCATCS11A -OE、 OsCATAS11D -OE和 OsCATCS11D -OE( 图5A和5B)。研究者还测定了正常生长条件下过表达植株和 oscpk12-cr 植株的CAT活性和pO2浓度。 与 OsCATAS11 A-OE植株相比, oscpk12-cr / OsCATAS11D -OE和 oscpk12-cr / OsCATCS11D -OE植株的CAT活性显著增强,且过表达转基因植株叶片中pO2积累量较低(图5C-5F)。然而, oscpk12-cr / OsCATAS11A -OE和 oscpk12-cr / OsCATCS11A -OE的CAT活性和pO2浓度与 oscpk12-cr 植株相似(图5C-5F)。上述结果表明, OsCATAS11D -OE和 OsCATCS11D -OE能在一定程度上挽救 oscpk12-cr 植株的CAT活性,而 OsCATAS11 A-OE和 OsCATCS11A -OE不能。总之,这些结果表明, OsCATAS11D 和 OsCATCS11D 在植物中表现出更高的CAT活性。
为了证明OsCPK12磷酸化OsCATA和OsCATC确实可以增加过氧化氢酶活性,研究者还使用纯化的OsCATA、OsCATAS11A、OsCATAS11D、OsCATC、OsCATCS11A和OsCATCS11D进行了CAT活性体外测定 (图S9)。 结果显示,OsCATAS11D和OsCATCS11D的CAT活性高于野生型OsCATA和OsCATC、OsCATAS11A和OsCATCS11A(图5G)。并在OsCPK12存在的情况下,分析OsCATA和OsCATC的CAT活性。 正如预期的那样,OsCPK12显著增强了OsCATA和OsCATC的CAT活性(图5G)。OsCATB和OsCATC的蛋白质稳定性也会因其搭档的不同而发生变化。例如,APIP6促进OsCATC的降解,从而减弱OsCATC介导的pO2清除效率。水稻增强型病害易感性1(OsEDS1)与OsCATC相互作用,稳定OsCATC,提高OsCATC介导的pO2清除能力;半卷叶水稻10-SRL10可以稳定OsCATB,增强CAT活性,调节水稻叶片形态和耐热性。 因此,研究者推测CPK12也可能通过改变CAT的蛋白稳定性来改变CAT的活性。然而,与野生型ZH8015相比,突变型 oscpk12-cr 品系OsCATA和OsCATC的蛋白水平没有变化(图5H) 。研究者还观察到OsCATA和OsCATC在ZH8015和OsCPK12 -cr原生质体中的亚细胞定位是一致的, 这表明OsCPK12介导的磷酸化并不调节OsCATA和OsCATC的蛋白稳定性和亚细胞定位。上述结果表明,OsCPK12磷酸化OsCATA和OsCTAC的11号丝氨酸位点可增强它们的CAT活性。
图5. 在体内和体外OsCATA和OsCATC Ser11位点的磷酸化激活了它们的CAT活性 , 对ZH8015和 oscpk12-cr 品系得OsCATA和OsCATC进行免疫印迹分析。 (A) OsCATA 在过表达 OsCATAS11A 和 OsCATAS11D的oscpk12 - cr 品系 幼苗叶片(T2)中相对表达量。(B) OsCATC 在过表达 OsCATAS11A 和 OsCATAS11D的oscpk12 - cr 品系 幼苗叶片(T2)中相对表达量。 (C) oscpk12-cr 品系过表达 OsCATAS11A 和 OsCATAS11D 的转基因幼苗(T2)的H 2O 2含量,以ZH8015 (WT)和 oscpk12-cr 为对照。(D) oscpk12-cr 品系过表达 OsCATAS11A 和 OsCATAS11D 的转基因幼苗(T2) H 2O 2含量。(E)在 oscpk12-cr 品系过表达 OsCATAS11A 和 OsCATAS11D 的转基因幼苗(T2)的CAT活性。以ZH8015(WT)和 oscpk12-cr 幼苗为对照。(F) oscpk12-cr 品系过表达 OsCATAS11A 和 OsCATAS11D 的转基因幼苗(T2)的CAT活性。以ZH8015 (WT)和 oscpk12-cr 植株品系幼苗为对照。(G) OsCATA和OsCATC Ser11位点的磷酸化激活了它们在体外的CAT活性。OsCATA S11A-GST和OsCATC S11A-GST,重组OsCATA和OsCATC的Ser11的突变为Ala,OsCATA S11D-GST和OsCATC S11D-GST,重组OsCATA和OsCATC的Ser11突变为Asp。分别纯化OsCATA-GST、OsCATA S11A-GST、OsCATA S11D-GST、OsCATC-GST、OsCATC S11A-GST、OsCATC S11D-GST和His-TF-OsCPK12并测定体外CAT活性。(A-G)数据以mean+SD(n=3)表示。柱形以上不同字母表示差异显著( P <0.05)。p值的确定和分析采用单因素方差分析,然后采用Tukey多重比较。(H) ZH8015和 oscpk12-cr 植株品系OsCATA、OsCATC和Actin的免疫印迹分析。总蛋白分别从ZH8015和 oscpk12-cr 植株品系叶片中提取。用抗OsCATA、OsCATC和β-actin血清(Anti-OsCATA、Anti-OsCATA和Anti-Actin)进行印迹。上图数据为OsCATA/Actin与OsCATC/Actin蛋白强度之比。
7 OsCPK12正调控水稻的氧化耐受性
为了研究OsCPK12对氧化耐受性的响应机制,研究者将野生型、过表达的OsCPK12( OsCPK12-OE )转基因品系和敲除品系( oscpk12-cr )的三叶期幼苗分别用100 mM pO2或100 mM pO2和20uM褪黑激素进行处理。处理6d后,测定幼苗叶绿素含量、pO2含量和CAT活性 。在正常条件下, OsCPK12-OE 品系、转基因 oscpk12-cr 品系和野生型幼苗的生长无显著差异。但在pO2处理6d后, oscpk12-cr 品系出现了严重的黄变、卷叶和干燥(图6A),而ZH8015品系的叶片出现了褪绿、卷曲和干燥。 OsCPK12-OE 品系的叶片也出现了褪绿和卷曲的现象,但这两种效应都弱于ZH8015品系(图S10A和S10B)。
OsCPK12-OE 品系叶片中pO2的积累量较低,而 oscpk12-cr 品系叶片中pO2的积累量较高(图6B)。与ZH8015和 OsCPK12-OE 品系叶片相比, oscpk12-cr 品系叶片的CAT活性较低(图6C)。 这些结果表明,水稻中过表达 OsCPK12 可以提高氧化胁迫的耐受性。褪黑素对植物细胞的氧化还原平衡、减少活性氧以及调节生物和非生物胁迫耐受性至关重要。与100 mM pO2胁迫的水稻植株相比,添加20 µM褪黑素显著缓解了100 mM pO2胁迫引起的水稻叶片衰老表型,减少了叶片中pO2的积累(图6A和图6B)。DAB染色结果进一步测定了 oscpk12-cr 品系叶片中pO2的积累情况(图6D)。这些结果表明,水稻过表达 OsCPK12 可以提高其氧化胁迫的耐受性 。

图6. OsCPK12正向影响水稻的氧化耐受性。 10 d龄的幼苗移栽到添加了100 mM H 2O 2或100 mM H 2O 2和20 µ M褪黑素的培养基中6 d。(A) H 2O 2胁迫和H 2O 2褪黑素胁迫下水稻植株的表型比较。(B) H 2O 2胁迫和H 2O 2褪黑素胁迫下水稻植株叶片中H 2O 2含量。数据以mean+SD(n =3)表示。采用 Student’s t 检验,* P <0.05,** P <0.01。(C) H 2O 2胁迫和H 2O 2褪黑素胁迫下水稻叶片CAT活性变化。数据以mean+SD(n=3)表示。采用 Student’s t 检验,* P <0.05,** P <0.01。(D)未处理、H 2O 2处理和H 2O 2+褪黑素处理叶片中H 2O 2的DAB染色。
讨论
1 OsCPK12是一种弱Ca2+依赖性蛋白激酶,具有典型的豆蔻酰化位点,定位于膜、细胞质和细胞核中
OsCPK12参与多种信号通路,参与信号转导通路,参与低氮胁迫响应,参与调节叶片衰老,正调控植株耐盐性,负调控植株的抗旱性。 oscpk12 通常在播种后60天左右呈现叶片泛黄。 CAT活性和pO2水平在播种后40天和40天后的ZH8015和 oscpk12 品系植株之间存在显著差异(图S1A和S1B),而OsCPK12在播种后20天的表达水平较高(图S1C)。研究者推测,植物出现生理差异可能需要一个特定的时间。
CPKs是植物信号传导的关键因子,将钙信号传递到生理反应中,并表现出高度可变的钙依赖性。越来越多的CDPK酶已经被发现在其体外激酶活性中显示出较低或甚至不可检测到的钙离子依赖性变化,尽管CDPK家族具有保守模结构并能推导出钙离子依赖性CDPK激活模型。一些CPKs需要增加细胞质内的钙离子,而另一些则在基础[Ca2+]上活跃和/或可能包含退化的EF手型,这表明参与了磷酸化或结合伙伴等其他调节机制。 本研究表明,加入钙离子后,重组OsCPK12的激酶活性增强(图1C和1D)。 先前有研究表明,钙离子依赖性可以通过故意去除CAD结构域而与激酶活性解耦联,通常导致CPKs解除调控或不受抑制。然而,一些截断的变体例如TgCDPK1和OsCPK17完全失活,或者与钙激活的全长激酶相比活性降低。 在本研究中,OsCPK12- v/K(没有CAD结构域的OsCPK12)不是一个组成活性激酶 (图2A和2B)。 Km 值可用于确定底物与酶的亲和力,激酶的 Km 值常随底物的不同而变化。以syntide 2作为底物,OsCPK12的 Km 值为2.97 μM (图1E)。OsCPK12对OsCATA(1-40aa)肽和OsCATC(1-40aa)肽的 Km 值分别为57.99 uM和135.3 μM(图S11A和S11B), 说明OsCPK12对OsCATA(1-40aa)肽的反应速率更为敏感。
亚细胞定位对于CPK的功能也是必不可少的。CPKs表现出不同的亚细胞定位,包括细胞质、细胞核、质膜、内质网、过氧化物酶体、线粒体外膜和植物油体。 在本研究中,结果显示OsCPK12主要定位于质膜,但也定位于细胞质、细胞核和内质网(图S2A-S2G) 。Xing等发现OsCPK12仅位于细胞膜上。研究者本次实验的结果与Xing等人的结果不一致可能是由于OsCPK12-GFP蛋白表达水平的差异。 有研究认为N -豆蔻酰化位点可能与CPKs的膜结合有关。拟南芥CPK4和CPK11缺乏任何酰化基序是可溶的,而其他11个CPKs (CPK2、CPK5、CPK25、CPK3、CPK9、CPK7、CPK8、CPK10、CPK13、CPK30和CPK32)显示预测的肉豆蔻酰化位点,主要或部分与膜相关。NMT和Myristoylator在线网站预测OsCPK12可以在甘氨酸第2位点发生豆蔻酰化。 在本研究中,OsCPK12-V-GFP定位于质膜(图S2I和S2J)。 奇怪的是,OsCPK12- v /K和OsCPK12-K的亚细胞定位与全长OsCPK12相似。这可能是因为膜结合不仅与预测的N端豆蔻酰化位点有关,还与一些额外的可逆过程有关,如棕榈酰化、蛋白质相互作用和由磷酸化调节的多碱结构域。
CDPKs也可在应激刺激下易位。McCDPKI(Mesembryanthemum crystallinum CDPK1)在非胁迫细胞中主要与质膜相关,但在盐胁迫下,McCDPKI更多地定位于细胞核中与CSP1相互作用。AtCPK10/30/32转运到细胞核响应硝酸盐。ETI激活时,AtCPK5与TF WRKY8、28或48协同激活防御基因需要细胞质到细胞核的易位。缺氧时,AtCPK12在Ser-186残基处被迅速激活和磷酸化,磷酸化后的CPK12从细胞质穿梭到细胞核,磷酸化ERF-VII以增强其稳定性。 研究者们预测OsCPK12通过允许自身作为膜蛋白或相关膜靶蛋白的调节剂参与响应应激刺激的信号转导来靶向细胞膜。OsCPK12的功能是否受到不同定位模式的影响,需要通过基因互补实验进一步研究。
2 水稻CAT同工酶协同调节植株发育
植物过氧化氢酶分为三类。 AtCAT1 主要在植物生殖组织和种子中表达,而 AtCAT2 在光合组织中强烈表达, AtCAT3 在根和幼叶中有基本性表达。AtCATI、AtCAT2和AtCAT3分别属于III类、I类和II类。在水稻中,已经鉴定出三种 CAT 同源物: OsCATA、OsCATB 和 OsCATC 。 OsCATC 属于I类, OsCATA 属于II类, OsCATB 属于III类。
OsCATA在所有器官中均有表达,在叶片中表达量最高;OsCATB主要在根中表达;OsCATC主要在叶片中表达。 本研究结果显示,OsCATA和OsCATC在叶、茎和鞘等绿色组织中高表达(图S12A和图S12C),与OsCPK12的表达模式一致,而OsCATB在茎、根和穗中高表达 (图S12B)。CATs的功能不仅与其时空表达有关,还与其亚细胞定位有关。以往研究表明,OsCATA主要定位于细胞质,而OsCATB和OsCATC主要定位于过氧化物酶体。 研究者还在细胞核和细胞膜中检测到了OsCATA、OsCATB和OsCATC的GFP荧光信号 (图S2和补充图S3)。先前的研究表明,OsCATA、OsCATB和OsCATC与水稻膜上的STRKI相互作用。CAT3定位于拟南芥的过氧化物酶体、细胞质和细胞膜,并与细胞膜上的CPK8相互作用。 因此,CAT可以与细胞膜上的一些激酶相互作用并被激活。OsCATB-GFP也通过PM处的弱荧光信号被检测到, OsCATC被发现定位于间断的细胞隔室 。然而, 本研究结果不仅证实了OsCATs确实定位在细胞膜上,而且还表明OsCATA、OsCATB和OsCATC定位在细胞核中 。
不同的CAT同工酶可能协同参与植物的生长发育。对拟南芥叶片CAT同工酶谱分析表明,光呼吸主要与CAT2相关,CAT3波段也逐渐明显。此外,在拟南芥的生长和衰老过程中发现了一些杂交CAT全酶带,这表明拟南芥叶片中的CAT全酶不仅涉及CAT2,还涉及CAT3。CAT全酶为四聚体形式,分子量约为220 kD,主要由拟南芥叶片中的CAT2和CAT3编码。水稻CAT可能是水稻叶片中主要CAT酶的同源或异源复合物,主要来源于OsCATC低聚物。最近有相关研究还表明,OsCATA、OsCATB和OsCATC可能参与AvrPiz-t-ROD1-CATs-APIP6/RIP1分层调节免疫网络,这表明水稻过氧化氢酶可能作为同源或异源复合物发挥作用。 本研究结果表明,OsCATA、OsCATB和OsCATC以Serll磷酸化不依赖的方式相互作用,OsCATA和OsCATC的Serl1磷酸化缺失也不影响它们与OsCPK12的相互作用 (图S13和图S14)。
noel 是OsCATC的一个功能缺失突变,也表现出pO2过度积累会导致叶片细胞死亡。 在本研究结果中, oscata-cr 和 oscatc-cr 品系表现出相似的光呼吸缺陷表型(图4和图S8),而 oscatb-cr 品系植株没有表现出明显的早衰表型。 大量研究表明,CAT不仅是一种关键的pO2清除酶,而且在叶片形态中也起着重要作用。拟南芥CAT2突变由于生长素水平的变化导致叶片变暗。水稻中OsCATB功能的丧失导致旗叶反向卷曲。 因此,研究者推测O sCATB 主要参与水稻叶片形态的发育,而 OsCATA 和 OsCATC 可能直接参与水稻的光呼吸过程。
3 OsCPK12与OsCATA和OsCATC相互作用并磷酸化以调节体内过氧化氢平衡
pO2作为氧化还原信号的主要传递者,直接参与衰老等多种生物过程。植物体内pO2的浓度通常维持在较低水平,以避免细胞毒性作用。过氧化物酶体中的pO2浓度可低至10 μM,正常条件下水稻叶片中的pO2浓度约为253 μM。所需和适当的pO2水平由CAT、抗坏血酸过氧化物酶(APX)、谷胱甘肽过氧化物酶(GPX)和苯酚过氧化物酶控制。CAT是pO2的主要清除剂,将pO2降解为氧气和水,主要存在于过氧化物酶体中。CATs具有非常快的周转率,但与APX和过氧化物氧还蛋白(PRX)等酶相比,其对pO2的亲和力非常低。据报道,不同生物中pO2 CAT的表观 Km 值从38到600 mM不等。因此,植物需要机制来增强CAT对它们通常维持的低浓度pO2的更高清除效率。
大量研究表明,CAT的磷酸化可能导致活性增加,不同的磷酸化位点可能与不同的刺激有关。例如,内皮素-1通过蛋白激酶C (PKCS)介导的丝氨酸167号位点磷酸化刺激CAT活性。CPK8可以磷酸化CAT3的Ser261,调节拟南芥CAT的活性。STRKI通过磷酸化水稻中的Tyr210激活OsCatC。 在本研究中, OsCPK12- OE品系 植株叶片中的CAT活性高于ZH8015、oscpk12和oscpk12-cr品系植株(图1D)。OsCPK12主要在OsCATA和OsCATC的Ser11位点发生磷酸化。OsCATA/OsCATC的Ser11在OsCATB中不保守(图S12D), CATB中的氨基酸为Gly11。此外,过表达持续磷酸化的OsCATAS11D-OE和OsCATCS11D-OE可以提高 oscpk12-cr 品系植物的CAT活性,降低pO2含量,而未磷酸化的 Os CATA S11A -OE 和 OsCATCS11A -OE则没有作用。在体外,OsCATAS11D、OsCATCS11D、OsCPK12介导的预磷酸化OsCATA和OsCATC均表现出比野生型OsCATA和OsCATC、OsCATAS11A和OsCATCS11A更高的CAT活性(图5E) 。 本研究结果表明,OsCATA和OsCATC在丝氨酸11号位点的磷酸化提高了它们的CAT活性,从而改善了水稻的氧化耐受性。 先前的研究也表明,大多数野生型CAT以单体和二聚体的混合形式存在,但S167D型CAT主要是四聚体,这是最大活性所必需的, 这表明特定位点的磷酸化可以通过影响CAT的聚合物形式来影响CAT的活性。本研究结果表明,OsCATA和OsCATC在丝氨酸11号位点的磷酸化提高了它们的CAT活性,从而提高了水稻的氧化耐受性
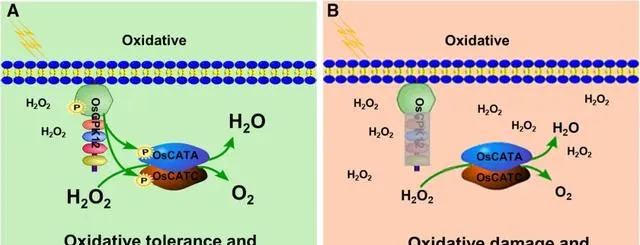
图7. OsCPK12调控水稻氧化耐受性模型。 在野生型植株中,OsCPK12的磷酸化主要通过在Ser11位点磷酸化来增加OsCATA和OsCATC的活性,从而抑制H 2O 2的积累。然而,在突变植株中,OsCPK12的功能丧失不能磷酸化OsCATA和OsCATC,未磷酸化的OsCATA和OsCATC具有较低的CAT活性。低CAT酶活性导致H 2O 2积累,使植株处于氧化应激状态。综上所述,OsCPK12磷酸化OsCATA和OsCATC的Serl1位点,增加其维持H 2O 2稳态的活性,并且OsCPK12的过表达提高了水稻对氧化胁迫的耐受性。绿色背景为野生型,粉色背景为突变型;P,磷酸化基团;字体越大,酶活性越强。
如图7建立的模型所示,在野生型植株中,OsCPK12的磷酸化主要通过在丝氨酸11号位点磷酸化来增加OsCATA和OsCATC的活性,从而抑制pO2的积累。然而,在突变品系中,OsCPK12的功能缺失不能磷酸化OsCATA和OsCATC,未磷酸化的OsCATA和OsCATC具有较低的CAT活性。低CAT酶活性导致pO2积累,使植株处于氧化应激状态。综上所述,OsCPK12磷酸化OsCATA和OsCATC的Ser11位点,增加其维持pO2稳态的活性,并且OsCPK12的过表达提高了水稻对氧化胁迫的耐受性。











