

次级代谢产物是以微生物、植物或动物等细胞合成的初级代谢产物为原料或前体,通过一些特殊代谢途径合成的一类可发挥显著生物活性的代谢产物。这类代谢产物大多具有特殊的生理活性,在机体适应特殊生境或完成特定代谢的过程中具有重要作用,也是中草药和天然药物的重要药效物质,因此挖掘此类代谢产物已成为寻找具有潜在天然活性产物的主要手段之一[1-2]。
放线菌分布广泛,因其可产生大量结构新颖且具有丰富活性的次级代谢产物而备受关注,包括抗生素、免疫抑制剂、抗肿瘤药物、维生素、酶等[3]。链霉菌 Streptomyces 属于经典的放线菌,其产生的次级代谢产物一直都是抗生素类药物发现和开发的重要来源。截至目前,在医药、农业等领域使用的抗生素中有90%均为放线菌合成的次级代谢产物,如大环内酯类抗生素、氨基糖苷类抗生素、四环素、酰胺醇等,而50%以上的链霉菌都能产生抗生素[4-5]。
尽管如此,在自然生长状态下,野生链霉菌的次级代谢产物合成效率较低,远不能满足大规模生产需要,其原因主要有:链霉菌是一种丝状细菌,具有复杂的发育周期,而其次级代谢产物的合成与链霉菌生命周期中的形态分化密不可分[6];链霉菌次级代谢产物的生物合成基因簇(BGCs)在自然生长条件下大多处于沉默或低水平表达状态[7],限制了链霉菌次级代谢产物种类和产量的积累;
此外,目前关于链霉菌次级代谢产物合成的代谢网络调控相关机制仍未得到充分解析,但随着全基因组测序技术和合成生物学技术的快速发展,大量的链霉菌BGCs被挖掘,如何激活这些BGCs提高链霉菌次级代谢产物的产量已成为新药研发领域寻找具有显著活性化合物的研究热点[8-9]。基于此,本文对调控链霉菌次级代谢产物生物合成的非靶向和靶向调控策略进行综述,为实现链霉菌次级代谢产物生物合成效率的高效强化提供参考。
1 链霉菌发育周期及其次级代谢产物的产生
链霉菌是一类广泛存在的革兰阳性丝状原核微生物,呈现出复杂的发育周期和生长模式。链霉菌生命周期始于分生孢子的萌发,当分生孢子在适宜条件下吸水后通过伸长和分裂启动发芽并以放射状向基质内层和表面扩散,形成大量具有吸收营养和排泄废物功能的基内菌丝体,同时又不断向上分化出气生菌丝。该阶段链霉菌菌丝处于快速生长状态,当气生菌丝成熟后,链霉菌会进入孢子分化阶段,分化成孢子丝,而后通过横割分裂的方式,产生分生孢子。孢子分化是链霉菌生命周期中的一个重要转变过程,该过程通常伴随着菌丝形态的变化和次级代谢产物的合成[5,10]。
液态发酵是链霉菌规模化培养进行次级代谢产物生产的主要方式,且通常将发酵过程分为菌体生长和产物合成2个阶段。以抗生素为例,其通常在菌体生长阶段结束后由基质菌丝体产生,目前在液态发酵环境中链霉菌菌丝分化领域的研究工作主要集中在菌丝形态、培养基组成和生物反应器设计等[11]。链霉菌在液态发酵体系呈现的形态可分为4种类型:小球(直径950 μm的致密团块)、团块(直径600 μm的不太致密团块)、分支菌丝和非分支菌丝,部分研究者认为,细胞聚集形成小球和团块是次级代谢产物高效合成的基础[12-13]。因此,链霉菌次级代谢产物的合成与其形态分化过程密切相关。
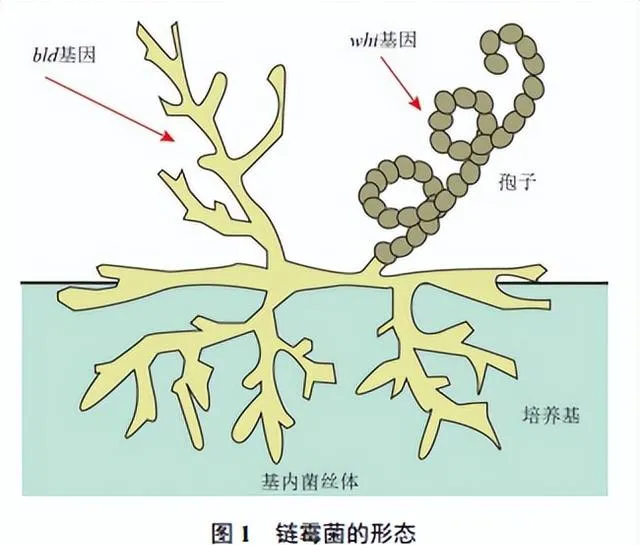
链霉菌的形态分化是多个调控因子和调控网络综合作用的结果,其中 bld ( bald )家族和 whi ( white )家族基因发挥着关键的调控效应(图1)[14]。 bld 家族基因包括 bldA、bldD、bldM 和 bldN 等,其中 bldA 基因能编码一种特殊的tRNA分子,通过翻译UUA(TTA)密码子而影响蛋白质合成; bldD 基因参与抑制链霉菌气生菌丝发育和孢子形成相关基因的转录,阻止孢子在菌丝生长期的生成; bldM 基因则编码一种双组分系统孤立应答调控蛋白,参与细胞的应答和调控; bldN 基因编码的是一个胞质外功能σ因子,也是一种转录调控蛋白。可见, bld 基因家族编码一系列的转录因子,通过调控链霉菌形态分化过程中的细胞合并、细胞壁合成与分化等关键步骤而对链霉菌的代谢发挥调控效应,这些基因的突变或缺失可导致链霉菌的分化受阻[14-15]。
whi 家族基因在链霉菌的形态分化和孢子形成过程中也发挥着重要调控作用,其中, whiA 和 whiB 表达产物是参与细胞延伸和分裂时期转换的关键调控因子,能够影响细胞分裂和孢子分隔的形成; whiG 基因编码一种RNA聚合酶σ因子,主要在链霉菌的气生菌丝分化晚期发挥作用,调控进入孢子生成阶段; whiI 基因编码双组分系统孤立应答调控蛋白,参与细胞的应答和适应性变化[14,16]。
在链霉菌的形态分化过程中,这些基因和调控因子通过调控基因表达、信号传导和细胞功能,共同参与调控细胞的合并、细胞壁合成、菌丝分化和孢子形成等关键步骤,它们的相互作用和调控网络对于链霉菌的生长发育、代谢产物合成及适应性变化等具有重要影响,对于链霉菌资源的研究和开发具有重要参考价值[14-17]。链霉菌形态分化的周期调控是一个复杂过程,涉及多个基因和调控因子的相互作用和调控网络。
目前,链霉菌的分化过程和生命周期已被深入研究,但从形态分化到次级代谢产生的转变机制仍不清楚,一旦阐明这些机制,或许可以通过调控某些节点开关对次生代谢做出正向调节,进而实现高活性次级代谢产物的强化合成,因此链霉菌中形态分化关键基因的表达研究对阐明次级代谢产物合成相关的代谢通路和优化链霉菌生命周期具有重要意义。
2 链霉菌的代谢调控策略
大量的链霉菌基因组测序结果表明链霉菌含有丰富的调控次级代谢产物合成的BGCs,但通过生物信息学分析发现BGCs中的很多基因在常规培养条件下都处于沉默状态[18],从而使链霉菌独特的次级代谢产物合成途径处于关闭或低效率代谢状态。因此,激活和调节链霉菌沉默的BGCs以促进次级代谢产物种类增加和产量提升是链霉菌源高活性化合物开发的研究重点[19]。
目前,已有多种激活BGCs的方法得到应用,包括非靶向激活(细胞外信号诱导,图2)和靶向激活策略(重建生物合成途径和关键蛋白异源表达,图3)[20]。值得注意的是,非靶向调控策略可能不具有高度选择性,而且对于产物产量和结构的影响往往也具有不稳定性,因此,在应用非靶向调控策略时,需进行调控策略和培养条件的优化,并结合分子生物学和代谢组学等方法深入研究其机制,进而实现对链霉菌生长和次级代谢的理性调控;而靶向调控策略结合了基因工程、合成生物学、信号通路研究和代谢工程等方法,可以更精确地调控链霉菌次级代谢产物的合成,对于链霉菌源的成药性化合物开发具有重要应用价值[18-21]。

2.1 非靶向调控策略
2.1.1 培养基组分的调整
培养基组分对链霉菌次级代谢产物的合成具有重要影响,不同培养基组分的组合和浓度可以影响菌株的生长和代谢途径的调控。大量研究表明,不同培养基营养条件(碳源、氮源、能源、无机盐、水)组成对链霉菌的次级代谢产物的种类和产量有明显影响[22-23],碳、氮源可提供进行能量代谢和蛋白质合成的必要物质基础,而无机盐和微量元素则可影响链霉菌代谢反应的速率和方向[24-25]。
微生物的能量代谢涉及电子传递过程,微量元素如铁(Fe2+/Fe3+)和钼(Mo2+/Mo4+)参与细胞色素和铁硫簇的形成,参与电子传递链传递,同时铁作为细胞代谢中大量关键酶的辅助因子,是重要的必需金属离子之一,但是铁在非酸性的好氧培养环境并不容易获得,链霉菌以其产生各种铁载体的能力而闻名,缺乏铁载体产生或摄取能力的链霉菌菌株生长可能会减少甚至消除,从而导致其形态分化和次生代谢物的合成受阻,而铁载体的生物合成与培养基中的铁含量密不可分[26]。
此外,锌(Zn2+)和镉(Cd2+)也是大量酶的辅助因子,锰(Mn2+)在一些氧化还原酶中发挥重要作用。锌已被证实具有在细胞中发挥稳定蛋白质结构折叠和作为酶催化辅助因子的双重作用[27],但高浓度的Zn2+也会对微生物的生长代谢发挥负效应,因此,必须严格调节和维持锌稳态[28]。铜(Cu2+)作为一种还原性金属离子,虽然对细胞有潜在危险,但铜(Cu2+)参与酵母色素和氧化还原酶的形成,从而促进电子传递和催化还原反应,特别是在链霉菌中,培养基中铜含量对形态分化的开始和次级代谢物的产生具有显著影响[29]。李全乐[30]通过考察Fe2+和Mg2+对吸水链霉菌 S. hygroscopicus 代谢组的影响,发现Fe2+在一定程度上可影响吸水链霉菌胞内脂肪酸和氨基酸合成并促进雷帕霉素的合成,而Mg2+对吸水链霉菌氨基酸代谢影响也比较显著。
此外,生长因子也是微生物生长和代谢所必需的重要成分,如维生素、脂肪酸、氨基酸等,一些些微生物需要外源的生长因子才能正常生长;调节剂和激素也可以调控微生物的生理过程和代谢途径。如脱氧胆酸可作为调节剂,影响某些细菌的次级代谢产物合成,而培养基中添加抗生素可以抑制其他微生物的生长,从而实现目标微生物的选择性培养,一些抑制剂也可用来阻断某些特定代谢途径或抑制细胞特定酶活性[25]。此外,部分强氧化剂也会对其有较大的影响。Wei等[31]发现优化吸水链霉菌5008培养体系中pO2的添加量和添加时间,可以将缬霉素A的产量提升40%。
2.1.2 培养环境的改变
微生物培养过程中环境温度、pH、溶氧量、渗透压、容器类型等也会引起其相关基因的差异表达[32],次级代谢相关途径中关键酶的活性直接影响次级代谢产物合成,如培养温度过高导致酶失活,温度过低则影响酶促反应速率,同时渗透压、pH、溶氧量等也会引起微生物生化反应速率的变化,并对一些沉默BGCs的激活发挥调控效应[33]。Boukaew等[34]通过对比不同的温度、光照/黑暗条件下链霉菌 S. philanthi RL-1-178、 S. philanthi RM-1-138、 S. mycarofaciens SS-2-243的代谢状况,发现不同温度和光照/黑暗条件对RM-1-138菌株合成的抗真菌代谢产物种类和产量影响极为显著,而Zhang等[35]发现通过控制灰略红链霉菌 S. griseorubens JSD-1发酵过程中的pH变化和溶氧量,可使该菌株纤维素酶、木聚糖酶和滤纸酶的产量大幅提升。
2.1.3 微生物共培养
微生物共培养是指2种及以上微生物(包括细菌、丝状真菌、酵母等)在同一培养体系中共同生长和相互作用的过程。该过程可实现不同菌株间代谢产物和代谢信号的共享和交换,进而发挥不同菌株间的协同或拮抗作用,激活可能的沉默BGCs,实现微生物新代谢产物的合成,或目标代谢物产量的显著提升[36]。
微生物共培养可以产生多种效应,如共生、协作、竞争等。共生关系是指微生物之间通过相互利用代谢产物或提供生长因子等互相促进生长;协同作用是指不同微生物的共培养可能导致协同效应,即彼此之间生长和代谢的相互促进,从而提高某些次级代谢产物的产量;竞争关系是指共培养体系中不同微生物之间争夺有限的可利用资源,包括营养物质和生长空间,进而导致对一种或多种微生物的生长抑制或排斥,竞争关系的出现取决于不同种微生物之间的生态位差异和生长速率等因素。
共培养体系中互为竞争关系的微生物可通过产生抗生素来抑制竞争对手的生长。这种抗生素产生可以被视为一种防御机制,帮助微生物在共存环境中获得竞争优势。在共培养中,微生物之间还可以进行基因水平的相互作用,如基因转移、共享或调控等。这些相互作用可以导致基因型的改变和适应性特征的转移[37-40]。微生物共培养方法已被大量研究证实有效,如Shin等[41]将海洋链霉菌与芽孢杆菌共培养产生一种新的含哌酸环肽;Huynh等[42]将链霉菌 S. sp. GA02和 Pandoraea sp. GA02N共培养产生了2种芳香化合物。
综上,微生物共培养技术现已经被广泛用于合成生物学领域,相比于单一菌株培养,微生物共培养不仅可以减轻出发菌株的代谢负担,实现复杂化合物的协同合成,还可以充分发挥不同物种的优势和能力,利用低劣生物质以提高目标产品经济性[43],但目前还存在共培养体系稳定性差、自主调控能力缺乏、关键控制点不清晰、工业放大难等问题。
2.1.4 中药提取物调控
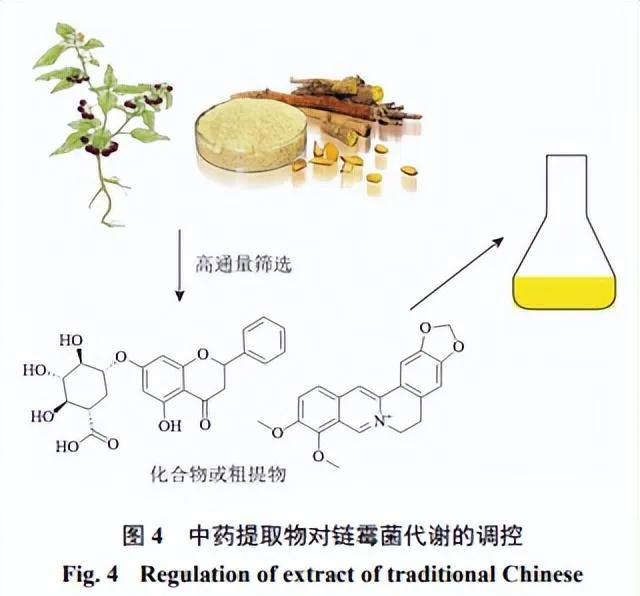
中药提取物中的活性成分,如生物碱、黄酮等具有抑菌或抗微生物活性[44],这些活性成分可以通过抑制微生物的代谢酶活性、破坏细胞膜结构或抑制细胞分裂等,抑制微生物的生长和繁殖(图4)[45-46]。一些中药提取物中含有具有激素作用的成分(植物生长素、植物激素等),这些激素可以刺激微生物的细胞分裂、营养吸收和代谢活动,加速其生长和繁殖过程[47]。酚类化合物可以改变微生物膜结构,从而影响细胞透过性和物质转运过程,进而影响微生物的代谢效率和产物合成[48]。
抗氧化、抗炎成分可以增强微生物的抗逆能力,这些抗逆能力的提高可以使微生物在恶劣环境下更好地适应和生长[49]。Seyedsayamdost[50]于2014年概述了一种利用高通量筛选小分子化合物激活沉默BGCs的方法。这种小分子通过小分子文库的高通量筛选提供了潜在的诱导剂,而中药是天然活性分子化合物的宝库,通过高通量筛选中药中某些具有较强生物活性的小分子可以作为激发子激活沉默的BGCs,虽然目前发现的这种激发子大多是抗生素,
但聂智英[51]将链霉菌CB02414、CB03234、CB02130和NRRL S-1813培养液中加入杜仲叶水提物后通过液质联用技术分析发现,加入杜仲叶水提物的CB02414培养组比对照组新增了2个化合物,加入杜仲叶水提物的CB03234培养组比对照组新增了1个化合物,且该化合物的产量随着杜仲叶水提物浓度的增加而增加,同时发酵液粗提物抑制金黄色葡萄球菌 Staphylococcus aureus 的活性也得到了明显增强,加入杜仲叶水提物的NRRL S-1813培养组比对照组新增了1个化合物,同时发酵液粗提物对金黄色葡萄球菌和藤黄微球菌 Micrococcus luteus 的抑制效果也显著增强。上述数据提示中药中的某些小分子可作为激发链霉菌中沉默BGCs的激发子,为沉默BGCs的激活提供了一种新的策略,但其具体机制仍需进一步研究。
2.1.5 表观遗传修饰
表观遗传修饰可以在不涉及DNA序列改变的前提下对基因的表达进行调控,通常通过调控DNA甲基化、组蛋白修饰和非编码RNA改变基因的表达水平或沉默状态(图5)[52]。DNA甲基化指在DNA甲基化转移酶的作用下,基因组CpG位点(C和G相邻的碱基对)二核苷酸的胞嘧啶5号碳位共价键结合1个甲基基团,DNA甲基化的结果通常导致基因沉默,抑制基因的转录活性[53]。而组蛋白修饰是一类常见的表观遗传修饰,一般通过化学修饰改变组蛋白分子状态,从而影响染色质的结构和功能,达到调节基因的可及性和转录活性的目的。
常见的组蛋白修饰类型包括以下几点:
(1)乙酰化:组蛋白乙酰化通常与基因的活性相关,通过加上乙酰基基团,可以使染色质更松弛,使得转录因子和转录机器更容易接近基因组,促进基因的转录;
(2)甲基化:组蛋白甲基化是在赖氨酸残基上添加甲基基团,可以引起不同的效应,在一些位点,组蛋白甲基化可以导致染色质结构的紧缩,抑制基因转录;
(3)磷酸化:组蛋白磷酸化通常与活化基因表达相关,磷酸基团的加入可以导致染色质结构的改变,促进转录因子与染色质的相互作用,并激活基因转录;
(4)泛素化:组蛋白泛素化是在赖氨酸残基上加上泛素分子,它可以参与染色质结构的调节和蛋白质的降解,并影响基因的表达。
此外,还存在其他类型的组蛋白修饰,如丝氨酸磷酸化、丝氨酸/苏氨酸乙酰化、丝氨酸/苏氨酸甲基化等,这些组蛋白修饰可以通过与其他转录调控因子的相互作用,调节染色质的结构及转录的启动和终止过程[54]。

组蛋白去乙酰化酶和甲基转移酶常作为化学表观遗传修饰剂激活真菌的沉默BGCs,这是因为真菌DNA结合在组蛋白上,组蛋白将DNA压缩成染色质并调节复制和转录[55],且这些基因的位置往往靠近其染色体的端粒,而组蛋白乙酰化和DNA甲基化对这些位点的转录有很大影响,可抑制或关闭真菌次级代谢产物的生物合成。
链霉菌等原核生物染色体结构虽比真菌染色体结构简单,但化学表观遗传修饰剂也可对链霉菌的次级代谢产物发挥调控效应[56],如Kumar等[57]用5-氮杂胞苷25 μmol/L处理 S. coelicolor AZRA 37后,液相色谱分析表明发酵产物增多,抗菌活性增强,全蛋白分析表明出现了新的孔蛋白。可能是由于链霉菌的DNA、蛋白质和RNA构成的染色体是高度压缩的超螺旋结构,DNA环绕在由RNA和蛋白质形成的「拟核」的内外,一些基因簇也可能由于压缩导致沉默。此外一些启动子附近DNA的甲基化也会影响基因表达,使用DNA甲基化酶抑制剂抑制其DNA甲基化,可激活相关基因表达[57-58]。
2.1.6 信号分子蛋白的表达调控
信号分子蛋白的表达调控是细胞中的一种重要机制,可以全局调控基因表达水平以响应特定的环境信号或细胞状态。目前,在链霉菌中报道信号分子合酶只有2种[59],包括A因子合成蛋白(AfsA)和乙酰辅酶A氧化酶(Aco)同源蛋白。AfsA同源蛋白可催化脂环类化合物的合成,如γ-丁内酯、丁烯羟酸内酯或呋喃类信号分子;Aco同源蛋白主要催化丁烯羟酸内酯类信号分子合成的酶[60-61]。
在链霉菌中,AfsA同源蛋白可通过催化特定的化学反应生成γ-丁内酯、丁烯羟酸内酯或呋喃类信号分子,这些信号分子在链霉菌的生命周期和发育过程中具有重要的调控作用,丁烯羟酸内酯类信号分子还可影响链霉菌细胞分化、发育和次级代谢产物的合成。AfsA和Aco同源蛋白的表达和活性均受到环境条件和细胞状态的调控,可作为链霉菌次级代谢调控的重要信号分子蛋白[62-63]。但是目前有关Aco类信号分子合酶的功能认知仍需进一步深入探索[59]。
此外,全局调控蛋白在调节链霉菌的初级和次级代谢转换过程中也发挥着关键作用[64]。如全局调控蛋白GlnR[65]和PhoP[66]分别通过监控链霉菌的氮代谢和磷酸盐代谢状态来控制抗生素的生物合成。研究表明全局调控转录阻抑蛋白DasR是一个平衡链霉菌碳源和氮源代谢的关键交叉点,它通过与中间代谢产物6-磷酸乙酰氨基葡萄糖(GlcNAc-6P)和6-磷酸氨基葡萄糖(GlcN-6P)结合,参与了链霉菌的营养感应、形态分化、初级代谢和次级代谢转换等生物学过程[67]。
N -乙酰葡糖胺的代谢产物GlcNAc-6P和GlcN-6P与DasR蛋白结合后,通过调节蛋白的构象,解除DasR与响应元件( dre )位点对下游基因的抑制作用。表明GlcNAc-6P和GlcN-6P通过改变DasR蛋白的构象来调节其与 dre 位点的结合,从而减弱甚至消除对下游基因的阻碍作用[68]。DasR蛋白的研究对于了解细菌的基因表达调控网络和代谢途径具有重要意义,为新抗生素等次级代谢产物挖掘和微生物代谢工程技术创新提供依据,然而,还有许多关于DasR蛋白的具体机制和功能目前仍未得到充分解析[69]。
2.1.7 转录因子调控
转录因子是一类可以与DNA分子上的特定核酸序列结合,并对基因转录发挥调控效应的蛋白质,其通过与DNA结合而参与调控基因转录起始复合物的形成或抑制,从而控制基因的转录水平和转录速率[70]。在链霉菌中,转录因子调控主要通过调控转录因子基因簇和第2信使系统等方式实现。链霉菌的基因组中通常存在一些特定的转录因子基因簇,它们编码具有相似结构和功能的转录因子,这些转录因子能够识别和结合到特定的DNA序列,在细菌中同时调控与代谢相关的基因簇表达,从而实现对代谢途径的整体调节。
此外,链霉菌中存在丰富的第2信使系统,如环磷酸腺苷、高度磷酸化的鸟苷酸分子调控(ppGpp调控)等,这些第2信使能够与转录因子相互作用,调整其亲和力或构象,从而调节特定基因的转录活性。如环二鸟苷酸(c-di-GMP)调节链霉菌的生物胶囊形成、生物膜合成和细胞的运动能力,高水平的c-di-GMP可促进生物胶囊的形成和生物膜的合成,从而抑制链霉菌的移动和生长,而低水平的c-di-GMP则与链霉菌的生长和分化过程相关。C-di-AMP可调节链霉菌的细胞壁合成和细胞分裂,其在链霉菌的生长和分化阶段发挥重要作用。ppGpp的合成与生长阶段和菌丝形成密切相关,高水平的ppGpp能够抑制链霉菌的细胞分裂和生长,导致细菌进入休眠状态[71-73]。
链霉菌的转录因子调控对于合成具有药用活性和工业应用前景的代谢产物非常重要,研究链霉菌中转录因子的结构、功能和调控机制有助于理解链霉菌的代谢途径调控和生物学过程,为优化微生物发酵过程和开发新型抗生素等代谢产物提供理论和实践指导。
综上,非靶向激活沉默基因簇的方法是通过调控细胞内的代谢调控因子或环境条件,使沉默的基因簇得以激活、表达并合成次级代谢产物,涉及一系列复杂的基因调控网络,调控因子主要包括转录因子、信号分子、蛋白质等。这些调控因子通过与DNA结合或参与信号传导途径,调节链霉菌的基因表达水平和代谢途径,同时,非靶向调控在细菌生存和对环境的适应过程发挥重要作用,可以帮助细菌响应环境变化或细胞内部信号,进而调整细菌细胞生长、代谢产物合成和细胞生理状态。
2.2 靶向调控策略
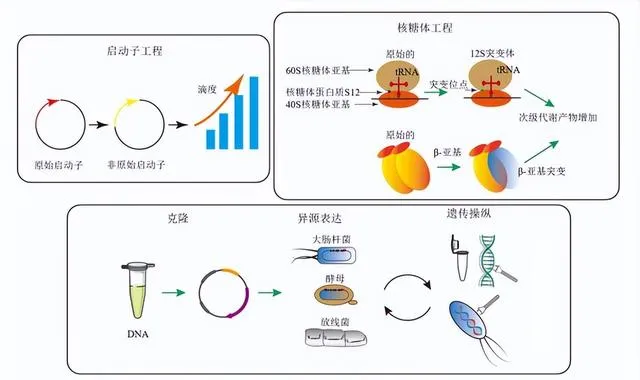
靶向调控策略是指通过针对特定基因、途径或调控网络的操作,实现对生物体的生物学特性进行精准调控以实现特定目的方法。这种策略广泛用于代谢工程、合成生物学、医药科学等领域,能够改善生物体的性能、代谢途径和产物合成[74-76],主要通过核糖体工程、启动子改造、沉默BGCs的异源表达或编辑等方法来实现
2.2.1 核糖体工程
核糖体工程本质是抗生素胁迫目的菌株发生定向突变的一种微生物育种技术,目的是通过改变核糖体的结构和功能,使其能够优化蛋白质合成的速度、准确性和产量[77-78],主要方法为利用一些能够作用于核糖体和RNA聚合酶等转录翻译元件上的抗生素,促使菌株发生抗药性突变,达到调控细胞内沉默BGCs表达并促进相关活性次级代谢产物的合成[79]。该方法简单高效,且可实现对目的基因的精准调控,几乎可用于所有放线菌菌株中次级代谢产物的挖掘或生物合成过程强化,所选抗生素尤以利福平和链霉素最为广泛,也是调控机制研究最为透彻的2种抗生素[77]。
利福平诱导放线菌产生的最常见突变位于 rpoB 编码的RNA聚合酶β-亚基保守的第437位的His/H,该位点容易突变为Tyr/Y、Arg/R和Leu/L等,该突变极易激活沉默BGCs从而促进新颖次级代谢产物合成,此外rpoB的433位与442位的Ser/S、422位的Leu、424位的Gln/Q及427位的Asp和440位的Arg也会发生相应突变,而链霉素诱导放线菌产生的突位点常见于 rpsL 编码的核糖体蛋白S12的第88、43位的Lys/K[80-81]。常见的突变形式为Lys88Glu、Lys88Arg和Lys43Asn[82]。Zhang等[83]通过使用利福平300 μg/mL诱导链霉菌 S. somaliensis SCSIO ZH66得到了耐药菌株ZH66-RIF1,相比于野生型菌株在其发酵产物中得到化合物 弗雷德里克霉素A ,最终确定为RNA聚合酶β亚基Arg444His的突变导致负责雷德里克霉素A合成的BGCs被激活。
2.2.2 启动子改造
具有良好表征的启动子是代谢工程和合成生物学的重要工具[84]。在重建微生物生物合成代谢途径改造过程中,常用的方案是利用不同强度的启动子对目的基因的表达效率进行精细调控,从而提高次级代谢产物的合成效率[85]。常见的链霉菌启动子改造策略包括启动子替换、引入辅助调控序列和随机突变、启动子工程等。
启动子替换是指通过基因克隆和DNA重组技术将目标基因的原有启动子序列替换为具有不同转录调控特性的启动子序列,替换后的启动子可以来自于链霉菌中其他基因的启动子或其他物种的启动子,如促进转录的强启动子,或抑制转录的弱启动子等。向启动子中引入辅助调控序列是指通过在目标基因启动子中引入额外的转录调控序列,如转录因子结合位点、响应元件或增强子序列来增强或抑制目标基因表达的方法,这些辅助调控序列可以来自于链霉菌中已知的调控元件,或是从其他物种中获得。
启动子随机突变是指通过随机引入点突变或插入突变来改变目标基因的启动子序列,进一步通过筛选或选择寻找具有不同表达水平的突变体,该方法可以帮助研究者寻找到合适的启动子序列,从而达到期望的基因表达水平。启动子工程是指通过基因组编辑技术,如成簇的规律间隔的短回文重复序列系统9(CRISPR/Cas9)系统可直接对链霉菌的基因组进行编辑,改变特定基因的启动子序列,从而实现对特定基因表达的调控,该方法可以精确修改链霉菌的启动子,以达到所需的表达水平[86-88]。
如Li等[89]将天蓝色链霉菌 S. coelicolor 中的天然启动子kasOp-受 S. coelicolor 蓝色素调节剂(ScbR)和ScbR2调节剂严格控制的暂时表达启动子改造成强启动子kasOp3,并通过随机突变和突变文库筛选消除kasOp3核心启动子区域内的另一ScbR结合位点获得了强启动子kasOp*,并在3种链霉菌中比较了kasOp*与另外2种已知强启动子ermEp*和SF14p的活性,发现kasOp*在3种宿主中均表现出最强的转录和翻译活性。此外,Li等[89]还探索了诱导型启动子调控BGCs表达的效应,发现与组成型启动子相比,诱导型启动子可显著提高 S. coelicolor 中放线菌红素和异质土霉素的滴度。上述研究证明启动子的设计可为链霉菌次级代谢产物合成途径沉默BGCs的表达发挥显著调控效应。
2.2.3 沉默BGCs的异源表达
BGCs的「沉默」状态通常是由于受到直接或间接的阻遏造成,因此去除或「绕过」阻遏因子是激活沉默BGCs的关键。通过生物信息学工具预测、克隆目的基因、修饰基因簇、构建表达载体、转移基因簇、功能性表达基因、比较分析代谢产物图谱、优化表达等而实现目标BGCs的激活,这种研究手段称为BGCs的异源表达[74,90]。选择合适的宿主是异源表达成败的关键。异源宿主相较于天然宿主具备多种优势:首先,异源宿主培养条件简单,其调控体系相对清晰;其次,转录元件在异源宿主中更易于控制,使直接克隆或重构BGCs后进行异源表达成为可能,通过这种方法,可以规避原宿主中复杂的调控体系(且多为未知),从而激活沉默BGCs,并产生相应的次级代谢产物[91]。
目前广泛使用的异源宿主包括大肠杆菌、酵母、链霉菌等。大肠杆菌作为常见的细菌宿主,具有高表达能力和培养条件简单等特点,被广泛用于重组蛋白表达[92];而酵母是一种单细胞真核生物,具有较高的蛋白质折叠和修饰能力,常用于复杂蛋白质表达和进行糖基化修饰的研究[93-94]。链霉菌具有许多有益特点,如广泛的物种多样性、天然的次级代谢能力、高效的蛋白表达系统及丰富的分泌途径,使其成为许多天然产物BGCs异源表达的理想宿主,如天蓝色链霉菌、浅紫灰链霉菌 S. lavendulae 和白色链霉菌 S. albus [95]。Pait等[96]将 S. lavendulae FRI-5的 lav 基因簇在工程菌株 S. avermitilis SUKA22异源表达时发现了一个新的二醇聚酮化合物。
通过异源表达BGCs,可以探索新的产物合成途径、增加产物的多样性,并帮助理解和利用BGCs在不同宿主中的表达特征,然而异源表达仍然面临一些挑战,如调控异源基因的表达、代谢负担和代谢通路中间产物的调控等,因此,在设计和实施异源表达策略时,需要仔细考虑特定的研究目的和宿主的适应性。
2.2.4 沉默BGCs的编辑
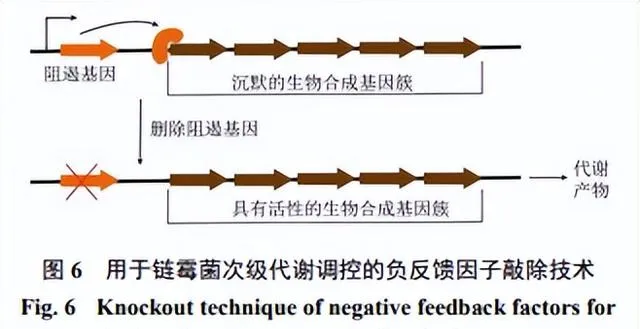
沉默BGCs的编辑通常是通过敲除或抑制特定基因或基因簇的表达来实现(图6),常见的基因编辑技术包括CRISPR/Cas9、RNA干扰(RNAi)、转基因技术、编辑酶等相关技术[97]。CRISPR/Cas9技术可以精确地敲除或编辑目标基因,利用CRISPR和Cas9核酸酶的复合物,通过编程的方式精确定位目标基因序列,并进行切割、插入或修复等操作,具有操作简单、高效率和多样性等优点[98]。
刘昭远[99]通过CRISPR/Cas9技术敲除海洋放线菌 S. sp. HNS05中的10个基因簇,经对所获得的突变株代谢产物进行分析发现其中3个基因簇的敲除可抑制该菌株分泌的抑菌活性物质的生物合成。RNAi是一种通过转录小干扰RNA(siRNA)或小发夹RNAs(shRNA)来抑制基因表达的方法。通过设计特异性的siRNA或shRNA序列靶向特定基因或基因簇的mRNA,RNAi技术可以诱导降解目标mRNA,从而沉默基因簇的表达[100]。
转基因方法通过构建含有负向调控元件(如启动子或反义序列)的转基因载体,将其导入目标生物体内。这些负向调控元件可以抑制目标基因或基因簇的表达,从而实现沉默效果[101]。编辑酶相关技术包括转录激活因子样效应核酸酶(TALENs)和锌指核酸酶(ZFNs)。TALENs和ZFNs是一类专门设计的DNA结合蛋白,可以与特定基因序列结合并诱导DNA断裂,通过设计这些编辑酶靶向基因簇的特定区域,实现基因簇的敲除或编辑[102-103]。
3 结语与展望
链霉菌是一类重要的原核微生物,具有丰富的次级代谢产物合成能力,其代谢调控是一个重要而复杂的研究领域。基于链霉菌基因组学和转录组学的分析表明,链霉菌次级代谢产物的生物合成受到一系列基因调控系统的精密控制,这些调控系统涉及到多个层面的调控,包括转录调控、信号传导、基因组和表观遗传学调控等。因此,了解这些调控机制对于挖掘链霉菌次级代谢产物生物合成潜力、优化产物产量及开发新的活性天然产物均具有重要意义。
在转录调控层面,数以百计的转录因子被发现与链霉菌次级代谢产物的生物合成相关,这其中包括正调控和负调控因子,它们通过结合特定的DNA序列、调节基因转录水平、影响酶活性等方式来调节次级代谢途径关键基因的表达。此外,信号传导系统在链霉菌次级代谢产物生物合成的调控中也发挥重要作用,这些信号传导系统包括多种信号分子的感知、转导和调控机制。如通过环境刺激、生理信号、细胞周期等,链霉菌可以调节次级代谢途径的启动和关闭,从而合理调控产物的合成。
另外,基因组和表观遗传学调控在链霉菌次级代谢产物生物合成中也被广泛研究,链霉菌具有较大的基因组和丰富的表观遗传修饰系统,这些修饰可以在细胞内部、细胞间传递并影响细胞内的基因表达和代谢调控,基因组和表观遗传学变化可以改变次级代谢途径中关键基因的表达,从而影响次级代谢产物的产生。通过基因工程和代谢工程的手段,也可以对链霉菌的代谢通路进行优化和改造。这些工作主要涉及调节基因表达水平、增强代谢途径酶活性、优化底物供应等策略。通过这些手段,大量的链霉菌菌株次级代谢产物的合成水平被显著提高。
尽管如此,目前对链霉菌代谢调控的研究和应用仍面临很多挑战。首先,链霉菌生命周期复杂,其代谢调控涉及多个层面,因此,需要深入研究不同阶段的链霉菌代谢调控网络,以更好地理解该类型微生物的代谢途径和调控机制。此外,传统的发酵调控方法在链霉菌代谢工程中的应用也面临一些限制,这些方法通常耗时且低效,因此需要引入高效、精准的分析、调控技术来加速代谢工程实验探索的优化。数据科学、人工智能和机器学习等方法可以帮助更好地分析和预测代谢调控网络,从而加速优化过程。此外将链霉菌代谢调控与合成生物学、代谢工程和先进的生物工程技术相关工具结合,进而尝试更强大的科研工具和策略开发,将有望为链霉菌次级代谢产物的挖掘与生物合成过程强化进一步助力。
综上,链霉菌次级代谢产物的生物合成受到多种调控系统的精密调控,理解这些调控机制有助于深入揭示链霉菌次级代谢途径的调控网络,进而为优化产物产量和开发新的生物活性化合物提供理论指导和实践基础。
来 源:孟俊华,张少航, 鲁曼霞, 厉 晓, 龚 婕,王 炜, 崔培梧.链霉菌次级代谢产物生物合成的调控研究进展 [J]. 中草药, 2024, 55(14): 4917-4923.











