钠元素在自然界中都以化合态形式存在,如以NaCl、Na2 CO3 、Na2 SO4 等盐的形式存在于海水、盐湖、地壳的岩层中,自然界中没有游离态的钠元素。
钠单质的工业制法:
2NaCl =(熔融电解)2Na + Cl2 ↑
一、活泼的金属单质——钠
钠原子的结构:

钠原子的结构示意图
钠原子的最外层只有一个电子 ,且钠原子半径较大,易失去最外层的一个电子 ,成为8e-的稳定结构,即带一个单位正电荷的钠离子Na+。
钠元素是典型的金属元素,有很强的金属性;钠单质性质活泼,是强还原剂,有很强的还原性。
实验:钠与氧气在常温下的反应

钠的取用方法
|
操作 |
观察广口瓶中的钠,用镊子从煤油中取出一块金属钠,用滤纸吸干表面的煤油,在干燥玻璃片上用小刀切下一小块金属钠,观察钠块的切面 |
|
结论 |
钠的性质活泼,需隔绝空气和水保存,所以保存在煤油或石蜡油中 。钠有银白色的金属光泽,质地很软,硬度很小, ρ (煤油)﹤ ρ (钠)﹤ ρ (水) |
|
分析 |
钠的表面变暗,生成了氧化钠: 4Na+O2 = 2Na2 O |
实验:钠与氧气在加热时反应
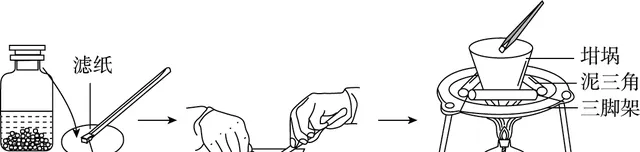
钠在空气中的燃烧
|
操作 |
加热干燥的坩埚,加入绿豆大的一块钠,等钠块熔化后撤掉酒精灯 |
|
现象 |
钠先熔化成一个金属小球,然后剧烈燃烧,发出黄色火焰,生成淡黄色固体 |
|
结论 |
钠与在高温下反应生成过氧化钠: 2Na+O2 = Na2 O2 |
同样的反应物,反应条件不同,发生的反应不一样,产物也不一样。利用这一点,可以通过控制反应条件,得到所需要的产物。
钠与其它非金属单质反应:
2Na+Cl2 =(点燃)2NaCl
2Na+S =(研磨)Na2 S
实验:在烧杯中加入适量的蒸馏水,滴入几滴酚酞,用镊子加入绿豆大一块钠,并盖上玻璃片
|
现象 |
分析 |
|
钠浮在水面上,熔化成一个金属小球 |
钠的密度比水小,熔点低,反应放热 |
|
小球在水面上四处游动,发出「嘶嘶」的声音,逐渐变小,最后消失 |
钠与水剧烈反应,产生气体推动小球运动 |
|
向烧杯中滴入酚酞液体变红色 |
有碱性物质(NaOH)生成 |
|
实验结论: 2Na+2p O = 2NaOH+p ↑ 2Na+2p O = 2Na+ +2OH- +p ↑ |
|
分析反应中得失电子的情况,思考下面的问题:
(1)将酚酞换成石蕊试液 ,现象有什么不同?
烧杯中的液体会变蓝色 。
(2)将水换成CuSO 4 溶液 、稀盐酸等溶液,现象有什么不同?为什么?
钠会先与溶液中的水反应生成NaOH和p ,生成的NaOH再与CuSO4 反应生成Cu(OH)2 沉淀,所以会有蓝色沉淀 出现,不会置换出红色的金属Cu 。
2Na+CuSO4 +2p O = Cu(OH)2 +Na2 SO4 +p ↑
钠与盐酸反应更剧烈,因为盐酸中H+ 的浓度更大。
2Na+2H+ = 2Na+ +p ↑
(3)实验室中钠怎样保存?为什么?
钠保存在石蜡油或煤油中,以隔绝空气,防止钠与
空气中的O2 、p O反应。
4Na+O2 = 2Na2 O
Na2 O+p O = 2NaOH
2NaOH+CO2 +9p O = Na2 CO3 ·10p O
Na2 CO3 ·10p O = Na2 CO3 +10p O
(4)钠着火能不能用水灭火?
不能用水灭火,是因为钠与水反应产生p ,用水灭火易发生爆炸。可用干燥的沙土盖灭。
钠的重要用途:
(1)钾钠合金用于原子反应堆的导热剂。
(2)作电光源:高压钠灯。
(3)冶炼某些金属,如冶炼金属钛。
4Na+TiCl4 =(熔融)Ti+4NaC l
小结:
金属钠有强还原性,是一种强还原剂,是活泼的金属。钠元素是典型的金属元素,有很强的金属性。
声明:原创不易,不得用于商业用途











