一波未平一波又起,近日來,飛利浦正面臨著與其器材召回相關的多項監管挑戰!

4月25日,位於美國賓夕法尼亞州西區的地方法院法官 Joy Flowers Conti 批準了一項和解協定,將為購買或租賃飛利浦召回呼吸機器材的使用者提供超過 5 億美元(折合人民幣36.2億元)的賠償 。
根據判決,飛利浦必須為購買召回器材的使用者以及退回公司的器材投入至少 4.675 億美元的和解基金。該公司還必須撥出 3400 萬美元作為付款人結算基金。 該協定還不包括人身傷害和醫療監測索賠,原告律師正在單獨尋求這些索賠。
01、 呼吸機美國地區已停售,但索賠未停止
該和解與飛利浦持續召回睡眠呼吸暫停器材和呼吸機有關,飛利浦於 2021 年 6 月開始召回這些器材, 涉及產品數量1500萬台,產品型號包含了雙水平氣道正壓通氣(Bilevel PAP、BiPAP 或 BPAP)和持續氣道正壓通氣 (CPAP) 等系列產品 ,因為用於機器隔音的聚酯基聚氨酯 (PE-PUR) 泡沫可能會分解並被患者吸入,構成潛在的健康風險。

據報道,與 PE-PUR 泡沫破裂相關的問題可能會導致嚴重傷害,並且可能需要醫療幹預以防止永久性傷害。
而在2024年1月底,飛利浦偉康(飛利浦睡眠和呼吸護理業務,Philips Respironics)宣布,由於正在努力遵守與美國FDA達成的和解, 未來幾年內將不會在美國銷售新的睡眠呼吸暫停(Sleep Apnea)治療器材。
2024 年 4 月 9 日, 聯邦地方法院釋出了針對飛利浦偉康 (Philips) 的關於在美國地區停售呼吸機相關產品的同意令。 同意令包括旨在優先考慮患者救濟並確保公司遵守監管規定的關鍵條款。
在本次訴訟中,Levin Sedran & Berman律師兼原告聯合首席律師珊迪娜·杜根 (Sandra Duggan) 表示,此次賠償大部份資金將流向使用者,其中包括使用了器材的患者以及購買了召回器材的醫院和睡眠中心。和解金額沒有上限,這意味著賠償金額可能會更高,具體取決於超出預先資助金額的索賠數量。
「對於此類賠償來說,這是一筆巨額和解金,」杜根說。
每個使用者將獲得的金額取決於器材,將被召回的器材退回飛利浦還可獲得 100 美元的固定付款。
「如果您購買了呼吸器材 Dreamstation,因為召回的器材中有三分之二是 Dreamstation,則支付的金額為 55.63 美元。如果您退回器材,您將再獲得 100 美元,累計就是 155.63 美元。」杜根在接受采訪時說道。「一些價格較高的器材(例如呼吸機)售價為 1,552.25 美元。」
如果人們在和解協定宣布之前購買了自己的替換器材,也可以獲得付款。杜根表示, 飛利浦將為這些索賠賠償高達 1500 萬美元。
和解協定的另一項條款是, 為透過飛利浦召回計劃獲得再制造器材的任何人延長兩年保修期。
根據 3 月 21 日的一份法庭檔, 註冊召回或參與和解並將器材退還給飛利浦的 150 萬使用者將獲得自動付款,而無需申請這些賠償。 無論飛利浦是否上訴,賠償金都將支付。
02、 一波未平,影像器材也頻受召回
無獨有偶,飛利浦在4月23日,收到FDA警告信關於該機構發現飛利浦位於中國蘇州的一家制造工廠,生產的電腦斷層掃描 (CT) 和超聲檢查系統存在問題。
FDA 表示,這些器材因不符合良好生產規範要求而存在「摻假」。具體來說,FDA 發現飛利浦未能驗證其 Incisive CT 機器中使用的客製數據電纜的註塑工藝,並且該公司未能向 FDA 報告過去的現場校正情況。
FDA於10月23日至26日檢查了中國蘇州的一家生產設施。檢查人員發現, 飛利浦未能向FDA報告與其Incisive CT機器相關的三項現場糾正問題。
問題之一是 CT 患者界面監視器的電纜連線故障,這可能會導致診斷延遲。另外兩個涉及軟件缺陷,可能導致影像反轉或顛倒,或影像偽影,從而可能導致誤診。
飛利浦透過回顧性審查回應稱,這三起未報告的現場糾正是唯一需要報告的召回事件。然而,FDA 還發現了其他舊召回報告,例如飛利浦 Insignia MR 器材在停電幾天後失去系統存取許可權的問題。
FDA 在警告信中還表示:「雖然貴公司的回顧性審查涵蓋了過去兩年,但考慮到之前發現的未報告的召回,建議進一步回顧(兩年以上),以確保沒有其他現場行動需要更正和刪除報告。」
該機構補充說,飛利浦未能確保該公司客製 Incisive CT 患者介面監護儀數據電纜供應商所使用的註塑工藝得到驗證。 在接到 64 起電纜連線問題投訴後,該電纜被重新設計。
飛利浦首席患者安全和質素官 Steve C de Baca 在一份電子郵件聲明中寫道:「我們正在與 FDA 密切合作,解決警告信中提出的問題,並致力於及時完成必要的行動。」
飛利浦發言人史蒂夫·古連克(Steve Klink)在一封電子郵件中寫道,警告信建議該公司延長現場安全通知的審查時間以及對供應給蘇州的所有零部件的審查時間。他寫道,檢查結果不包括患者受到傷害的報告。
Klink 補充道, 飛利浦蘇州團隊預計不會出現任何生產、運輸中斷或重大財務影響,蘇州工廠主要供應美國以外的市場。
FDA在 1 月份釋出了相關召回公告,稱該軟件缺陷影響了全球 828 台器材。此外,根據警告信,FDA 還發現了 19 份有關飛利浦其他放射器材召回的報告。
與此同時,
飛利浦已對相關問題發起主動召回。
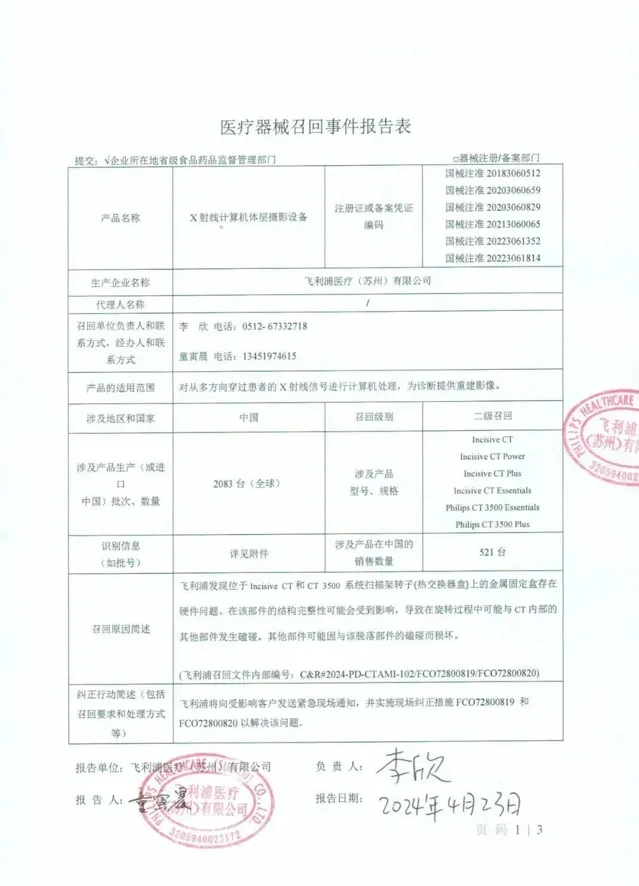
4月24日,江蘇省藥監局官方訊息,飛利浦醫療(蘇州)有限公司報告,該企業發現位於Incisive CT 和CT 3500系統掃描架轉子(熱交換器盒)上的金屬固定盒存在硬件問題,可能會在旋轉過程中與CT內部的其他部件發生磕碰,其他部件可能因與該脫落部件的磕碰而損壞。現主動召回,召回級別為二級,召回範圍針對全球,器材數量涉及2083台。涉及產品的具體資訊見【醫療器械召回事件報告表】。
除此之外,在過去一年中,飛利浦因其影像器材存在可能導致嚴重傷害甚至死亡的安全問題而 發起了幾次重大召回:
有墜落風險--BrightView 影像系統召回: 2024年2月,飛利浦召回了BrightView、BrightView X和BrightView XCT影像系統,因為檢測器可能意外掉落,可能導致嚴重傷害,如頸部傷害、創傷性腦損傷甚至死亡。這次召回被FDA歸類為I級召回,意味著存在嚴重傷害或死亡的高風險。這次召回在美國影響了553台器材,始於2023年12月。
有爆炸風險--Panorama 1.0T HFO MRI系統召回: 2023年12月,由於在緊急冷卻程式中,氦氣壓力過大可能導致爆炸,該型號被召回。這種情況可能導致化學暴露、缺氧、組織損傷和機械創傷,包括嚴重傷害或死亡。這次同樣被歸為I級召回的召回在美國影響了150台器材,始於2023年11月。
03、 面對挑戰,飛利浦仍對未來飽含信心
在2023年的財報中,飛利浦的年度銷售額為181.7億歐元,同比增長6%。其核心業務仍表現出讓人欣喜的有機增長,其中診斷和治療業務實作了11%的增長。此外飛利浦還表示將積極解決剩余呼吸機召回問題,並且有信心從第三季度開始恢復增長。

飛利浦在2023年還面臨了營運和供應方面的挑戰,這些挑戰也影響了其業績表現,但飛利浦在研發上的投入持續增加,以支持創新和產品質素的提升。
綜上,盡管面臨挑戰但飛利浦透過專註核心業務增長和推動創新,以及積極應對召回問題和提升供應鏈韌性,仍然實作了銷售額的增長,並對未來的可持續增長保持樂觀態度。
也讓我們持續關註飛利浦相關產品的未來走勢,能否在2024年實作逆風翻盤。
▲文章來源:醫療器械創新網 ▲轉載請標註上方來源 聲明:本文僅作資訊傳遞之目的,僅供參考。










