近日,由中國與美國、澳洲研究人員組成的國際團隊在【細胞】雜誌上發表了一項研究成果,利用人工智能(AI)從全球微生物組中辨識到近100萬種潛在的抗菌肽(肽類抗生素),現已確認63種表現出對致病菌株的抑制效果。也就是說,新的抗生素可能因此被發現,以應對抗生素耐藥性這一全球性難題。
致病菌對抗生素產生耐藥性的主要原因是過度使用、誤用和不合理使用抗生素,最嚴重的後果是導致超級耐藥菌的出現。對此,世界衛生組織多次發出警告,如果這種情況持續下去,未來人類受到細菌感染時將無藥可用。知名科普作者張田勘介紹,全世界科研人員為此進行了諸多探索,並將主流研究方向集中在用人工智能篩選更多抗生素、研發有特定目標的「智能抗生素」、透過病毒(噬菌體)降低細菌致病力並阻止細菌產生耐藥性上,以期找到抗生素耐藥性的解決之道。
(1)AI助抗生素加速研發
抗生素耐藥性是一個全球性難題,是指微生物尤其是細菌耐受抗生素類藥物,從而使藥效打折扣甚至無效。
說到細菌耐藥,研究人員首先想到的是研發更多新藥,以避開細菌對老藥的適應和耐受。但新藥從研發到投入市場,通常需要10-20年時間和10億美元以上的研究經費。現在,有了人工智能的幫助,新型抗生素的研發也進入了快車道。
相對於青黴素等傳統抗生素,一類新型抗生素正受到科學家的青睞,這就是抗菌肽,又稱為抗菌蛋白、肽類抗生素或天然抗生素,它們通常是具有抗微生物活性的小分子短肽。其實在過去幾十年中,抗菌肽已成為強大的替代藥物,滿足了人們對新型抗感染藥物的需求,以克服日益嚴重的抗生素耐藥性問題。
現在,借助人工智能的機器學習方法,美國、中國和澳洲的聯合研究團隊在全球微生物組中,辨識出近100萬種潛在的抗菌肽。在選取其中有代表性的100種抗菌肽進行測試後,確認有79種具有體外活性、63種表現出對致病菌株的抑制效果,而且,這些致病菌株中有一些是超級耐藥菌。
在這項新研究中,研究團隊使用機器學習平台篩選包含微生物基因組數據庫在內的多個公共數據庫,分析了來自特定微生物的87920個基因組,以及來自環境樣本的63410個微生物基因組混合物。最終,鑒定出來的物質涉及地球上生活於72種不同棲息地的微生物,其中,土壤/植物中的微生物占36.6%,水中的微生物占24.8%,人類腸道中的微生物占13%。
透過人工智能的幫助,研究人員鑒定了863498個候選抗菌肽,其中90%以上以前從未被描述過。為了驗證這些發現,研究人員合成了100種抗菌肽,並測試了它們對11種致病菌株的作用,如金黃色葡萄球菌(含有耐藥菌耐甲氧西林菌株)、鮑曼不動桿菌、肺炎克雷伯菌、大腸桿菌(含有一種耐粘菌素菌株)、銅綠假單胞菌、萬古黴素耐藥菌株糞腸球菌和屎腸球菌。
試驗結果表明,有63種抗菌肽能完全抑制至少一種致病菌株的生長,有些抗菌肽在濃度很低時仍然具有抗菌活性,與現在臨床使用的多粘菌素B和左氧氟沙星的抗菌效果相似。更令人鼓舞的是,一些耐藥菌對這些抗菌肽尤其敏感,比如,分別有39種、24種、21種和26種抗菌肽對鮑曼不動桿菌、大腸桿菌、萬古黴素耐藥菌株糞腸球菌和屎腸球菌表現出抑制活性。
有一個問題是,雖然這些新篩選出來的抗菌肽對很多細菌有抑制作用,但是它們也與過去的抗生素一樣,不具有專一性,會對很多細菌或所有細菌具有殺滅作用。這也意味著,新抗菌肽一旦研發出來用於臨床,可以在一段時間內對抗耐藥菌,但由於它們具有廣譜性,會無差別殺滅細菌,所以未來依然可能讓細菌產生新的耐藥性。
(2)「智能抗生素」可選擇性打擊致病菌
除了尋找新的抗生素外,解決細菌耐藥的另一個重要舉措是讓抗生素具有專一性,而非廣譜性,如此既能避免抗生素「濫殺無辜」,又能防止更多細菌產生耐藥性。研究人員正在尋找和研發「智能抗生素」,只抑制和殺滅少數致病細菌,而不傷害其他對人和生物無害的微生物。
在現實生活中,革蘭氏陰性菌引起的感染越來越普遍,引發的疾病包括肺炎、腹膜炎、泌尿道感染、血液感染、傷口或手術部位感染、腦膜炎等。對於大腸桿菌、變形桿菌、沙門氏菌、克雷伯氏菌、綠膿桿菌等革蘭氏陰性菌導致的感染,臨床通常采用廣譜抗生素治療,但這樣做不可避免地會對腸道微生物組造成破壞,且容易產生繼發感染,從而讓革蘭氏陰性菌變得越來越耐藥。
現在大多數抗生素的靶點都是革蘭氏陰性菌和革蘭氏陽性菌(如芽孢桿菌、李斯特菌、葡萄球菌和鏈球菌等)所共有的。由於腸道微生物群中本就含有許多革蘭氏陰性菌,不加選擇地使用抗生素(如粘菌素),除了導致細菌耐藥外,還可能引發嚴重的腸道生態失調。耐藥的原因不外乎幾種:天生就對某些抗生素耐藥、從已耐藥的細菌中獲得基因轉移而耐藥、基因突變導致耐藥。所以,研究人員希望針對革蘭氏菌的耐藥性研發新的非廣譜抗生素。
研究人員把目標轉向研發「智能抗生素」。美國伊利諾大學的研究團隊研發了一種新型抗生素洛拉米星(Lolamicin),這是一種能靶向脂蛋白轉運系統的革蘭氏陰性特異性抗生素。初步試驗結果表明,洛拉米星對130多種耐多藥的細菌具有抑制活性,並對小鼠的急性肺炎和敗血癥感染顯示出療效。暴露於抗生素耐藥細菌後出現血液感染的小鼠,在給予洛拉米星後全部存活,沒有接受洛拉米星治療的小鼠有87%在3天內死亡。而且,對小鼠使用洛拉米星後,其腸道微生物組還保留了下來,因此能防止因腸道微生物菌群失衡而導致的艱難梭菌繼發感染。
革蘭氏陰性菌的外膜由脂多糖、磷脂、外膜蛋白和脂蛋白等成分組成,是細菌抵禦外界有害物質的主要物理屏障,與細菌致病性和耐藥性密切相關。細菌外膜各成分依韋特定的系統進行跨膜轉運,包括脂多糖轉運系統、脂質不對稱維持系統、β-桶狀裝配機器及脂蛋白定位系統等,這些系統能夠保證細菌外膜的完整與穩定,被視為維持細菌生命活動的命門。換句話說,任何破壞細菌命門的物質都有可能成為抵禦革蘭氏陰性菌的藥物。
洛拉米星的作用原理就是瞄準細菌的脂蛋白定位系統,這個系統是細菌外膜的重要組成部份,對各種革蘭氏陰性菌至關重要。研究人員評估了洛拉米星對臨床多重耐藥菌株,如大腸桿菌、肺炎克雷伯菌和陰溝腸桿菌的療效,並與其他藥物進行了比較。與臨床一線抗生素安默西林和古連黴素相比,洛拉米星對腸道微生物組的影響最小。同時,與對照組相比,使用洛拉米星的小鼠腸道中的艱難梭菌容易清除,而使用安默西林或古連黴素的小鼠無法清除艱難梭菌。這些情況表明,安默西林等常見抗生素會嚴重破壞動物的腸道微生物組,導致艱難梭菌感染,洛拉米星則不會引起腸道微生物組的顯著變化,能使小鼠免於艱難梭菌感染。
以上研究結果表明,洛拉米星是一種比較專一的特異性抗生素,有可能最大限度地減少對腸道微生物群的損害,並能預防繼發性感染,從這個角度看,符合「智能抗生素」的條件。不過,洛拉米星只是在動物試驗中體現出了「智能」藥效,在人體中是否有效還需進行人體試驗的驗證,如果能獲得同樣的結果,便有望在未來進入臨床使用。屆時,洛拉米星這樣的「專一」抗生素將比目前臨床使用的廣譜抗生素有更大優勢,能選擇性地殺死致病細菌,而不會殺死非致病細菌、破壞腸道菌群的平衡。
(3)解除細菌耐藥性還有新路徑
致病菌對抗生素產生耐藥性的另一個重要原因是細菌的基因適應了某些常用藥物。比如,針對青黴素,有的細菌發展出了抗藥基因,並且把這種耐藥基因傳遞給了後代(垂直傳遞),同時,這種抗藥基因也可透過基因載體(特別是質體)攜帶,水平轉移到其他細菌,引起更多的細菌耐受抗生素。此外,細菌耐受抗生素的機理還包括細菌膜對該抗生素的抗滲性;細菌對滲入抗生素的外排;透過對作用靶點的定量或定性修飾,降低抗生素與細菌靶點的親和力;利用細菌酶使抗生素失活等。因此,科研人員只要找到上述機理的突破口,就可以破解抗生素耐藥性的難題。
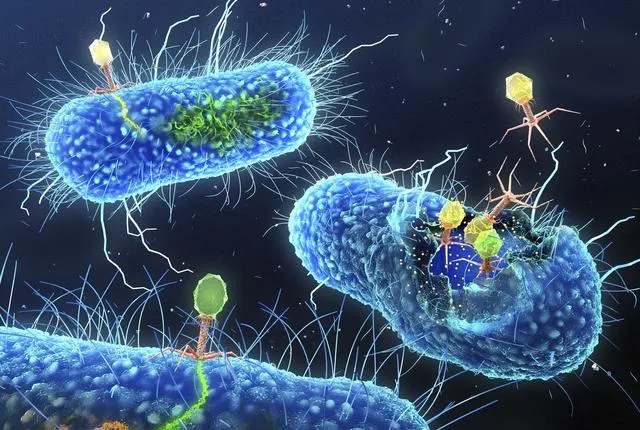
現在,美國德薩斯農工大學的一個研究小組發現,使用侵襲細菌的病毒(噬菌體)可以讓細菌失去耐藥性,它還可以當成抗生素來使用,以抑制細菌的活性。這一結論基於對銅綠假單胞菌的研究。
銅綠假單胞菌是一種可以引起血液、肺部感染的細菌,也是目前比較頑固的耐藥菌之一。人類是銅綠假單胞菌的宿主之一,細菌通常寄宿在人的腋窩和生殖器等部位,引起多種感染和疾病,如輕微的外部感染(耳朵或毛囊感染)、嚴重的內部感染(肺、血液、心臟瓣膜感染)。耐抗生素假單胞菌感染的流行,使得研究人員高度關註如何對付這種耐藥菌。研究人員發現,銅綠假單胞菌之所以耐藥,是因為它們彼此之間能傳播抗藥基因,並四處移動,導致更多的銅綠假單胞菌內形成難以被抗生素突破的生物膜結構。其中,一種被稱為菌毛的附屬物能幫助銅綠假單胞菌產生耐藥性,並傳播耐藥基因。
有意思的是,有的病毒可以透過附著於銅綠假單胞菌的菌毛而感染細菌。研究人員利用熒光顯微鏡、低溫電子顯微鏡和計算模型觀察了一種名為PP7的病毒(噬菌體)是如何吞噬細菌的。PP7沾在菌毛上後,菌毛收縮並將其拉到細胞表面。在病毒進入的地方,菌毛會彎曲並折斷,菌毛的遺失使銅綠假單胞菌感染宿主的能力大大降低。病毒感染銅綠假單胞菌後,會讓後者的菌毛彎曲並遺失,這意味著,利用特定的病毒感染細菌,不僅能使細菌失去致病性,還會讓細菌失去耐藥性,因為細菌的菌毛可以在細菌之間傳遞耐藥基因。
截至目前,研究人員已發現銅綠假單胞菌、大腸桿菌和不動桿菌3種細菌可以被特定病毒感染、損害菌毛,從而抑制細菌感染人和傳遞抗藥基因的能力。種種跡象表明,治療細菌感染不是只有抗生素這一條路,也可讓噬菌體解除細菌的武裝(如損壞其菌毛),使細菌失去感染宿主的能力。減少抗藥基因透過菌毛在細菌之間傳遞,以降低細菌的耐藥性,也便於醫生用較低劑量的抗生素來治療疾病。
面對抗生素耐藥性這個全球性難題,人工智能篩選抗生素、研發「智能抗生素」、采用病毒(噬菌體)抑制細菌等主流研究方向目前取得的研究進展雖然尚處於動物試驗階段,但至少為人類解決抗生素耐藥性提供了切實可行的路徑和方向,值得繼續探索。
(供圖:視覺中國)











