*僅供醫學專業人士閱讀參考


今日,英國列斯大學科學團隊在【自然】雜誌發文, 研究者們利用冷凍光電聯用(cyto-CLEM)技術,首次完成了阿爾茨海默病(AD)患者腦內β澱粉樣蛋白(Aβ)沈積和tau蛋白纏結的原位成像,精度達到2.38Å。 此前,我們只能將病理蛋白提純後進行成像分析,並不了解它們處於病生理環境中的形態。
研究結果顯示,Aβ細絲排列相當「隨意」,具有分支結構,其間還夾雜著細胞外囊泡、液滴、膜碎片等細胞成分;相對的,tau蛋白細絲則排列得非常整齊,能纏出這麽規整「線團」的人肯定是個強迫癥。
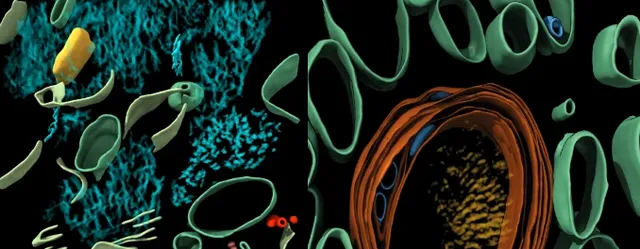
左Aβ(藍綠色),右tau(橙紅色)

論文題圖
此前已經有不少透過冷凍電鏡技術解析Aβ和tau結構的研究,但那些研究采用的樣本普遍是從AD患者或模式動物大腦內提純的蛋白。這雖然讓結構分析變得更容易,但卻不能百分百代表這些蛋白在AD腦內實際的結構狀態,而我們知道,蛋白結構對其功能的意義非常重要。
為了確認復雜大腦內Aβ和tau的位置,研究者使用了能夠結合澱粉樣蛋白的熒光標記物甲氧基-X04(MX04),再透過cyto-CLEM來完成成像。
分析樣本來自一位70歲的女性AD患者,她在54歲時出現記憶問題,58歲確診癡呆,在進行性癡呆12年病史時經神經病理學確診AD。該患者沒有癡呆家族史,基因型為 APOE3/3 。
病理分析顯示,該患者的顳中回含有豐富的澱粉樣斑塊、tau纏結/細絲、少量的腦澱粉樣血管病理,不存在其他常見神經退行性疾病相關的病理學。
腦樣本在患者死後約6小時取出經液氮急凍保存。這種保存方式會產生冰晶,所以研究者們將其解凍後,在高壓下進行-188℃急凍,制備成70nm的薄片,以符合cyto-CLEM的成像要求。
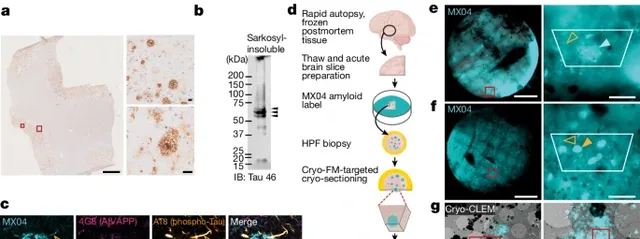
實驗過程
乍一看去,Aβ斑塊內的原纖維排列成平行的陣列或晶格,與研究者們之前分析FAD小鼠腦內蛋白斑塊結構比較一致。 可見Aβ細絲存在分支和交叉,方向不受相鄰細絲影響,Aβ細絲間還散布著細胞外囊泡、液滴、70-200nm大小的長方體顆粒和膜碎片。
研究者認為膜碎片可能是大腦樣品凍融導致的。對小鼠大腦進行凍融後成像,也能觀察到類似的膜碎片,但如果直接高壓冷凍切片就沒有膜碎片。
至於那些神秘的長方體顆粒,研究者發現它內部表現出高密度的間隔條紋,令人聯想到一些脂蛋白顆粒,但真相不明。
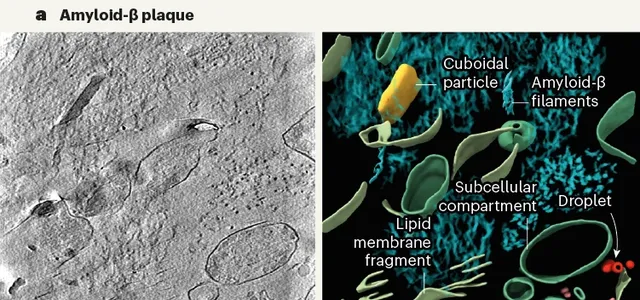
左電鏡,右重建3D
tau細絲則排列成300-800nm的平行簇,相鄰細絲以相同的方向和極性排列在一起。 研究者在神經突的細胞質和有髓軸突中發現了tau沈積,但在細胞外也發現了一簇這種蛋白,不知道是不是樣品制備導致的。
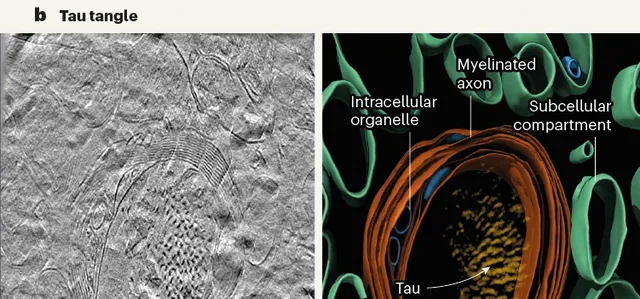
左電鏡,右重建3D
此前有研究發現,AD中的tau細絲存在成對的螺旋細絲和直細絲兩種形態,在本研究的分析結果中,兩種形態的tau細絲也不會混合,而是更傾向於同類別排列在一起。
研究者認為,這是tau細絲之間的極性相互作用導致的非隨機排列,而Aβ細絲由於較小,可能不足以實作類似的相互作用。
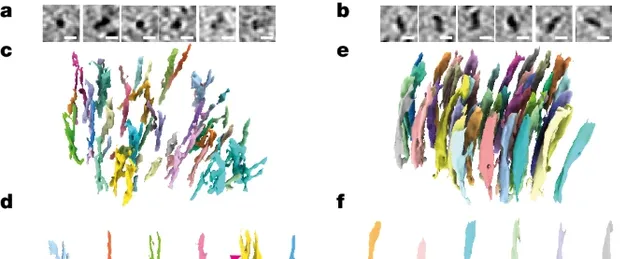
Aβ(左)tau(右)細絲的排列形態
研究者認為,這項研究使用的技術也可以用於分析其他神經退行性疾病中的絲狀病理蛋白,最起碼tau蛋白就在皮質基底節變性、進行性核上性麻痹等疾病中有關鍵作用。也有研究發現,在不同的神經退行性疾病中,tau病理的結構是不同的。
這些發現將為開發疾病模型、研究疾病潛在分子機制和開發新療法提供有力的工具。
參考資料:
[1]https://www.nature.com/articles/s41586-024-07680-x
[2]https://www.nature.com/articles/s41586-024-07680-x

本文作者丨代絲雨











