引言
光遺傳學(optogenetics) ,一門結合了光學和遺傳學的前沿學科,正在以其獨特的方式重塑我們對細胞內過程的理解和控制。 透過利用光敏蛋白,研究人員能夠精確地操縱細胞內的特定分子,實作對細胞行為的精確控制 。這種技術不僅為基礎生物學研究提供了強有力的工具,也為臨床治療,尤其是神經科學和細胞治療等領域,開辟了新的可能。
在細胞生物學的微觀世界裏,單個分子的行為對細胞功能的影響至關重要 。傳統的生物學研究方法往往關註於大量分子的平均效應,而忽略了單分子層面的動態變化和異質性。 光遺傳學的出現,使得研究人員能夠對單個分子進行精確的時空控制,從而揭示其在細胞內的具體作用和調控機制 。然而, 如何在不幹擾細胞自然狀態的前提下實作單分子的精確釋放,仍是一個巨大的挑戰 。 3月8日 Nature Methods 報道了該領域的最新進展「 An optogenetic method for the controlled release of single molecules 」。
Highlights
該研究 開發了一種新的光遺傳學(optogenetics)方法,用於在活細胞中控制單分子(single molecule)的釋放。研究團隊 透過結合一種可光解的蛋白質(photocleavable protein)實作了這一目標,這種蛋白質在近紫外光(near-ultraviolet light)照射下會發生裂解,從而釋放繫結的目標分子 。
這項技術的關鍵創新之處在於,它 可以精確控制細胞內功能性單分子的釋放,並允許研究人員在單分子水平上觀察和分析蛋白質在活細胞中的行為 。透過這種方法,研究人員能夠在細胞質和細胞膜上進行單分子成像(single-molecule imaging),大大簡化了對任何蛋白質在活細胞中的單分子顯微鏡(single-molecule microscopy)研究的可及性。
此外,這種技術還展示了 透過控制釋放的方式重構離子通道導電性(ion channel conductance)和恢復敲除細胞中的訊號通路(signaling pathway)的潛力 。透過釋放一種在敲除細胞中缺失的關鍵激酶,研究者成功地重建了免疫細胞中的訊息傳遞通路。
這項研究為單分子水平上研究細胞功能提供了一個強大的新工具,並可能對未來的生物學和醫學研究產生重要影響。
Strategies
設計和構建光解蛋白復合體(Photocleavable Protein Complex): 研究團隊首先構建了一個含有光解蛋白PhoCl的復合體。 PhoCl 是一種在 近紫外光(near-ultraviolet light)照射下可以發生裂解的綠紅色光轉換蛋白(photoconvertible protein) 。 這種裂解將切斷肽鏈,從而釋放與其相連的目標蛋白(target protein) 。
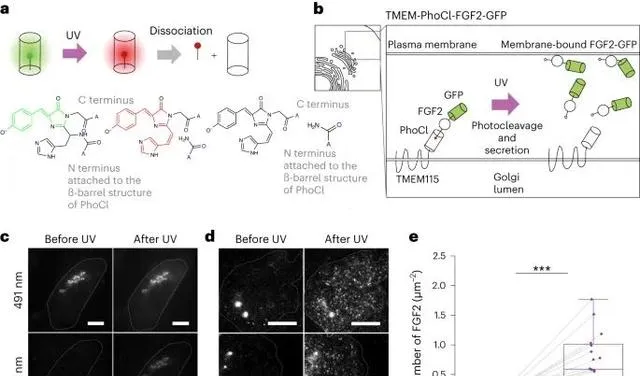
透過 PhoCl 蛋白進行光控制的方法,用來釋放細胞中的胞漿蛋白 FGF2-GFP。這一過程透過 PhoCl 蛋白的光解活性來實作,即在近紫外光的啟用下,PhoCl 蛋白被光解,導致與其連線的目標蛋白(在這個例子中是 FGF2-GFP)從胞器(如高基氏體)釋放到胞漿中。 這個方法允許研究者以光劑量依賴的方式,將功能性蛋白以適合單分子成像的量傳遞到細胞質和質膜中,從而簡化了對活細胞中任何蛋白質的單分子顯微鏡技術的要求。 (Credit: Nature Methods )
融合目標蛋白和錨定蛋白(Protein Fusion and Anchoring): 然後,研究者將目標蛋白與PhoCl融合,並進一步與位於高基氏體(Golgi apparatus)的錨定蛋白(anchoring protein)相連線。這樣,目標蛋白在未經光解之前被限制在高基氏體。
近紫外線照射(Near-Ultraviolet Illumination): 在實驗中,研究者透過短暫的近紫外光脈沖照射細胞,觸發PhoCl的裂解,導致與其融合的目標蛋白從高基氏體釋放到細胞質或細胞膜。
單分子成像(Single-Molecule Imaging): 釋放的目標蛋白可用於單分子成像研究。研究者利用這種方法,能夠在單分子水平上觀察和分析蛋白質在活細胞中的行為和功能。

使用 PhoCl 蛋白的光解活性來控制跨膜蛋白 CD4 的釋放。研究人員構建了一個含有 mScarlet-CD4、PhoCl 和 Golgi-定位蛋白 RER 的融合構建物。這個構建物被錨定在高基氏體上。在紫外光照射下,PhoCl 蛋白發生光解,導致與其連線的 CD4 蛋白從高基氏體釋放,並被運輸到細胞膜上。透過使用 TIRF 顯微鏡技術,可以觀察到單分子層面上 mScarlet-CD4 的動態。這個過程展示了如何利用 PhoCl 蛋白實作對跨膜蛋白功能和定位的光學控制,從而促進對細胞膜蛋白功能的單分子研究。 (Credit: Nature Methods )
功能性研究(Functional Studies): 除了觀察蛋白質的行為,研究者還利用這一技術研究了蛋白質的功能,如離子通道導電性(ion channel conductance)的重建和訊號通路(signaling pathways)的恢復。
Behind the Scenes
光遺傳學釋放單分子的工作原理
光敏蛋白的設計和原理
光遺傳學技術的核心在於光敏蛋白的設計和套用,這些特殊的蛋白質能夠響應特定波長的光照而發生結構上的改變,從而實作對細胞內過程的精確控制。光敏蛋白的設計靈感多源自自然界中的光感受器,如綠藻中的ChR2(通道藍藻蛋白-2),其能夠在藍光照射下開啟離子通道,控制細胞內的電位變化。
光敏蛋白的種類
光敏蛋白大致可以分為兩類: 一類是作為離子通道或泵,在光照下直接影響細胞的膜電位和內部離子濃度 ; 另一類則透過光誘導的結構變化,啟用或抑制特定的生物分子,進而影響細胞內的訊號傳遞路徑 。這兩種機制各有優勢,選擇哪一種取決於研究目的和物件。
設計原理
光敏蛋白的設計通常基於自然界中存在的光感受蛋白。透過基因工程技術,研究人員對這些天然蛋白進行改造,以適應特定的實驗需求。例如,透過改變光敏蛋白的胺基酸序列,可以調整其對光的敏感波長,從而實作對光訊號的精確控制。
光敏蛋白的設計要考慮多個因素,包括光敏蛋白對 光的敏感度、啟用和關閉的速度、以及是否易於被細胞表達和容納 。此外,為了實作更精細的控制,研究人員還在不斷開發新的光敏蛋白變體,以適應不同波長的光照和不同類別的細胞。
在實際套用中,光敏蛋白通常透過遺傳工程的方式引入目標細胞,與特定的生物分子融合,形成一個能夠響應光照的融合蛋白。當受到特定波長的光照射時,融合蛋白發生構象變化,啟用或釋放與之結合的生物分子,從而實作對細胞功能的調控。
短脈沖光源的作用機制
在光遺傳學領域,短脈沖光源的套用是實作精確控制單分子釋放的關鍵技術之一。
短脈沖光源
短脈沖光源指的是能夠產生極短時間持續的光脈沖的光源,其持續時間通常在皮秒(10^-12秒)到飛秒(10^-15秒)範圍內 。這種短暫而強烈的光照能夠精確地啟用目標光敏蛋白,而不對細胞造成熱損傷或其他不利影響。
啟用機制
當短脈沖光照射到光敏蛋白上時,光能被吸收,引發光敏蛋白的構象變化。這一變化觸發了蛋白質內部的一系列生物化學反應,最終導致與其結合的目標分子的釋放。這一過程的精確性和快速性是透過控制光脈沖的持續時間、強度和波長來實作的。
光脈沖參數的調控
持續時間: 短脈沖的持續時間直接影響光敏蛋白的啟用效率,過短可能無法有效啟用,過長則可能引起非特異性啟用或細胞損傷。
強度: 光脈沖的強度需精確控制,確保足夠的能量達到光敏蛋白,實作有效啟用。
波長: 選擇適合光敏蛋白吸收特性的光脈沖波長是實作特異性啟用的關鍵。
短脈沖光源在光遺傳學中的套用,極大地拓寬了單分子研究的可能性。透過精細調控光脈沖參數,研究人員能夠在空間和時間上精確控制單分子的行為,從而深入理解其在細胞生命活動中的作用。
高基氏體 的特殊作用
在細胞生物學中,高基氏體 是細胞內重要的器官之一,負責蛋白質的修飾、排序和運輸。在光遺傳學釋放單分子的過程中,高基氏體 發揮著不可或缺的作用,成為實作精確控制單分子釋放的關鍵環節。
高基氏體 的基本功能
高基氏體 由一系列平行排列的膜囊組成,它不僅是細胞內蛋白質加工的車間,也是蛋白質分泌的中轉站。在光遺傳學套用中,研究人員利用高基氏體 的這些天然功能,為單分子的定位和釋放提供了理想的平台。
在光遺傳學中的套用
透過將光敏蛋白和目標分子共同定位到高基氏體 ,可以實作對目標分子的嚴格控制。當受到特定波長光照的啟用後,光敏蛋白引發的結構變化能夠觸發目標分子從高基氏體 釋放到細胞內其他位置,或是分泌到細胞外。這一過程的精確度極高,幾乎不受其他細胞內過程的幹擾。
特殊作用的機制
定位精確性: 高基氏體 的特殊結構為光敏蛋白和目標分子提供了獨特的微環境,有助於提高定位的精確性。
釋放控制: 光敏蛋白在高基氏體 的啟用可以透過細胞內訊號傳遞路徑精確控制,從而實作對目標分子釋放時間和位置的精確控制。
功能多樣性: 高基氏體 內的不同區域具有不同的生化環境,可以根據目標分子的特性選擇最適合的區域進行定位和釋放。
高基氏體 在光遺傳學釋放單分子中的特殊作用,不僅為單分子研究提供了新的方法,也為細胞內物質運輸和分泌機制的研究開辟了新的路徑。隨著對高基氏體 功能的深入了解和光遺傳學技術的不斷發展,未來將有望在更多生物醫學領域中發揮重要作用。
單分子成像技術的創新套用
單分子成像技術是一種能夠觀察和分析生物分子在單分子水平上行為的先進技術,為研究人員提供了研究細胞內復雜過程的新視角。該技術透過高靈敏度的光學器材和精細的實驗方法,捕捉到單個分子的動態變化,揭示了許多傳統宏觀實驗無法觀察到的生物現象。
光學系統的關鍵元件
高效能顯微鏡: 具有高分辨率和高訊噪比的顯微鏡是實作單分子成像的基礎器材,能夠精確捕捉到單個分子的影像。
激光光源: 用於提供穩定且具有特定波長的光照,激發標記在目標分子上的熒光標簽。
高靈敏度探測器: 如雪崩光電二極管(APD)或電子放大CCD相機,用於檢測極低強度的熒光訊號。
熒光標記的作用
在單分子成像技術中,熒光標記的選擇至關重要。研究人員通常將熒光分子或熒光蛋白質標記到研究的目標分子上。當這些標記分子被激光激發後,會發出熒光,從而使目標分子在顯微鏡下可見。
成像技術的類別
熒光相關光譜(FCS) : 透過分析熒光強度隨時間變化的關聯函數,了解分子的擴散行為和濃度。
光學鑷子: 利用激光束捕獲和操縱微小物體,用於研究單個分子的力學性質。
單分子熒光共振能量轉移(smFRET): 透過測量兩個熒光分子間能量轉移的效率,研究分子間的距離和相互作用。
數據分析與解釋
單分子成像產生的數據量龐大且復雜,需要運用高級的影像處理軟件和統計方法進行分析。透過這些分析,研究人員能夠從單個分子的行為中提取出有關分子動態、相互作用和功能的重要資訊。
光遺傳學方法在單分子成像中的套用
光遺傳學方法在單分子成像領域的套用,標誌著生物醫學研究進入了一個嶄新的時代。透過精確控制光敏蛋白的活性,研究人員能夠在單分子水平上觀察和操縱生物分子的行為,從而深入理解細胞內復雜的生命過程。
光遺傳學與單分子成像的結合
目標分子的精確操控: 透過將光敏蛋白與特定的目標分子相結合,光遺傳學技術能夠實作對這些分子在細胞內位置和時間的精確控制。
高時空分辨率的觀察: 利用短脈沖光源啟用光敏蛋白,研究人員可以在極短的時間尺度內觀察分子的動態變化,提供高於傳統顯微鏡技術的時空分辨率。
套用
單分子追蹤: 透過光遺傳學技術,研究人員能夠標記並追蹤單個蛋白質或RNA分子在細胞內的移動路徑,揭示其在細胞生命活動中的作用。
細胞訊號傳遞研究: 透過控制特定訊號分子的釋放,光遺傳學方法可以用於研究細胞內的訊號傳遞過程,如神經遞質的釋放和受體的啟用。
細胞間相互作用: 利用光遺傳學操縱單個分子的行為,研究人員可以研究細胞間的相互作用,如免疫細胞辨識和腫瘤細胞侵襲的機制。
實驗中一般會遇到的挑戰和解決方案
單分子成像技術在光遺傳學中的套用雖然為生物學研究提供了前所未有的細致視角,但在實驗過程中也面臨了不少挑戰。
挑戰一:熒光標記的穩定性
在單分子成像實驗中,熒光標記的穩定性是一個常見的問題。熒光分子可能會因光照而光解或猝滅,導致訊號的遺失。
解決方案:
-使用光穩定性更好的熒光分子或熒光蛋白。
-最佳化光照條件,如降低激光強度、縮短照射時間。
-套用熒光恢復技術,如光漂白後的熒光恢復。
挑戰二:背景噪音的幹擾
單分子成像需要極高的訊噪比,而細胞內雜質和其他熒光物質的存在常常造成背景噪音,影響觀察精度。
解決方案:
-提高顯微鏡的空間分辨率,采用超分辨顯微技術。
-使用更為特異的熒光標記,減少非特異性結合。
-套用先進的影像處理軟件,透過演算法減少背景噪音。
挑戰三:樣本制備的困難
要保持單個分子在自然狀態下的活性和功能,同時使其能夠被顯微鏡準確捕捉,是一項極具挑戰的任務。
解決方案:
-最佳化樣本制備流程,減少對分子活性的影響。
-開發新型的化石相容性載體,以更好地支持和保護樣本。
-利用活細胞成像技術,減少樣本制備對細胞狀態的幹擾。
挑戰四:數據量巨大的處理與分析
單分子成像技術產生的數據量龐大,且數據的處理和分析十分復雜,給研究者帶來了巨大的挑戰。
解決方案:
-開發更為強大和高效的數據處理軟件,提高數據處理的自動化和智能化水平。
-采用雲端運算和大數據技術,提高數據處理和儲存的能力。
-引入機器學習和人工智能技術,提升數據分析的準確性和效率。
光遺傳學方法在細胞功能重建中的套用
BK和LRRC8離子通道的重建
在細胞生理學中,BK和LRRC8離子通道扮演著至關重要的角色,它們參與調節細胞的電位平衡、體積控制以及訊號傳遞等多個重要生理過程。透過光遺傳學技術,研究人員現在能夠在分子層面上重建這些關鍵的離子通道,從而為疾病治療和生命科學研究開辟了新的道路。
BK離子通道的重要性
電生理功能: BK離子通道是一種大導電的鉀通道,能夠響應細胞內鈣離子濃度的變化及膜電位的變化,從而調節神經元的興奮性和肌肉細胞的收縮。
疾病關聯性: BK通道的異常與多種疾病如高血壓、哮喘和肌肉疾病等有密切聯系。
LRRC8離子通道的作用
細胞體積調節: LRRC8通道是一種體積調節陰離子通道(VRAC),在細胞遇到滲透壓變化時開放,參與細胞體積的調節。
參與細胞訊號傳遞: LRRC8通道還與細胞內訊號傳遞相關,包括細胞雕亡和細胞增殖等過程。
光遺傳學技術在離子通道重建中的套用
基因編碼的光敏蛋白: 研究人員利用基因編輯技術,將光敏蛋白與BK或LRRC8離子通道蛋白融合,透過光照控制其活性,實作離子通道的開關。
精確的時空控制: 透過調節光照的強度、持續時間和作用位置,光遺傳學技術能夠在極其精確的水平上模擬離子通道的自然調控機制。
功能重建與驗證: 重建後的離子通道能夠在體外細胞模型中進行功能性驗證,甚至在特定條件下套用於體內模型,為疾病治療提供新策略。
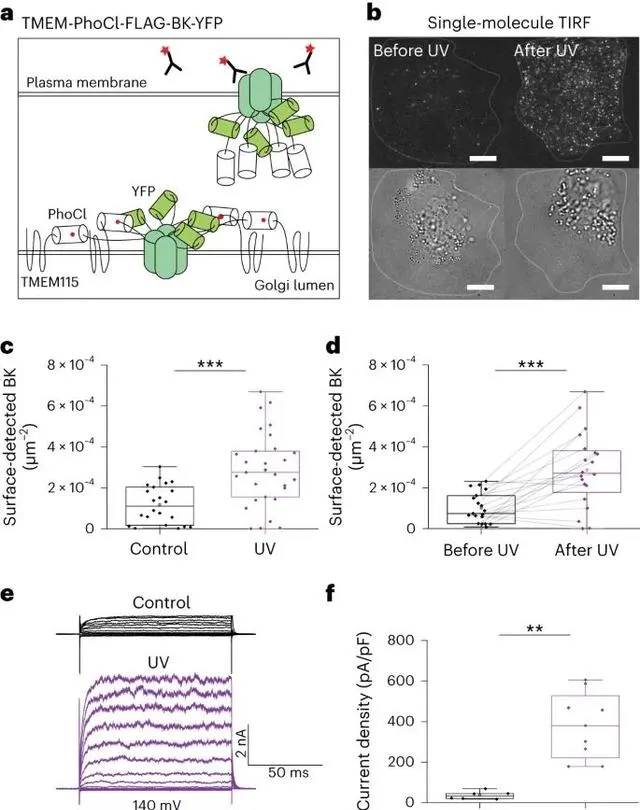
透過光遺傳學方法釋放BK通道的結果。BK通道是一種電壓門控和鈣感應的鉀通道,由四個相同的亞基組裝而成。在這項研究中,研究人員透過將BK通道的編碼序列透過PhoCl與TMEM115融合,實作了將其定位於高基氏體。隨後,他們使用405納米光進行短脈沖照射,觀察到表面傳遞的BK通道可以透過添加到培養基中的AF647偶聯抗體在TIRF顯微鏡下檢測到。相比之下,未經405納米照明的相同細胞中未檢測到這些通道。與此一致的是,電生理測量表明,與對照細胞相比,解封後的細胞出現了明顯增加的BK通道特征電流,但也觀察到對照細胞中存在基礎電流,表明存在輕微泄漏。因此,這項研究展示了一種控制釋放功能性離子通道和跨膜多亞基蛋白的系統。 (Credit: Nature Methods )
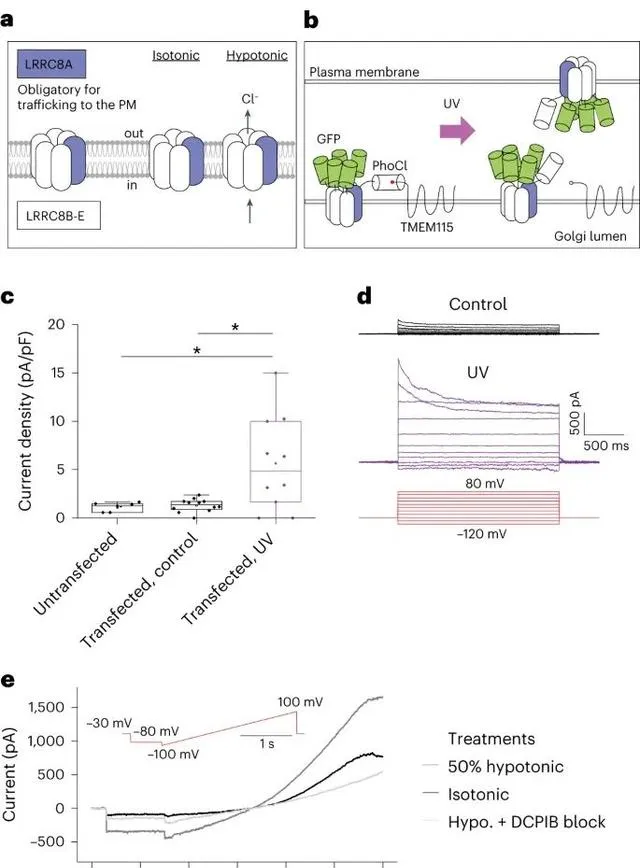
透過光遺傳學方法控制釋放體積調節陰離子通道(Volume-Regulated Anion Channels, VRACs)。這些通道通常在細胞體積變化時啟用,調節細胞內外的離子平衡。在這項研究中,研究人員使用光遺傳學工具控制特定蛋白質的釋放,進而實作對VRACs活動的精確控制,從而研究它們在細胞功能中的作用。 (Credit: Nature Methods )
NF-kB訊號通路的啟用
NF-kB訊號通路在細胞生存、免疫應答和炎癥反應中發揮著至關重要的作用。光遺傳學技術的發展為NF-kB訊號通路的精確啟用提供了新的策略,從而為研究其在疾病中的角色和開發新的治療方法提供了有力工具。
NF-kB訊號通路的生物學重要性
調節機制: NF-kB是一類能夠響應多種刺激的轉錄因子,透過調節下遊基因的表達,參與細胞生長、分化、雕亡和免疫反應等多個過程。
疾病相關性: NF-kB訊號通路的異常啟用與多種疾病的發生發展密切相關,包括炎癥性疾病、自身免疫疾病、心血管疾病以及癌癥等。
光遺傳學技術的套用
精準啟用: 透過將光敏蛋白與NF-kB訊號通路的關鍵分子相結合,利用光照控制其活性,實作對NF-kB訊號通路的精確啟用。
時空調控: 光遺傳學技術能夠在特定時間和特定細胞內啟用NF-kB訊號通路,為研究其在細胞功能中的作用提供了強大工具。
動態觀察: 利用即時成像技術,研究人員能夠觀察NF-kB訊號通路的啟用過程和動態變化,揭示其調控機制。
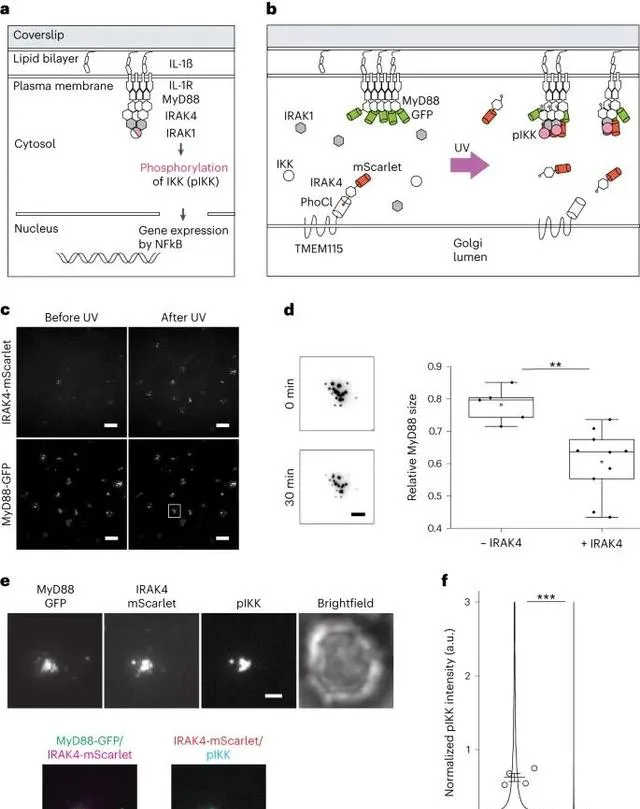
使用光遺傳學方法在敲除細胞中重新構建白細胞介素-1受體(IL-1R)訊號傳導通路。這一過程中,研究人員透過光遺傳學技術控制特定效應蛋白的釋放,來補償因基因剔除而失去的訊號分子,從而恢復IL-1R訊號傳導通路的功能。這種方法能夠在單個細胞水平上定量地研究訊號通路的組成和動態變化,對於深入理解細胞訊號傳導機制具有重要意義。 (Credit: Nature Methods )
方法的潛在限制和未來的改進方向
光遺傳學技術在細胞功能重建方面的套用雖然展現出巨大的潛力,但仍面臨一些技術和套用上的限制。
方法的潛在限制
光穿透深度: 光遺傳學操作通常需要外部光源啟用,但光在生物組織中的穿透能力有限,這在體內套用時尤為顯著。
細胞毒性: 長時間或高強度的光照可能對細胞產生毒性,影響細胞的生存和功能。
表達水平的控制: 光敏蛋白在細胞中的表達水平需要精確控制,過低的表達水平可能導致訊號弱,而過高則可能產生非特異性效應。
響應速度: 目前的光敏蛋白啟用和關閉的動態範圍與自然生物過程相比仍有差距,限制了其模擬細胞內復雜動態過程的能力。
未來的改進方向
深部組織光照技術: 開發新型光照技術,如近紅外光啟用或雙光子光遺傳學,提高光在深部組織中的穿透能力。
減少細胞毒性: 透過最佳化光照參數和光敏蛋白設計,降低光照對細胞的毒性,保證細胞功能的完整性。
動態調控表達系統: 利用智能化的基因表現系統,實作對光敏蛋白表達水平的即時調控,以適應不同的實驗和治療需求。
快速響應光敏蛋白的開發: 設計和篩選新型光敏蛋白,具有更快的響應速度和更高的動態範圍,以更精確地模擬細胞內的生物過程。
多模態光遺傳學工具: 結合多種光遺傳學工具和訊號途徑,實作對細胞功能的多層次、多維度調控。
光遺傳學釋放單分子方法的未來展望
該方法在生物醫學研究中的潛力
光遺傳學釋放單分子方法作為一種前沿的生物技術,其在生物醫學研究領域內的潛力不容小覷。該技術透過精確控制單個分子的行為,為揭示細胞內復雜生物過程提供了強有力的工具。
促進疾病機制的理解
精確操控單分子: 利用光遺傳學技術,研究人員可以在特定時間和空間內精確操控單分子,從而深入研究分子在疾病發生發展中的作用。
揭示病理過程: 透過觀察和分析光遺傳學操控下的分子動態變化,可以揭示許多疾病的病理過程,如腫瘤發展、神經退行性疾病及免疫相關疾病等。
推動新藥物的開發
靶點驗證: 該技術能夠精確調控特定分子的活性,為藥物靶點的驗證提供了方便快捷的途徑。
藥效評估: 在光遺傳學的幫助下,可以即時觀察藥物對單個分子的影響,評估藥物的作用效果和機制。
改善細胞治療策略
細胞功能調控: 透過光遺傳學技術,可以精確調控細胞內關鍵分子的活性,為細胞治療提供了更為精準的策略。
提高治療效率: 利用該技術可以在細胞移植前對細胞進行預編程,增強其在治療中的功能表現,提高治療效率。
促進個人化醫療的發展
個人化治療: 光遺傳學釋放單分子方法能夠針對個體差異進行精確調控,為實作個人化醫療提供了可能。
早期幹預: 透過該技術,可以在疾病早期透過調控特定分子來進行幹預,防止疾病的進一步發展。
可能的技術創新和套用領域
隨著光遺傳學技術的快速發展,其在多個領域的套用前景日益廣闊。未來的技術創新和套用領域不僅將推動科學研究的深入,也將為臨床醫學、藥物開發以及生物制造等行業帶來革命性的變革。
技術創新的方向
高精度光控系統: 開發更為精確的光照控制系統,實作對單分子活動的細致調控,提高實驗的精確度和重復性。
多色光遺傳學: 透過引入多色光敏蛋白,實作對多個生物分子的同時控制,拓展光遺傳學的套用範圍。
微納光電整合: 結合微納技術和光電子技術,發展便攜式或可植入式的光遺傳學器材,為實驗和治療提供更多可能。
套用領域的拓展
精準醫療: 光遺傳學技術能夠實作對特定細胞或組織的精確調控,為個人化治療提供了新的策略,特別是在癌癥治療、神經系統疾病等領域。
神經科學研究: 利用光遺傳學技術精確操控神經細胞的活動,為研究神經網絡的功能、學習記憶機制以及神經退行性疾病提供了強大工具。
合成生物學: 在合成生物學中套用光遺傳學技術,控制合成生物系統中的基因表現,推動生物制造和生物能源的發展。
藥物篩選: 利用光遺傳學進行高通量藥物篩選,快速評估藥物對目標分子的作用效果,加速新藥的開發流程。
Q&A
什麽是光遺傳學釋放單分子方法?
光遺傳學釋放單分子方法是一種創新的科學技術,它結合了光遺傳學和單分子研究的優勢,透過光訊號精確操控和觀察生物分子。該技術利用特定波長的光來啟用細胞內的光敏蛋白,從而實作對單個分子的精準釋放和控制。
如何使用光遺傳學方法進行單分子成像?
-制備光敏標記分子:首先,需要將目標分子與光敏蛋白結合,形成可響應光啟用的復合體。
-選擇適宜的光源:根據光敏蛋白的特性選擇合適的光源,如激光,以啟用光敏蛋白。
-實施精準照射:使用光源對標記的分子進行定向照射,控制其在細胞內的釋放和活動。
-高分辨率成像:透過高級成像技術,如共聚焦顯微鏡或熒光顯微鏡,捕捉單分子的行為和位置。
光遺傳學釋放單分子方法在細胞功能研究中有哪些套用?
-細胞內訊號傳遞研究:解析細胞內復雜的訊號網絡和分子互作。
-生物分子動力學觀察:在單分子層面上,直觀觀察分子如何在細胞內移動和相互作用。
-病理機制探索:研究特定分子在疾病發生過程中的作用,有助於揭示疾病機制。
該方法在臨床套用中有何潛力?
-疾病診斷和治療:光遺傳學釋放單分子方法在早期診斷和精準治療方面顯示出巨大潛力,特別是在神經科學和腫瘤學領域。
-藥物開發:為藥物的靶點發現和作用機制研究提供了新的途徑,促進個人化醫療的發展。
-再生醫學:在組織工程和細胞療法等領域,精準控制分子的活動,為組織修復和再生提供了新的策略。
參考文獻
https://www.nature.com/articles/s41592-024-02204-x
Kashyap P, Bertelli S, Cao F, et al. An optogenetic method for the controlled release of single molecules. Nat Methods. Published online March 8, 2024. doi:10.1038/s41592-024-02204-x
責編 |探索君
排版|探索君
轉載請註明來源於 【生物探索】
End











