界面新聞記者 | 唐卓雅
界面新聞編輯 | 謝欣
信達生物的雙靶點減肥藥瑪仕度肽研發又有新進展。
1月9日早間,信達生物官微釋出文章稱,胰高血糖素樣肽-1受體(GLP-1R)/胰高血糖素受體(GCGR)雙重激動劑瑪仕度肽在中國超重或肥胖成人受試者中的首個III期臨床研究(GLORY-1)達成主要終點和所有關鍵次要終點。
也就是說,這款雙靶點減肥藥的三期臨床試驗獲得成功。
並且,信達生物稱,計劃近期向國家藥品監督管理局(NMPA)藥品審評中心(CDE)遞交瑪仕度肽減重適應癥的首個新藥上市申請(NDA)。目前,瑪仕度肽是國內研發進度最快的雙靶點創新藥。如果上市成功,瑪仕度肽將成為首個國產減重GCGR/GLP-1R雙靶點創新藥。
1月9日,信達生物股價開盤高漲5.61%,截至收盤漲1.96%,報39.05元/股。而今年開年以來,信達生物股價總體一路走低,1月2日至1月8日跌去了10.41%。
瑪仕度肽是信達生物與禮來制藥共同推進的一款GLP-1R/GCGR雙重激動劑。2019年8月,信達生物和禮來達成合作,在中國共同開發和商業化這款候選藥物。也就是說,信達生物僅有瑪仕度肽在國內的商業化權益。
目前,瑪仕度肽在中國超重或肥胖(GLORY-1和GLORY-2)受試者和2型糖尿病(DREAMS-1和DREAMS-2)受試者中的四項III期註冊研究正在進行中。此外,2023年12月26日,信達生物啟動了瑪仕度肽頭對頭司美格魯肽的III期臨床試驗,研究的人群為早期2型糖尿病合並肥胖患者。 其中,GLORY-1研究已經達成主要終點和所有關鍵次要終點。
具體來看,GLORY-1(NCT05607680)是一項在超重或肥胖受試者中評估瑪仕度肽的有效性和安全性的多中心、隨機、雙盲、安慰劑對照的III期臨床研究。研究入組610例受試者,隨機分配至瑪仕度肽4mg組、瑪仕度肽6mg組或安慰劑組,雙盲治療48周。
研究結果顯示,GLORY-1的兩個主要研究終點均順利達成:瑪仕度肽4mg和6mg組受試者治療32周後體重相對基線的百分比變化,以及體重相對基線下降≥5%的受試者比例均顯著優於安慰劑組;第48周時,瑪仕度肽組的減重療效較32周進一步提升。
此外,該研究所有關鍵次要終點均順利達成,與安慰劑相比,瑪仕度肽組體重相對基線下降≥10%和≥15%的受試者比例、以及腰圍等指標的改善均顯著優於安慰劑。
信達生物稱,雙盲治療期內,瑪仕度肽整體安全性良好,安全性特征與瑪仕度肽的既往臨床研究一致,未發現新的安全性訊號。
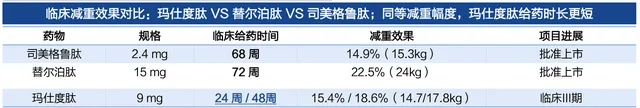
並且,2023年10月,信達生物曾公布瑪仕度肽II期臨床研究的數據,治療24周後,瑪仕度肽9mg組體重較基線的平均百分比變化與安慰劑組的治療差值達−15.4%。國金證券研報曾對比瑪仕度肽與替爾泊肽、司美格魯肽的臨床減重效果顯示,同等減重振幅下,瑪仕度肽的給藥時長更短。也就是說,單從各自的臨床試驗數據來看,瑪仕度肽的減重效果較替爾泊肽、司美格魯肽更好,不過考慮到並非頭對頭臨床試驗,這一比較的參考價值有限,而瑪仕度肽頭對頭司美格魯肽的III期臨床試驗仍在進行中。
此外,信達生物表示將在近期遞交瑪仕度肽減重適應癥的首個新藥上市申請(NDA)。目前,國內尚無雙靶點減肥藥上市。
從國內的GLP-1減肥藥競爭格局來看,國內華東醫藥的利拉魯肽生物類似藥和仁會生物的貝那魯肽註射液已經獲批減重適應癥。但是這兩款減肥藥都是GLP-1單靶點藥物,相較而言,瑪仕度肽的雙靶點激動劑效果更優。
國內在研的雙靶點減肥藥還包括博瑞生物的BGM0504、盛迪醫藥(恒瑞醫藥子公司)的HRS9531、華東醫藥的HDM1005等。不過,這幾款產品的研發均未到Ⅲ期。2023年7月博瑞生物的BGM0504Ⅱ期臨床獲倫理批件,盛迪醫藥的HRS9531尚處於臨床Ⅱ期,2023年12月22日華東醫藥的HDM1005臨床申請獲受理。相較而言,瑪仕度肽的進度遙遙領先。
對於信達生物而言,瑪仕度肽極有可能成為繼PD-1抑制劑信迪利單抗之後的又一業績增長點。2023年三季度報告顯示,信達生物前三季度實作約41億元的總產品收入,而達伯舒(®信迪利單抗註射液)前三季度銷售額約為2.8億美元(約20.05億元),約占信達生物總營收的一半。
但在信迪利單抗之後,誰能撐起信達生物的業績?正處於風口上的瑪仕度肽被寄予厚望。2023年第三季度,替爾泊肽全球銷售額達29.58億美元;2023年前三季度,司美格魯肽銷售額達142億美元。兩款減肥藥的熱賣引發了市場的無限想象,東北證券曾預測,瑪仕度肽在2025年的銷量將達到20億元。











