撰文 | Biu
腸道內復雜的微生物群落與宿主相互作用,調控免疫、代謝和社會行為,從而影響人類健康。腸上皮屏障是維持黏膜免疫必不可少的屏障,腸道中的常駐免疫細胞和上皮細胞能夠分泌免疫球蛋白、抗菌蛋白和細胞因子等來調節腸道微生物。
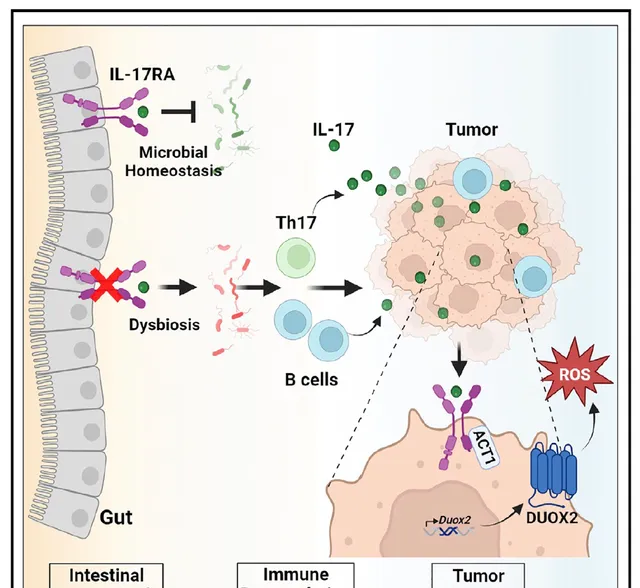
其中,腸道中的白細胞介素-17 (Interleukin-17, IL-17 ) 家族是一類促炎細胞因子,可由腸道共生微生物促進分泌,並透過IL-17-IL-17RA (Interleukin-17 receptor A,IL-17RA) 訊號通路調節腸道內穩態。有研究表明,IL-17訊號通路與 胰腺導管腺癌 (Pancreatic ductal adenocarcinoma, PDAC ) 的發生相關,能夠調控其免疫抑制和腫瘤微環境重塑。此外,有文獻報道,腸道菌群也會影響PDAC等腫瘤的進展。鑒於已知的 IL-17-IL-17RA在維持腸道內穩態中具有重要作用以及其與PDAC等腫瘤的相關性,那麽,腸道 IL-17-IL-17RA訊號是否能透過調控微生物影響遠端腫瘤發生呢?該科學問題及其分子機制目前尚未得到解決。
近日,來自美國德克薩斯大學MD安德森癌癥中心的 Florencia McAllister 團隊在 Cancer Cell 雜誌上發表了文章 Gut epithelial Interleukin-17 receptor A signaling can modulate distant tumors growth through microbial regulation ,該研究 以全身和腸上皮缺失IL-17RA小鼠的腫瘤移植模型為切入點,探究了腸道IL-17-IL-17RA訊號通路缺陷介導的微生物失調透過全身免疫促進遠端腫瘤發生的分子機制 。 此外, 該研究也針對臨床IL-17/IL-17RA抑制劑抗腫瘤效果不佳的現象給出了可能性解釋並提出了解決方案 。

首先,為了確認IL-17-IL-17RA訊號在胰腺腫瘤生長中的作用,研究團隊將小鼠來源的胰臟癌細胞分別原位移植和皮下移植到全身IL-17RA缺陷的小鼠及對照組小鼠,然後比較兩組小鼠的腫瘤生長情況,實驗結果表明,ll17ra-/- 小鼠與對照組相比其原位移植瘤和皮下移植瘤生長速度都顯著增加。進一步,研究團隊透過RNA-seq對原位移植瘤ll17ra-/-小鼠及其對照組小鼠進行轉錄組學分析,結果顯示ll17ra-/-小鼠與對照組相比其原位胰腺腫瘤中IL-17訊號相關靶基因和通路顯著上調。此外,研究人員檢測了ll17ra-/-小鼠與對照組小鼠血漿中各種細胞因子的水平,並進行了差異表達分析,結果發現ll17ra-/-小鼠血漿中 IL-17A和 IL-17F水平顯著升高 (已知IL-17A和 IL-17F可形成同源或異源二聚體並透過IL-17RA進行訊號傳遞) 。那麽血漿中的IL-17是如何升高的呢?據此前的文獻報道,IL-17可以由腸道微生物刺激免疫細胞分泌產生,因此,研究人員給ll17ra-/-小鼠及其對照組小鼠口服混合抗生素 (針對細菌和真菌) 然後檢測血漿IL-17水平以探究IL-17RA敲除是否透過調控腸道微生物促進IL-17產生,實驗結果顯示,口服混合抗生素或針對細菌的抗生素可以顯著降低ll17ra-/-小鼠血漿IL-17水平。以上結果說明IL-17RA全身敲除可以透過調節腸道微生物提高IL-17水平並促進胰臟癌生長。
為了探究是否是腸道特異性的IL-17-IL-17RA訊號缺陷促進胰臟癌生長,研究人員構建了腸上皮細胞特異性敲除IL-17RA的小鼠 (ll17rafl/fl;Villin-Cre) 並檢測其血漿中IL-17水平,結果發現其血漿中IL-17A和 IL-17F水平較對照組小鼠是顯著升高的。此外,研究人員還發現腸道特異性敲除IL-17RA能夠像全身敲除IL-17RA小鼠一樣促進其原位及皮下移植胰腺腫瘤生長,而口服抗生素能夠逆轉上述現象。進一步,為了證明腸道 IL-17RA缺陷是透過遠端腫瘤細胞的IL-17-IL-17RA訊號直接調節腫瘤生長,研究人員將敲除IL-17RA的胰臟癌細胞移植入ll17rafl/fl;Villin-Cre小鼠,結果發現ll17ra-/-胰腺腫瘤生長速度不再受腸道IL-17-IL-17RA訊號調控,以上實驗結果證明了特異性腸上皮 IL-17RA缺乏導致的腸道微生物失調可以促進 IL-17分泌,IL-17能夠透過啟用腫瘤細胞中的 IL-17RA訊號促進腫瘤細胞的生長。
接下來,研究人員對ll17rafl/fl; Villin-Cre小鼠的配對回腸和胰腺腫瘤組織進行了免疫譜系分析以確定腸道 IL-17-IL-17RA訊號缺陷是否能夠透過影響免疫細胞來助力腫瘤生長,分析結果表明ll17rafl/fl; Villin-Cre小鼠腫瘤浸潤性以及腸系膜淋巴結和脾組織的B細胞顯著增加。為了確定增多的B細胞是否介導了腸道 IL-17-IL-17RA訊號缺陷促進的腫瘤生長,研究團隊在ll17rafl/fl; Villin-Cre小鼠中進行胰臟癌細胞皮下移植實驗並且清除掉小鼠體內的B細胞後觀察腫瘤生長情況,實驗結果顯示,清除B細胞抑制了在ll17rafl/fl; Villin-Cre小鼠中觀察到的腫瘤生長增加,這表明在腸道IL-17-IL-17RA訊號缺陷的情況下產生的B細胞具有促瘤能力。此外,研究人員透過單細胞RNA測序(scRNA-seq)等分析手段發現ll17rafl/fl; Villin-Cre小鼠腫瘤浸潤性Tp7細胞也會顯著增加,增加的Tp7細胞會協同增加的B細胞分泌IL-17A和IL-17F。以上數據表明,在腸道IL-17-IL-17RA訊號缺陷的情況下,腸道微生物失調會使腫瘤浸潤性Tp7細胞和 B細胞增多,增多的Tp7細胞和 B細胞可以分泌大量IL-17A和IL-17F促進腫瘤生長。
進一步,研究人員針對腫瘤細胞中IL-17如何促進其生長進行了探究,他們透過單細胞RNA測序 (scRNA-seq) 技術對ll17rafl/fl;Villin-Cre小鼠胰臟癌模型中受IL-17調控的基因進行了篩選,並與之前文獻報道的受IL-17調控的胰臟癌差異表達基因數據進行了比較,結果顯示,Duox2是受 IL-17差異調控的共同基因。據文獻報道,DUOX2是一種受 IL-17RA訊號調控的與氧化應激相關的酶,研究人員透過體外細胞實驗證實IL-17能夠促進DUOX2表達,並且進一步調控細胞氧化應激。
最後,研究人員對人胰臟癌標本及其血液迴圈中產生IL-17的細胞群進行了分析,分析結果表明人類胰臟癌患者其血液迴圈細胞和腫瘤浸潤細胞中均存在能夠表達 IL-17的細胞群,並且腫瘤組織中IL-17水平與DUOX2水平正相關。此外,研究人員發現 PDAC患者的腸道微生物與腸道上皮細胞 IL-17RA缺失和IL-17升高導致的腸道微生物變化相似,該結果表明由於IL-17RA缺失而被清除的腸道微生物可能促進 PDAC的發生。
基於上述實驗結果,研究人員猜想臨床上透過IL-17RA抗體抑制IL-17-IL-17RA訊號通路來治療腫瘤的效果不佳可能是由於腸道微生物可以代償性促進IL-17分泌。因此,研究人員將IL-17RA抗體和抗生素聯用,以探究清除腸道微生物能否增強IL-17RA抗體的抗腫瘤效果,實驗結果顯示,該藥物聯用治療方案可以有效抑制腫瘤生長。
綜上,該研究 發現全身或腸道上皮特異性缺失IL-17RA引起的腸道微生物失調會促進Tp7細胞和 B細胞發育,使腫瘤浸潤性Tp7細胞和 B細胞增多並分泌更多的IL-17,IL-17訊號能夠透過增加腫瘤細胞中的DUOX2表達促進腫瘤生長。 而透過靶向消除微生物以阻斷代償環路,能夠增強臨床IL-17RA抗體抗腫瘤效果。該研究工作 揭示了IL-17-IL-17RA訊號在人體不同部位的復雜性,並且針對臨床細胞因子抑制劑抗腫瘤效果不佳這一現象提出了可能的耐藥機制以及潛在的藥物聯用治療方案。
原文連結:
https://doi.org/10.1016/j.ccell.2023.12.006
制版人:十一











