近日,博士畢業於哈爾濱工業大學賀強教授課題組、目前在荷蘭燕豪芬理工大學揚·C·M·範·赫斯特(Jan C. M. van Hest)課題組從事研究工作的邵婧鑫博士及所在團隊,利用具有「碗型」形貌的聚合物囊泡負載金納米粒子,設計出一種由光熱驅動的納米馬達。
該馬達的最大速度可達到 125μm/s,實作了納米馬達運動速度的新突破。
納米馬達在生物醫學領域具有廣泛的套用前景。透過自主運動,納米馬達能夠用於藥物靶向遞送、疾病早期診斷與監測、組織再生與修復、生物成像、基因治療、以及抗菌和抗腫瘤治療。
本次制備的光驅動納米馬達,透過負載相應的「貨物」,如抗菌和抗腫瘤藥物、生物標誌物、生長因子、生物成像熒光分子、基因編輯工具(CRISPR/Cas9)等,可以套用於上述各個領域。
除此之外, 該成果具有光熱響應性,因此也可用於光熱治療,並與負載「貨物」的相應功能相結合,進一步拓展其套用領域。
另外,金納米粒子還可以作為電子電腦斷層掃描(CT,ComputedTomography)成像的造影劑。
因此,本研究中所制備的納米馬達有望用於精確的成像,在遞送藥物的同時,追蹤納米馬達在體內/體外的運動及富集情況。
對於相關論文[1],審稿人高度評價了本次光驅動納米馬達的優異效能。
並高度贊賞了課題組使用冷凍透射電子顯微鏡來表征和分析納米馬達的形貌的做法。
預計本次成果將為設計和制備基於軟材料的納米馬達提供新的思路,同時為納米馬達的形貌表征、運動機理的探索提供新的啟發。

(來源:Nature Communications)

制備「碗型」聚合物囊泡
據介紹,具有形貌可控和功能整合的聚合物囊泡,是一種優異的藥物載體,在生物醫學領域有著廣泛的套用。
相比於球形聚合物囊泡,「碗型」結構的聚合物囊泡具有額外的負載空間,即中空內陷的腔體。
為進一步挖掘並擴充套件聚合物囊泡的套用領域,邵婧鑫所在團隊充分利用這一腔體的負載能力,裝載具有不同功能和特性的「貨物」,並套用於各個領域。
例如,他們曾將白金納米粒子負載於內腔中,成功制備了基於聚合物囊泡的氣泡驅動納米馬達[2];
以及將酶負載的「碗型」聚合物囊泡用於制備酶驅動的納米馬達 [3];
並將二氧化錳納米粒子負載的可降解的「碗型」聚合物囊泡,用於腫瘤組織的有效穿透和深度藥物運輸 [4]。
基於前期工作,本研究的初始構想是將金納米粒子負載到「碗型」可降解聚合物囊泡的內腔中,制備具有光熱響應性的聚合物囊泡,以構建光驅動的聚合物納米馬達,並將其用於光熱抗腫瘤治療。
然而,受到表面功能化技術的啟發,他們將研究重點從內腔負載轉向金納米粒子在聚合物囊泡表面的功能化,以進一步提高負載效率。
另據悉,此前他們透過濺射鍍膜的方法構建了 Janus 球型聚合物囊泡 [5] 及 Janus「碗型」聚合物囊泡 [6],並將其用於制備光驅動納米馬達。
透過對其運動進行精準控制,實作了藥物運輸、細胞內遞送和深層組織穿透等套用。
據介紹,納米馬達能將外界能量轉化為機械能,從而實作自主驅動運動。
與傳統納米藥物載體(沒有自主運動能力)相比,納米馬達作為載藥體系,可以更有效的進行胞內遞送,並可進入深層組織的內部。
光驅動納米馬達,因其在空間和時間上對運動行為的精確控制,得到廣泛關註。
迄今為止,多種形貌的納米金材料,如金納米粒子、金納米殼、金納米棒、金納米星等,均已被引入光驅動納米馬達體系的設計與制備之中。
通常,以聚乙二醇-b-聚苯乙烯為組裝材料的聚合物囊泡具有相對剛性的膜結構,更易於利用濺射鍍膜的技術構建金-聚合物混成的聚合物囊泡。
然而,以可降解兩親性聚合物聚乙二醇-聚-D-乳酸為組裝單元的聚合物囊泡,則具有相對柔性的膜結構,因此濺射鍍膜技術在這種情況下將不再適用。
基於此,對聚乙二醇-聚-D-乳酸聚合物囊泡進行表面功能化將更具挑戰性。
(來源:Nature Communications)

將不同外源「貨物」送至細胞
據介紹,與其他類別的納米馬達(如化學驅動馬達)相比,光驅動馬達具有許多獨特的優勢。
首先,光驅動馬達能夠進行遠端操控,無需直接接觸,避免了接觸性調控對運動行為的幹擾,更適用於精細的生物醫學套用。
其次,透過使用近紅外激光,可實作組織深層穿透並獲得光熱響應性功能。
透過調節光源的強度、波長、入射光的角度等,可以精確調節納米馬達的運動行為及運動方向,使其能在復雜環境中發揮套用價值。
這些優勢使光驅動納米馬達在生物醫學和其他領域具有廣泛的套用前景。
鑒於此,本課題致力於拓展「碗型」聚合物囊泡的套用領域,設計並制備光驅動聚合物納米馬達。

(來源:Nature Communications)
如前所述,受到課題組前期工作的啟發,本次課題的初步設想是將金納米粒子載入「碗型」聚合物囊泡的內腔中,制備由近紅外激光驅動的納米馬達。
然而,考慮到光熱轉化效率,他們將研究重點從金納米粒子的負載轉向聚合物囊泡表面的金納米粒子功能化。
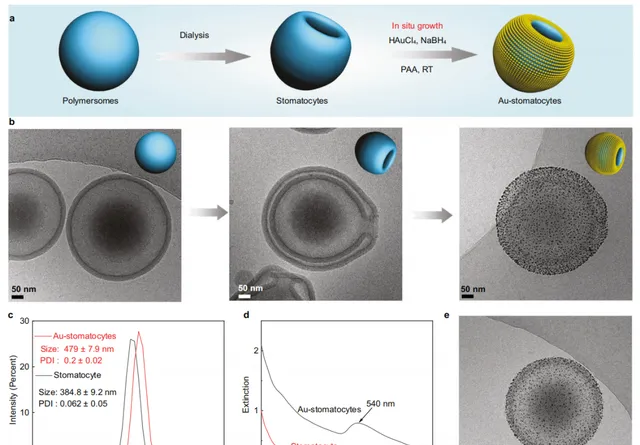
透過靜電相互作用及氫鍵相互作用,大量金納米粒子被修飾於「碗型」聚合物囊泡的表面。
冷凍透射電子顯微鏡和低溫斷層掃描表征結果證明了金納米粒子修飾的「碗型」聚合物囊泡的成功制備。
基於「碗型」聚合物囊泡自身的不對稱結構,在近紅外激光的照射下,這些囊泡能夠轉化為光驅動納米馬達。
透過單粒子追蹤分析,他們發現金納米粒子修飾的「碗型」聚合物囊泡具有超快的運動速度及精確可控的運動方向。
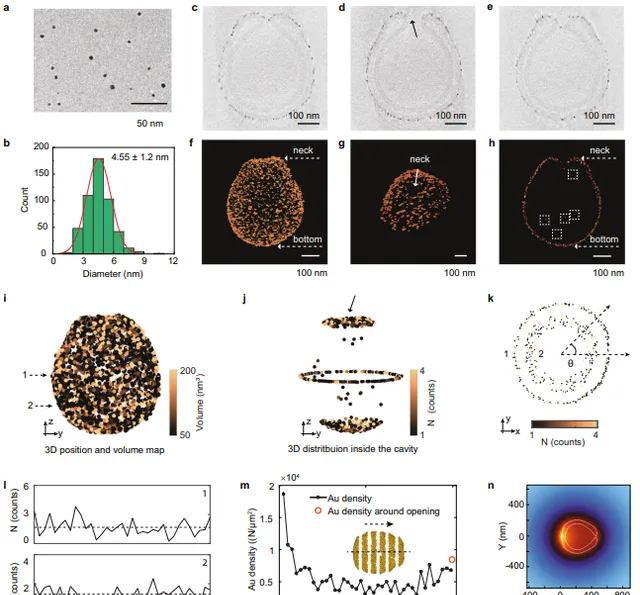
為揭示超快運動速度的機理,該團隊對納米馬達表面金納米粒子的尺寸和空間分布進行了詳細和深入的分析。
結合理論模擬分析,課題組發現沿著「碗型」聚合物囊泡軸向存在溫度梯度。該溫度梯度的存在使納米馬達能夠在近紅外激光的激發下展現出超快的運動速度。
(來源:Nature Communications)
最後,他們對光驅動納米馬達在細胞內遞送方面的套用進行了評價。
研究表明:納米馬達透過自主運動,可以快速開啟細胞膜,將不同尺寸的外源「貨物」快速、有效地遞送至細胞中。
日前,相關論文以【超快光啟用聚合物納米馬達】(Ultrafast light-activated polymeric nanomotors)為題發表在 Nature Communications 。

圖 | 相關論文(來源:Nature Communications)
荷蘭埃因霍芬理工大學博士生王建洪為第一作者,邵婧鑫博士和荷蘭埃因霍芬理工大學揚·C·M·範·赫斯特(Jan C. M. van Hest)教授擔任共同通訊作者。
圖 | 王建洪(來源:課題組)
基於該研究,他們將進一步拓展表面功能化的材料,如加入細胞靶向功能基團或細胞滲透肽等,以進一步增強光驅動納米馬達的生物醫學功能。
同時,他們計劃在「碗型」聚合物納米馬達的內腔中負載各種「貨物」,並結合表面的功能基團,構建協同作用系統。
本次研究中的納米馬達主要依賴於單一的驅動力,後續研究中他們將設計多驅動力的聚合物納米馬達,以實作更加多樣化和高效的套用。
同時,也將進一步探討納米馬達在基因治療藥物的負載與遞送方面的套用。
參考資料:
1.Wang, J., Wu, H., Zhu, X.et al.Ultrafast light-activated polymeric nanomotors. Nat Commun 15, 4878 (2024). https://doi.org/10.1038/s41467-024-49217-w
2. Nat. Chem . 2012, 4, 268-274.
3. ACS Cent. Sci. 2016, 2, 843-849; ACS Nano 2016, 10, 2652-2660; Angew. Chem. Int. Ed. 2019, 58, 13113-13118.
4. Nano Lett. 2020, 20, 4472-4480.
5. Angew. Chem. Int. Ed. 2020, 59, 16918-16925.
6. J. Am. Chem. Soc. 2022, 144, 11246-11252.
營運/排版:何晨龍











