導語
與小白鼠相生相殺的日子,被咬傷出血真是一件很讓人抓狂的事,不只是影響著身體健康。所謂一朝被蛇咬,十年怕井繩,心裏的恐懼還會延誤我們的課題,關乎著畢業。不懂人情世故的小編也難逃此劫,回看過去幾篇文章,其實小鼠性情溫順還挺可愛的,原來它咬傷我,在於我還不懂她……
因此,在日常實驗中,我們應該讀懂小鼠,站在小鼠的角度理解她,在不使她產生痛苦、符合生理特性、減少應激的基礎上操作,就會避免很多不必要的麻煩。下面咱們就從最基礎也最重要的小鼠抓取與固定說起,給大家介紹一下在小鼠實驗中最常接觸到的幾種實用技能(小鼠的抓取與固定;給藥方式),助你以後的實驗得心應手起來!
一、抓取與固定
很多實驗如小鼠給藥,采血等,均需要將小鼠固定住才可進行操作,因此規範準確地抓取動物是實驗的前提,既能避免動物咬人,也更便於我們實驗操作。對於一般簡單實驗,雙手就是最好的固定的工具。
1. 抓取步驟
① 右手提起小鼠尾巴,將其放在鼠籠蓋或其他粗糙表面上
② 小鼠向前掙紮爬行時,再用左手拇指和食指抓住鼠耳和頸部皮膚(如下圖)
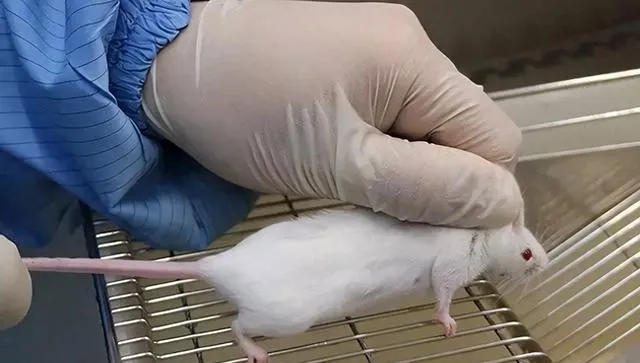
③ 小鼠於左手心中後,用左手的無名指和小指夾其背部皮膚和尾部(如下圖)
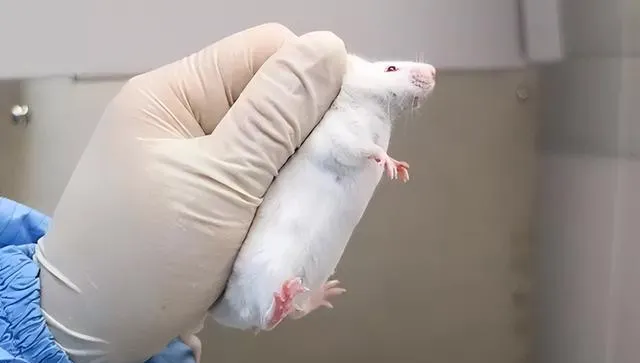
套用: 一些簡單的操作如小鼠灌胃、皮下註射、腹腔註射、肌內註射、剪毛等
註意
①小鼠體型雖小但非常靈活,抓取時避免咬傷一定要又穩又準
② 抓尾巴時,應抓取小鼠尾巴的中部或根部,捏住尾端可能損傷小鼠
③ 由於小鼠一直在活動,一次沒抓好時要放開重新抓,不要急於下一步操作
2. 固定
進行解剖、手術、心臟采血和尾靜脈註射等操作時(必要時先行麻醉),需做一定形式的固定。 如尾靜脈註射或采血時: 如下圖為小鼠固定器和尾靜脈註射。
第一步:開啟尾蓋,手提起小鼠尾巴,讓動物頭對準鼠筒口並使其本能的爬入固定器內;
第二步:調節小鼠固定器的長短,留出尾巴即可進行操作。

小鼠固定器
尾靜脈註射的小鼠固定
如果需要解剖或者心臟註射時:
① 麻醉小鼠
② 處於背臥式後再用大頭針(或者固定膠布)將鼠前後肢依次固定在蠟板上再進行操作。
套用: 對小鼠的解剖、手術和心臟采血等操作
二、小鼠常用給藥方法
進行藥物治療時,為了達到安全合理用藥,必須根據治療目的選擇適當的給藥途徑。接下來介紹一下常用到的小鼠給藥途徑的操作方式及各自特點。
因藥物性質和給藥目的不同,動物實驗中大概分為以下三種給藥方式:
1. 小鼠自動攝入
2. 灌胃
3. 註射給藥(皮內註射、皮下註射、肌肉註射、腹腔註射、靜脈註射、腦內註射等)
1. 小鼠自動攝入
一般是將藥物摻入飼料或者飲水中,使動物自動攝入
優點:操作簡單方便
缺點:劑量不能準確掌握,且動物個體間服藥量差異較大
2. 灌胃
藥物經口腔、食管直接送入胃中,要經過消化過程才能進入體迴圈,再到血液發揮作用。多用於急性試驗中的經口給藥法
操作方法
①抓取小鼠,頭部向上,頭向後仰使口腔和食管呈直線
②右手持註射器(一般用1ml的註射器配灌胃針頭),從一側口角進針,沿著上顎推至後頭,以針頭輕壓舌根
③灌胃針前端順利進入食管後,緩慢推進,插入針時應無阻力;
若感到阻力或動物掙紮時,應立即停止進針或將針拔出
參考給藥量:小鼠0.1ml/10g體重,最大不超過0.5ml/10g體重
優點:劑量準確,是常用,比較安全、方便經濟的給藥方法,
缺點:吸收不恒定,誤差較大。如某些藥物因本身的被物理性質而不能吸收;
有些藥物對胃粘膜有刺激作用可引起嘔吐;藥物與食物同時存在時,吸收會有影響
3. 註射給藥 (透過註射的方式,使藥物吸收)
優點:劑量準確,作用快,是動物實驗中常用的給藥方法
缺點:操作比較復雜,安全性較低、風險較大
根據註射位置分為多種註射方式。為了便於理解,首先了解一下皮膚構造,
如下圖:依次是表皮、真皮、皮下組織和肌肉層。
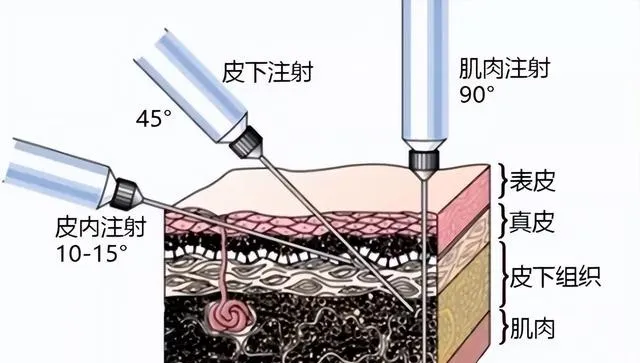
註射給藥中,根據實驗目的,主要分為以下幾種:
1. 皮內註射
將藥物註射於表皮與真皮之間(結合上圖),緊貼皮膚表層刺入皮內,針頭與皮膚呈10-15°角先刺入皮下,針頭向上挑起進入皮內再稍刺入,推出藥夜,見皮膚表面鼓起小皮丘,若皮丘不很快消失,證明藥液在皮內。一般選擇小鼠背部脊柱兩側皮膚進行註射
特點:適用於皮膚過敏試驗,觀察皮膚反應
參考給藥量:小鼠每次每點不超過0.05ml,兩點間隔1cm以上
2. 皮下註射
將藥物註射於皮下,提起註射部位皮膚使皮下形成空隙,將註射針沿皮膚推進5-10mm,若針頭可輕松左右擺動,表明針頭在皮下,輕輕抽吸無回流物,則可註入藥物,拔出針後應按壓針刺部位,防止藥液外漏和促進藥物吸收,一般選擇小鼠的背部
特點:皮下註射的吸收速率通常均勻而緩慢,因而作用持久;僅適用於對組織無刺激性的藥物,否則可引起劇烈疼痛和組織壞死
參考給藥量:小鼠0.1~0.3ml/10g體重
3. 肌肉註射
將針頭刺入大腿外側肌肉,註射時垂直迅速刺入肌肉,回抽針栓如無回血,將藥物註入。一般選肌肉發達,無大血管透過的部位,多選臀部
特點:藥物水溶液肌肉註射時吸收十分迅速,適用於油溶液和某些刺激性物質
參考給藥量:小鼠給藥量每次小於0.05-0.1ml
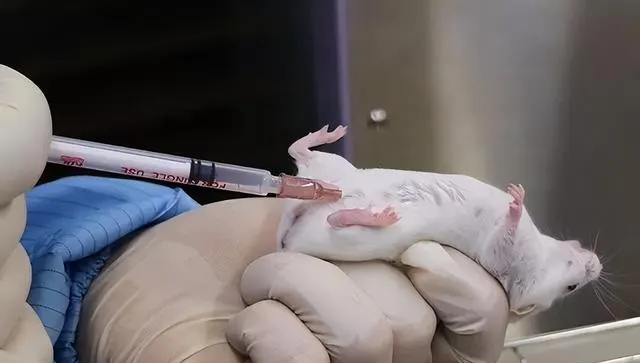
4. 腹腔註射
抓取小鼠,使其腹部朝上頭部略向下垂,抓緊背部皮膚使使腹部皮膚緊繃,於腹中線一側刺入皮下,在皮下平行腹中線推進針頭3-5mm,再以45°角向腹腔內刺入,當針尖透過腹肌後,抵抗力消失,回抽無回流物,緩慢推入藥物。
特點:是很常見的給藥方式,註射劑量大,註射後腹膜能力吸收強;尤其是在麻醉時,最常見的麻醉方法就是麻醉藥物腹腔註射
參考給藥量:每次給藥量小鼠0.2-0.8ml
5. 靜脈註射
小鼠一般采取尾靜脈註射方式,鼠尾靜脈有三根,左右兩側及背側各一根,一般選擇左右兩側尾靜脈,先距尾尖1/3處先緩註少量藥液,如無阻力,表示針頭已進入靜脈,可繼續註入。
特點:將藥物直接輸入血液,沒有消化過程,藥物直接到達迴圈系統,藥效迅速可靠。但由於高濃度的藥物迅速到達血漿和組織,增加了發生不良反應的危險性。反復註射還有賴於持續保持靜脈通暢。不適用於油溶液或不溶性物質。
參考給藥量:0.05ml - 0.1ml/10g

6. 腦內註射
一手拇指和食指抓住動物兩耳後的頭皮固定頭部,使註射針頭和額頂顱骨呈45°角,在中線外側2mm處刺入,註射速度一定要慢,避免引起顱內壓急遽升高
特點:多在微生物學動物實驗
參考給藥量:每次低於0.03ml
7. 其他註射
除了上述常見的幾種註射給藥方式外,根據你的實驗目的,還有其他註射方式,如心室註射等,這裏就不在贅述了。
小鼠的固定不僅僅是為了避免我們被咬傷,更是很多實驗操作成功的前提,所以我們一定要熟練掌握。
本文來源於公眾號「邦耀實驗室 」












