在醫療創投行業,一筆10億級美元以上的融資,往往要在企業發展的中後期才能出現。
而在近期,一家醫療創新企業剛剛走出隱匿模式,便宣告拿下超10億美元融資,成為截至目前2024 年全球最大醫療種子輪,也讓這家企業一躍成為獨角獸。
要知道,種子輪往往是創業公司獲得的第一筆重要資金,由於此時專案十分初創,平均融資額大致在數十萬至數百萬美元之間。10億美元以上融資額的醫療種子輪,極其稀少,目前全球僅兩例(另一例是抗衰老企業Altos Labs在2022年獲得的30億美元融資)。
此次拿下超10億美元種子輪的企業名為Xaira Therapeutics,由生物技術領域最大的投資機構之一ARCH Venture Partners和Foresite Labs於2023年5月聯合孵化。 據官網介紹,Xaira Therapeutics核心業務方向是利用AI重塑藥物研發,目前專註蛋白質組學方向,即研究蛋白質如何在健康和疾病中發生變化。
與業務方向密切相關,這家企業的聯合創立者為2021年科學突破獎·生命科學獎(該獎被譽為「科學界的奧斯卡」)獲得者、華盛頓大學蛋白質設計研究所所長David Baker,其與團隊研發的新技術,能夠設計在自然界中從未見過的蛋白,包括一些對於人類疾病具有幹預性治療潛力的新型蛋白。
其實,在「AI+蛋白質」,Xaira Therapeutics的融資不是孤例。據動脈橙數據庫 ,2022年1月至2024年6月的兩年半間,該賽道已發生不下100起融資事件,總融資額超60億美元, 是目前醫療健康最受資本熱捧的領域之一。
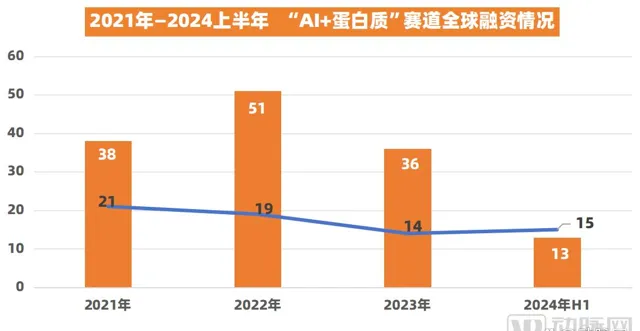
(數據來源:動脈橙數據庫)
頻獲融資背後,「AI+蛋白質」賽道究竟講出了一個什麽樣的產業新故事?
超豪華陣容+超10億美元加持,Xaira Therapeutics具體要做什麽?
在當下,「AI+蛋白質」正成為科技行業關註的焦點。
原因在於, 傳統的蛋白質研究方法存在著實驗周期長、成本高昂等問題,而AI能夠加速蛋白質研究行程: 一旦用於藥物研發,可助力新靶點的發現,縮短研發周期和降低時間成本,而用於材料,則以生成超越自然界的新蛋白質材料,為農業食品等領域帶來新增量。
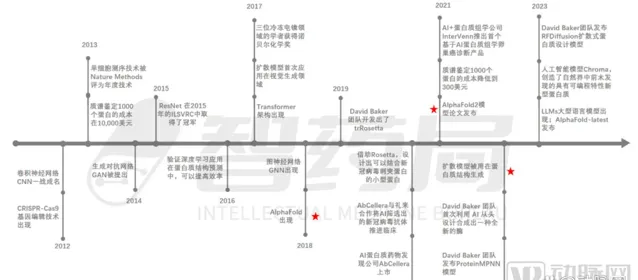
(Al+蛋白質行業的發展大事件 圖片來源:智藥局·【AI+蛋白質行業研究報】)
正是在巨大的想象空間下,「AI+蛋白質」賽道開啟狂奔征途。但要想入局,並不容易——其一,要滿足足夠的研發資金;其二,要有強大的團隊。
前者,Xaira Therapeutics已經拿下超10億美元;後者,Xaira Therapeutics更是擁有一個強大的跨學科團隊,成員囊括電腦科學、生物資訊學、數據科學、藥理學、商業管理等行業背景的專業人才。比如擔任CEO的是Marc Tessier-Lavigne博士,其曾是基因泰克首席科學官,同時也是洛克菲勒大學和史丹福大學前校長。
更重要的是,前文提到的聯合創立者David Baker,是「AI+蛋白質」領域大牛級的人物。據悉,Xaira Therapeutics的大部份技術來自David Baker及其任職的華盛頓大學蛋白質設計研究所。
因此,要深入了解Xaira Therapeutics,就需要知曉David Baker及其團隊的研究成果。縱觀David Baker的科研經歷,其一直專註在蛋白質結構預測和蛋白質設計方向。
● 在蛋白質結構預測方 向,David Baker及其團隊早在1998年便推出了Rosetta演算法,並在第三屆國際蛋白質結構預測大賽中嶄露頭角。隨著後續的不斷最佳化,Rosetta在蛋白質結構預測領域一直是最具代表性的演算法之一,並陸續開發出多種臨床階段蛋白質生物制劑、多款IND 階段分子和十多種臨床前階段生物制劑。
●在蛋白質設計方向,David Baker及其團隊在2022年推出了深度學習工具ProteinMPNN,其借鑒了影像辨識使用的神經網絡,能夠明確與特定結構相對應的序列,可以更加精準、快速地設計蛋白質分子,將設計蛋白質的時間長度從「月」縮短至「秒」,比此前最好的軟件快200多倍。
據悉,Xaira Therapeutics所用的AI大模型,就整合了David Baker及其團隊開發的AI大模型RFdiffusion,後者是該團隊繼ProteinMPNN後,推出的一種更先進、更通用的蛋白質設計模型。
具體來說,RFdiffusion是利用擴散模型構建的創新型生成式AI系統,其類似Midjourney和Stable Diffusion等能將文本生成影像的模型,即可以生成新穎的、可客製的蛋白質「骨架」(即蛋白質的整體結構支架),然後將序列分層。據外媒報道,該模型可按需設計生物分子,有望革新疫苗和藥物開發領域。
不過,由於尚處初創階段,Xaira Therapeutics並未透露太多研發進展和管線布局,外界還難以預判其未來的具體動作。
但可以肯定的是,憑借強大的明星創始團隊和巨額融資,Xaira Therapeutics一出場已經成為「AI+蛋白質」賽道最重磅的選手之一。
資本熱捧,「AI+蛋白質」賽道進展幾何?
「AI+蛋白質」的創投大浪潮始於2020年。
彼時,由Google DeepMind團隊開發的AlphaFold成功預測出蛋白質的三維結構,邁出了利用人工智能預測蛋白質結構的第一步,使「AI+蛋白質」成功破圈,並吸引眾多創業者和投資機構入局。
「這是人工智能對科學領域最大的一次貢獻,也是人類在21世紀取得的最重要的科學突破之一。」談及AlphaFold,西湖大學校長施一公曾如此表示。
從技術角度看, 「AI+蛋白質」賽道可以分為三大主要方向,分別是AI蛋白質組學、AI蛋白質預測與AI蛋白質設計, 其區別如下:
● AI蛋白質組學:蛋白質組學是以蛋白質組為研究物件,研究細胞、組織或生物體蛋白質組成及其變化規律的科學,AI與蛋白質組學的結合,能夠在靶點發現、生物標誌物的發現和精準醫療領域有很大套用潛力。
● AI蛋白質預測:透過機器學習和深度學習演算法,基於蛋白質的胺基酸序列資訊,預測蛋白質的三維結構、折疊方式和與其他分子的相互作用。
● AI蛋白質設計:利用AI在沒有人類直接幹預的情況下,透過學習蛋白質序列和功能之間的關系,設計出新的蛋白質。
接下來,我們將從三個方向看各自的代表企業與其進展。不過需要註意的是,蛋白質預測和蛋白質設計都是緊緊圍繞「蛋白質如何折疊」這一核心命題展開研究,所以一些創新企業在兩個方向上皆有布局。
目前,在AI蛋白質組學方向,已經有珞米科技、Matchpoint、Olink、Somalogic、西湖歐米(按企業名稱首字母排序)等為代表創新企業。
以西湖歐米為例,其成立於2020年7月,主要聚焦開發和套用以蛋白質譜為主的多組學技術,並透過該技術正在推進甲狀腺結節、阿爾茨海默病(老年癡呆癥)、肺癌等多種疾病的體外診斷試劑和方法的開發。
例如,針對甲狀腺結節的檢測,西湖歐米透過蛋白質組結合AI技術,開發出新型分子診斷產品「甲譜諾」。該產品能夠將結節良惡性診斷的準確率提升到90%左右,從而幫助大部份原本難以判斷良惡性的患者免受手術之苦。
又比如總部位於瑞典的Olink,該企業提供了一個以蛋白質組學為中心的產品和服務平台,其中最著名的是其鄰位延伸分析(PEA)技術——該技術可在實驗室安裝的qPCR儀器和下一代測序儀上執行,帶來高通量蛋白質分析能力。據悉,PEA技術建立在超過5300個蛋白質生物標誌物目標的龐大文庫上,已經在約1400份科學論文中得到套用,顯示了其強大的市場潛力和科研價值。
就在7月10日,全球科學服務領域的巨頭賽默飛宣布對Olink進行收購,收購總金額高達31億美元。賽默飛總裁兼行政總裁Marc Casper在聲明中提到:「收購Olink凸顯了蛋白質組學在推進生命科學研究和精準醫療方面的深遠影響。」
在AI蛋白質預測方向,湧現了百圖生科、DeepMind、分子之心、GenesisTherapeutics、華深智藥、Profluent Bio、深勢科技、天壤(按企業名稱首字母排序)等代表企業。
作為AI蛋白質預測領域的先行者,繼AlphaFold後,DeepMind於去年釋出了又一AI模型AlphaMissense。根據國外媒體的報道,AlphaMissense透過利用蛋白質序列數據庫和變異結構背景,可以辨識致病的錯義突變(錯義突變是可能破壞人類蛋白質功能的基因突變)和未知致病基因,且可預測的範圍比人類專家提升近千倍。
同時,在今年5月,DeepMind與AI 藥物發現公司Isomorphic Labs共同宣布推出新一代AI生物分子結構模型AlphaFold 3,其開發建立在AlphaFold 2 的基礎之上,能將預測範圍從蛋白質帶到廣泛的生物分子。

(AlphaFold3預測的分子結構 圖片來源:DeepMind)
國內企業天壤推出了xCREATOR工作台,其透過整合多樣化的AI演算法和計算資源,為科研院所、企業等提供更高效、更便捷、更易用的蛋白質結構預測與設計服務。使用者無需編寫任何程式碼即可進行蛋白質預測和設計等各項任務,並對計算結果進行視覺化展示和分析,適用於多肽、酶、抗體和各類功能蛋白質。
借助工作台,使用者幾分鐘內就可以獲得接近實驗解析精度的蛋白質結構。在過去,這個時間可能是數個月甚至數年,並且得借助造價昂貴的專業器械。
在AI蛋白質設計方向,已經跑出Arzeda、Cradle Bio、分子之心、Generate Biomedicines、RevolKa、天壤、天鶩科技、途深智合等(按企業名稱首字母排序)企業。
國外企業Generate Biomedicines是該方向的代表企業之一,其由生命科學頂級風投公司Flagship Pioneering孵化,開發了名為Chroma的生成式人工智能模型,該模型建立在擴散模型(Diffusion Models)和圖神經網絡(Graph Neural Networks)的框架上,能夠從頭生成高質素、多樣化和創新的蛋白質結構。
在落地套用上,目前Generate Biomedicines已經擁有廣泛的產品管線,涵蓋免疫學、腫瘤學和傳染病學。
再看國內企業分子之心,該企業自主研發了產業級AI蛋白質生成大模型——NewOrigin(達爾文)大模型,該模型擁有百億級參數,學習了海量高度專業、復雜的多模態數據,可根據產業套用需求,「按需客製」功能性蛋白質。
截至目前,分子之心已將NewOrigin大模型廣泛套用於創新藥研發、新材料、食品、化工、農業等領域,在大分子藥物設計、極端環境下蛋白質穩定性最佳化、酶活性最佳化、酶-特定受質對接、蛋白質從頭設計等多類別的高難度產業任務上取得重大突破,並在真實的生產體系中獲得驗證。
不難發現,在各個細分方向,創新企業們已經取得重要突破,並正持續深入中。
後續,得益於更多企業的進入與新的可能性產生,「AI+蛋白質」在行業端的套用會迎來更大進展,市場空間將不斷拓寬。據MedMarket Insights測算, 2023年AI蛋白質市場規模已達14.83億美元,預計到2031年市場規模將增長至178億美元, 年復合增長率約為36.5%。

(「AI+蛋白質」市場規模預測 圖片來源:智藥局·【AI+蛋白質行業研究報】)
水大,魚就可能大。在不斷拓寬的想象空間裏,「AI+蛋白質」賽道勢必走出全球性的巨頭企業。
向挑戰發起沖鋒,「AI+蛋白質」的未來正在到來
前路很美好,但同時也要註意, 「AI+蛋白質」賽道仍面臨著一些落地挑戰。
比如【AI+蛋白質研究報告】就指出, 數據質素問題 是AI套用中的一個關鍵限制因素,由於蛋白質結構的復雜性,所以需要大量高質素的數據來訓練和驗證AI模型。目前,盡管如PDB(蛋白質數據銀行)公共數據庫提供了大量結構資訊,但這些數據往往存在偏差和不完整性,這可能影響AI模型的準確性和泛化能力。
此外,哥倫比亞大學助理教授Mohammed AlQuraishi在接受【Nature Biotechnology】采訪時表示,從設計具有特定分子功能的蛋白質到了解它們如何在人和生物體內運作,在這一過程中, 生物學的全部復雜性 會成為限制性步驟。
當然,任何事都有兩面性, 挑戰的背後即是機遇 ——作為生命體中最為基礎的組成部份之一,在AI加持下,蛋白質相關套用或能在接下來數年內在更多細分領域落地,帶來巨大商業可能性。
目前,包括Meta(原Facebook)、輝達等行業巨頭已經跨越到「AI+蛋白質」領域,意欲透過學習大量數據來研發設計蛋白質的模型。而當越來越多的企業加入該賽道,相關研究成果的論文層出不窮,且持續加速,行業很有可能在某個時間節點迎來巨大突破。
相信,隨著行業入局者們迎難而上,解決一個又一個挑戰,「AI+蛋白質」賽道將講出更為性感的故事,從而為醫療創新行業帶來更大可能。
在這個過程中,那些不斷創新求索的企業,也終將獲得屬於它們的豐碩回報。











