2月1日,清華大學生命學院劉俊傑課題組在【科學】 (Science) 雜誌線上發表了題為【可編程的水解型核酸內切核酶用於DNA靶向切割】(Hydrolytic endonucleolytic ribozyme(HYER)is programmable for sequence-specific DNA cleavage)的研究論文,報道了一種催化性RNA(核酶)—HYER(水解型內切核酶)。HYER可序列特異地切割RNA和DNA受質,並對哺乳動物細胞基因組產生位點特異的編輯。無需蛋白核酸酶的參與,HYER的受質辨識和切割均由RNA分子實作,有望成為繼CRISPR之後新一代的基因編輯底盤工具。

圖1.歷代基因編輯工具
基因承載著遺傳資訊,定義了生命的多樣性和復雜性。基因編輯是理解和改造生命的關鍵技術,在生物學研究和生物產業發展中發揮著重要作用。歷代基因編輯工具如巨核酸酶、ZFNs、TALENs,均以蛋白質為基礎辨識和切割DNA,編輯位點的重編程較為困難。目前被廣泛使用的CRISPR-Cas工具,是RNA引導的蛋白核酸酶,透過引導RNA的間隔序列來辨識DNA,具有很好的編輯位點重編程能力,但依然存在著PAM序列限制、分子量大、蛋白免疫原性等多種問題。
HYER源自細菌逆轉座子(第二類內含子,GIIintron),一種可在宿主基因組上「拷貝和貼上」(逆轉座)的可移動元件。該元件通常編碼一個兼具核酸酶和逆轉錄酶活性的蛋白質以及一個RNA分子,透過形成蛋白核酸復合物(RNP)來執行在宿主基因組中的逆轉座擴增。有趣的是,透過廣泛的生物資訊學篩選,劉俊傑課題組發現了許多不編碼蛋白的、緊湊的二類C型內含子(ORF-lessGII-Cintron)在細菌基因組中存在多拷貝的現象。這一現象暗示,這些內含子編碼的唯一組份RNA分子,可能具有不依賴蛋白的擴增位點辨識和切割能力,來實作內含子在宿主基因組內的拷貝擴增。
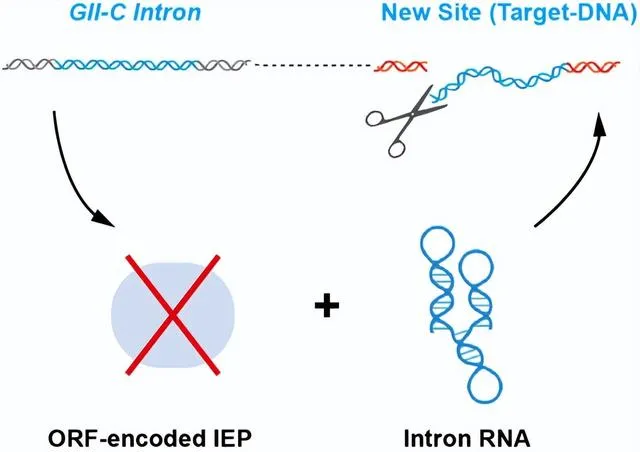
圖2.不含蛋白組分的第二類內含子RNA在基因組中「拷貝和貼上」的假設示意圖
生化實驗表明,這些長度約600nt的RNA分子在廣譜的離子濃度和溫度範圍內,具有顯著的RNA和DNA水解切割活性。因此,研究人員將這些RNA分子命名為水解型內切核酶(Hydrolytic Endonucleolytic Ribozymes, HYERs),這是科學界首次報道具有DNA水解切割能力的核酶(Ribozyme)。值得註意的是,HYER1和HYER2表現出了與緊湊型的CRISPR-Cas12e(CasX)和Cas12l(Casπ)相當的DNA體外切割效率。
為檢驗HYER在細胞內的DNA切割能力,研究人員在大腸桿菌中構建了ccdB毒蛋白報告系統,證明HYER1和HYER2可以對帶有ccdB毒基因的質體進行靶向切割。在HEK293T細胞內,研究人員構建了移碼Puromycin抗性基因(puro*)報告系統。結果表明,HYER1可對puro*產生移碼編輯,賦予細胞Puromycin抗性。在抗性篩選富集後的細胞裏,三個靶位點中最高的編輯效率為9.18%。這表明,HYER可以在真核細胞基因組中引入雙鏈斷裂並產生編輯。然而,在未經Puromycin篩選富集的細胞中,編輯效率僅為0.09%到0.2%,表明HYER的真核基因編輯能力還有很大的進步和最佳化空間。
研究人員利用冷凍電鏡獲得了HYER1的高分辨三維結構(3.0Å),發現HYER1以同源二聚體的形式存在,並揭示HYER1水解切割DNA的機理。HYER1透過一段暴露的單鏈RNA(6nt)區域,TRS(Target Recognition Site),辨識並招募DNA受質,將DNA捕獲在結構域V所形成的催化核心中,透過經典的雙鎂離子機制催化DNA水解。
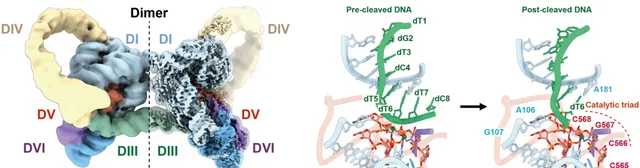
圖3.HYER1的電子密度圖和DNA水解切割機制
基於HYER的三維結構,研究人員進行了多種理性設計,證明HYER具有良好的可編程性,可根據受質序列靈活設計TRS的序列和長度;在TRS臨近區域插入14nt的受質招募序列(Recruiting Sequence,RS),可明顯提高HYER1的受質辨識特異性和切割效率;對回文序列和TRS進行改造, HYER1則可形成帶有兩個不同TRS的異源二聚體,靶向雙鏈DNA受質的不同區域,產生了具有5’突出、3’突出或平末端的客製化切割產物。
受「RNA世界」假說的啟發,研究人員提出了第二類內含子中的「RNA的催化功能逐漸被蛋白質取代」的分子前進演化歷程:在前進演化過程中,第二類內含子的結構域IV逐漸擴大,並產生了可編碼短肽的開放閱讀框(ORF),而這些短肽可作為順式元件與內含子RNA相互作用,增強其結構穩定性和催化活性;隨著ORF變得更長、更為成熟,其編碼的蛋白質不僅起到穩定結構的作用,亦獲得了DNA切割和逆轉錄活性,以替代RNA核酶行使催化功能。該成果不僅拓展了科學界對「RNA世界」假說和RNA催化功能的理解,也為創制具有中國完全自主知識產權的新型核酸操縱底盤工具,以及將其進一步用於基因編輯和RNA編輯等奠定了基礎。
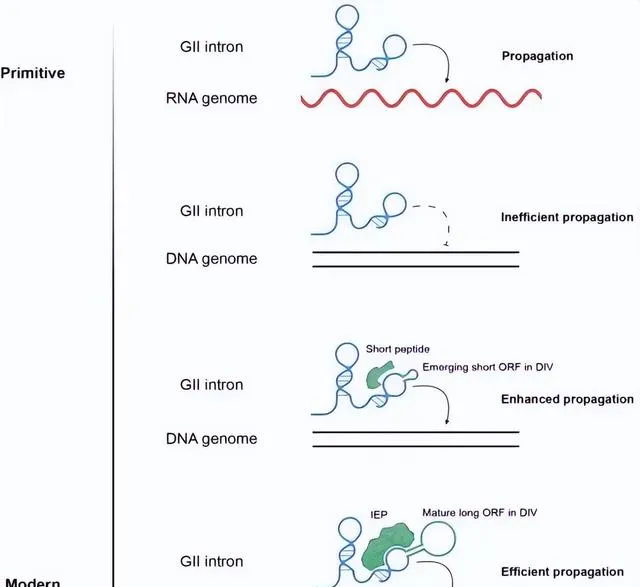
圖4.第二類內含子的前進演化假想
清華大學生命學院劉俊傑副教授為本文通訊作者;清華大學生命學院2021級博士生劉子賢、高精尖結構中心卓越學者張壽悅博士、2020級博士生朱漢舟、博士後陳之航、2019級博士生楊韻和2022級博士生李隆騏為該文共同第一作者;清華大學生命學院2021級本科生劉雲、2018級博士生李丹苑、2020級博士生孫奧、李承平、2021級博士生譚順青、2023級博士生王高立、2023級博士生沈婕怡、水木學者靳帥博士,中國科學院遺傳與發育生物學研究所高彩霞研究員和2020級博士生雷源為本研究作出了大力貢獻。清華大學冷凍電鏡平台為本研究提供了器材和技術支持。本研究得到了基金委原創專案(32150018)、農業部和清華大學的經費、資源支持。
論文連結:
Hydrolytic endonucleolytic ribozyme (HYER) is programmable for sequence-specific DNA cleavage | Science
供稿 | 生命學院
編輯 | 黃思南
稽核 | 王曉霞











