近日,美國華盛頓聖路易大學吳萌教授和哈佛醫學院教授丹尼斯·L·卡斯珀(Dennis L. Kasper)團隊,揭開了腸道補體系統的神秘面紗。
長期以來,科學界普遍認為補體系統僅僅是血液中的一個先天免疫組成部份,它在人體的免疫防禦中發揮著關鍵作用。吳萌和合作者發現了腸道記憶體在一個獨立的補體系統。
透過有選擇性地表達特定的補體成分,在腸道共生微生物群的調控下,這一系統能與共生微生物系統和諧共存,並能有效地清除病原體。

圖 | 吳萌(來源:吳萌)
此前有研究發現腸道內 C3 水平升高,是炎癥性腸病患者和克羅恩病患者的表現癥狀。但是,C3 的腸道表達、及其在疾病中的作用尚不清楚。
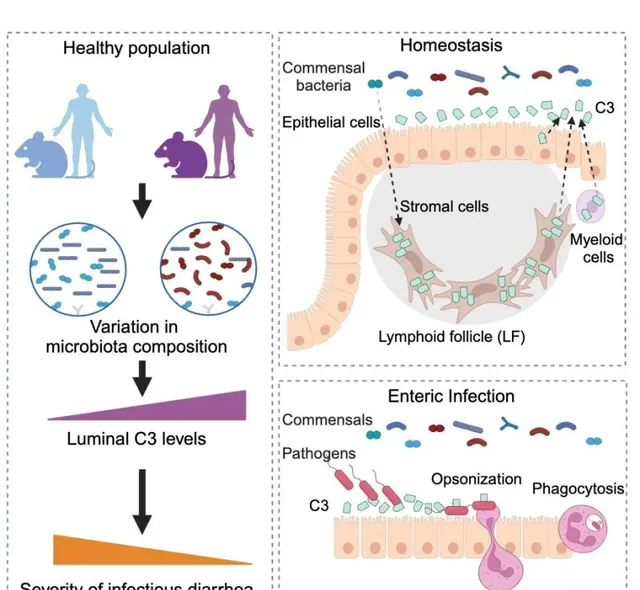
在最新的研究中,吳萌及團隊首次在腸道中發現了補體成分 3(C3)的直接證據, 揭示了腸道微生物可以調節腸道內 C3 的水平,及其腸道 C3 在抵抗腸道感染中的保護作用。
此外,該研究小組也首次揭示出 C3 不僅僅由肝臟細胞制造,它同樣能夠由腸道的細胞生產,並且被分泌到腸腔內。
該研究表明,補體系統在體內的防禦機制中扮演著更復雜、更全面的角色,尤其在維護健康的微生物群平衡方面,具有特定細菌和細菌產物能夠調節 C3 表達的現象。
研究團隊進一步研究了黏膜上的 C3 成分是如何發揮作用、它們的細胞來源,以及這些表達對宿主微生物群的依賴性,從而拓展了我們對補體蛋白 C3 產生和功能的認識。
總的來說,本次工作為免疫系統中補體部份的研究開啟了新方向。 對於透過調節腸道菌群與腸道補體之間的相互作用來治療腸道感染、炎癥性腸病和克羅恩病來說,這一研究也能為其提供新的預防思路和治療思路。
(來源:Cell)

「古老」的補體系統及腸道菌群
作為一種古老的宿主防禦機制,補體系統由一系列蛋白質組成,是先天免疫系統的重要組成部份。
補體系統的「古老」體現在兩個方面:
一方面,補體系統在生物前進演化上特別古老,其生物起源可以追溯到十多億年前,早在腔腸動物和原口動物中就已經存在。這一前進演化上的保守性,表明其在生物體內具有至關重要的功能。
另一方面,補體系統是人類最早深入研究的生物學系統之一。19 世紀末,比利時免疫學家與微生物學家朱爾·博爾代(Jules Bordet)發現補體系統存在於血液中,並因此榮獲 1919 年諾貝爾生理學與醫學獎。
此後一個世紀,科學家們陸續發現了更多的補體系統成分,其中補體蛋白 C3 被認為是其核心蛋白,上下遊途徑都與之相關。長期以來,人們認為 C3 主要由肝細胞產生,而補體系統主要在血液和間質液中發揮作用。
近年來,隨著現代測序技術的進步,人們對腸道微生物有了更為深入的了解。學界發現人類腸道內有著豐富的微生物群落,包括細菌、古細菌、真菌、原生動物和病毒。
這些微生物能與人類和諧共處,並對人體健康產生重要影響。同時,科學家們還揭示了腸道菌群與免疫系統之間復雜而微妙的關系。
其中,腸道菌群不僅具有訓練免疫系統的功能,同時免疫系統也能在一定程度上調節腸道菌群。
然而,在腸道這個微生物豐富的環境中,補體系統是否存在?如果存在,它與共生微生物群、以及病原體又是如何相互作用的?為了回答這樣一個既古老、又現代的問題,課題組開展了本次研究。
巧妙的人類腸道補體系統
定下課題方向之後,他們圍繞 C3 開展了一系列研究。
首先,課題組利用無菌小鼠模型和微生物菌群分析,證明腸道菌群的確可以調節補體 C3 蛋白的水平。
透過此,他們鑒定並分離出一種能以特異性的方式,提高腸道補體 C3 蛋白的菌株。並在動物模型中驗證了它的作用。
進一步地,他們發現血液裏的 C3 水平,受到腸道菌群的影響較小。於是推斷 C3 應該是腸道內的某種細胞,由於感知了腸道菌群的訊號而產生的。
所以,課題組開始尋找這種腸道細胞的研究。透過結合單細胞 RNA 測序、流式細胞儀分析,原位染色等一系列實驗手段,他們發現腸道淋巴濾泡中的基質細胞,是穩態條件之下 C3 最豐富的來源。
盡管腸上皮細胞和免疫細胞也可以在一定程度上產生 C3,但這是第一次發現腸道基質細胞表達 C3。
因此,他們建立了一個體外培養系統,證明腸道基質細胞可以直接感知共生訊號,進而表達 C3 並將其分泌到細胞之外。
為了確定腸道補體系統的功能,他們開展了新的實驗,並行現在感染期間,腸道產生的 C3 水平會有所增加,所有三種細胞類別都會參與到針對侵襲性病原體的保護之中。
然後,C3 透過替代性補體途徑發揮作用,然後被 C3 標記的細菌,會被嗜中性球吞噬。
此外,由健康腸道菌群所決定的基線腸道 C3 的水平、與感染的嚴重性呈現出反向的相關關系。
最後,在對人類腸道樣本進行檢測和分析之後,他們證實腸道補體系統同樣也存在於人體中,並且受腸道菌群的調控。
確認腸道記憶體在補體蛋白 C3 之後,他們面臨著這樣一個問題:
一方面,本次實驗清楚地證明在健康攜帶腸道菌群的老鼠和人類體內,存在數目可觀的補體蛋白 C3;
另一方面,傳統免疫學研究都表明 C3 是一種對細菌具有殺傷力的蛋白,在血液裏面「見菌就殺」。
然而,由於腸道裏富含大量的細菌,這讓他們不禁思考 C3 是如何和這些細菌和平共處的?
為此,他們嘗試使用多種方法追蹤 C3 在健康腸道中的行為,但一直未能找到一個明確答案。直到他們研究病原體入侵腸道後,才有所突破。
他們發現在這種情況之下,C3 主要透過嗜中性球等吞噬細胞發揮作用。而在腸道之中,並不存打孔蛋白(C5-C9)。
至此,這個疑問也就豁然開朗。在健康的腸道之中,嗜中性球相對較少,即使有些益生菌被 C3 標記。
但是由於 C3 下遊的兩個通路, 即形成細菌膜上的膜攻擊復合物和可以吞噬細胞吞食包裹並消化微生物的吞噬細胞如嗜中性球,都在健康腸道中存在量極低,因此腸道補體可以和益生菌和平共處。
「當我們發現這一現象時,對人類腸道補體系統的設計之巧妙感到十分驚嘆。這是一個非常聰明的系統,透過有選擇性地表達不同的分子,針對益生菌和有害菌實作了精準調控。
腸道補體系統就像人體腸道內的衛兵一樣。它們平時負責巡邏,並能和益生菌和平共處。一旦出現了有害菌,就能快速有效地清除它們。」吳萌說。
最終,相關論文以【微生物群誘導的腸道補體可與病原體作鬥爭並於共生菌和諧共處】(Gut complement induced by the microbiota combats pathogens and spares commensals)為題發表在 Cell 雜誌上[1],吳萌、鄭文是第一作者,哈佛醫學院教授丹尼斯·L·卡斯珀(Dennis L. Kasper)擔任通訊作者。
圖 | 相關論文(來源:Cell)
目前吳萌所在的華盛頓聖路易大學,是腸道菌群研究最早開始的地方。
她表示。「我們學校的測序中心曾是美國三大測序中心之一,承擔過人類基因組計劃。
在這樣的學術環境中,我的課題組采用多種研究方法,來研究無菌小鼠模型和人體樣本,致力於探究腸道菌群對宿主的分子調控機制。」
而透過本次研究,他們發現腸道補體系統是一個嶄新、且富有研究潛力的方向。
未來還有很多問題值得進一步深究:比如腸道菌群如何調控補體蛋白 C3 的水平?是透過細菌產生的代謝產物、還是透過細菌表面的一些結構性分子?宿主細胞的受體是什麽?
預計透過深入探索腸道菌群和補體系統的相互作用, 對於以微生物為靶向的精準醫學方法也將迎來新的途徑,從而實作腸道疾病的預防和治療。
參考資料:
1.Wu, M., Zheng, W., Song, X., Bao, B., Wang, Y., Ramanan, D., ... & Kasper, D. L. (2024). Gut complement induced by the microbiota combats pathogens and spares commensals. Cell , 187(4), 897-913.
2.https://sites.wustl.edu/wulab/
營運/排版:何晨龍











