在基因編輯技術領域,哈佛大學教授 David R.Liu(劉如謙) 實驗室曾做出不少突破性成果。他們曾開發了堿基編輯器(BE,base editor)和先導編輯器(PE,prime editor),從而能夠準確地更改基因中的堿基,進而有望治療因基因突變產生的疾病。
其中, 先導編輯器更是成為近年來最受矚目的基因編輯技術之一。 但是,如何將這些新的編輯技術,以安全、有效的方式遞送到生物體內,仍是一個亟待突破的問題。
目前,已經開發出來的兩大類可遞送技術,都可以遞送像基因編輯蛋白那樣的大分子載體。
這兩種遞送技術主要是:
一是利用一些病毒能夠進入生物體的能力,來移除病毒本身的基因,將其取代為基因編輯蛋白的 DNA,讓基因編輯蛋白在遞送後,可以在細胞內表達並編輯相應的基因;
二是利用非病毒載體,最具有代表性便是已被廣泛用於疫苗的固體脂質納米粒。
但是,病毒型載體和非病毒型載體,各有各的優點和缺點。
病毒型載體,往往可以實作高效的遞送,但是由於可遞送的 DNA 大小,受限於病毒本身的基因大小,因此大分子蛋白往往要被一分為二,只有這樣才能載入到兩個載體中進行遞送。
而且當把基因編輯器以 DNA 形式遞送之後,會長期在細胞內表達,因此可能會產生一些副作用。
非病毒型載體,主要采用 mRNA 形式或蛋白形式來遞送基因編輯器,所以在進入細胞體內很快就會被分解。然而,在肝以外的器官之中,當前固體脂質納米粒技術的遞送效率並不樂觀。
因此,仍然需要一個新的載體,它不僅可以有效地遞送大分子蛋白,而且沒有大小的限制,最好能以短期內可自然分解的 mRNA、或蛋白的形式遞送,並且可以高效遞送到器官中。
兩年之前,該團隊開發了病毒樣顆粒(eVLP,engineered virus-like particle)來遞送堿基編輯器 [1]。
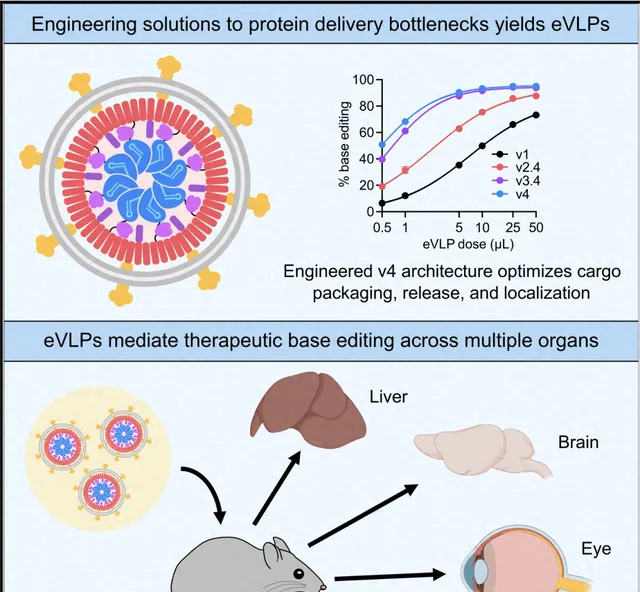
圖 | BE-eVLP(來源:Cell, 2022)
病毒樣顆粒,是一個類似病毒的載體,它具有病毒的外核,但是不包含病毒的基因,同時可以載入 mRNA 和蛋白,並能有效地遞送到細胞內。
可以說,eVLP 結合了病毒類和非病毒類的優點,並排除了它們各自的缺點,因此是一個非常理想的基因編輯器載體。
因此,該團隊也著重提高了在生產 eVLP、載入和遞送堿基編輯器時的效率,讓堿基編輯器能被高效率地遞送到各類細胞以及大腦、肝、眼睛等器官。
據了解,上一代的堿基編輯器可以將 DNA 堿基中的「A」更改為「G」, 或者將「C」更改為「T」。 而新一代的先導編輯器既能實作任意的更改,也能實作小規模 DNA 的增加和刪除,因此使用起來更加靈活,套用範圍也更廣泛。
在近期一項研究中,該課題組的博士生安美睿和同事透過最佳化先導編輯器的載入和遞送,開發了第三代 PE-eVLP,填補了此前的技術空白地帶,為遞送先導編輯器增加了一個新選項。
圖 | 安美睿(來源:安美睿)
這樣一來,先導編輯器不再需要被分載於多個載體,並能以可快速分解的蛋白形式遞送,從而能夠極大提高安全性、有效性和可生產性。
2023 年 12 月,美國食品藥品監督管理局批準了首個利用 CRISPR-Cas9 系統治療基因疾病的藥物。目前,利用堿基編輯器的臨床試驗正在進行中。
「預計在未來幾年之內,業內也將開展關於先導編輯器的臨床試驗,以用於治療廣泛的基因疾病。屆時,利用 eVLP 遞送先導編輯器的方式,或能在一些領域發揮用武之地。」安美睿表示。
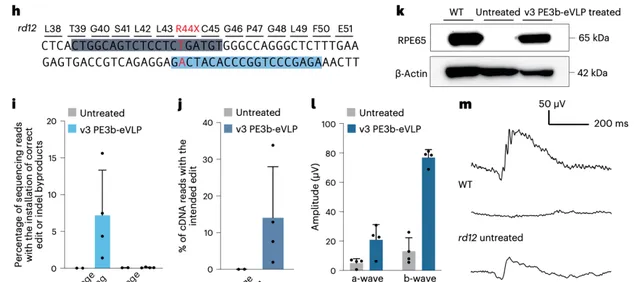
之所以能有這份底氣,是因為她和所在團隊針對基因突變引起 rd12 視盲癥的小鼠模型,利用 PE-eVLP 遞送先導編輯器後,7% 的小鼠視網膜細胞透過基因編輯得到了正確的基因順序。
並且這些小鼠不同程度地恢復了視力,這個案例有力證明了 PE-eVLP 被用於治療基因疾病的潛力。
(來源:Nature Biotechnology)
事實上,安美睿剛來到該課題組的時候,組裏正在進行 BE-eVLP 的開發,效果也非常不錯。當時,負責開發 BE-eVLP 的同事,曾經探索過能否直接照搬遞送堿基編輯器的系統來遞送先導編輯器。
然而,答案是否定的。因為僅僅簡單地把堿基編輯器換成先導編輯器,並不能有效地將先導編輯器於細胞內。
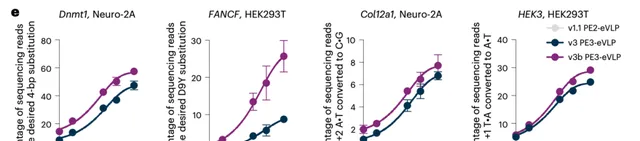
於是,在安美睿加入實驗室之後,她和同事決定專註於提高先導編輯器的遞送。研究中他們發現,雖然先導編輯器和堿基編輯器的構造大體雷同,但是由於先導編輯器的很多特性,導致其遞送效率降低。
透過剖析 eVLP 的形成、以及載入蛋白到遞送蛋白的每個過程,他們發現了影響遞送效率的因素,並利用不同策略最佳化了這些負面因素。
比如,用於先導編輯器的 gRNA(pegRNA),比用於堿基編輯器的 gRNA(sgRNA)結構更加復雜。
因此,pegRNA 的遞送效率相比 sgRNA 要低很多。後來,他們透過制定相關策略,提高了先導編輯器 pegRNA 的遞送效率。
事實上,每一次最佳化所帶來的進步都很微小,很多時候最佳化之後只比前一代提高 1.2 倍左右。甚至連安美睿自己也開始懷疑,這麽一點點的提高值得被認為是「進步」嗎?
而當第二代 PE-eVLP 在培養皿細胞中的遞送效率得以顯著提高後,他們進一步開展了動物實驗,測試了 PE-eVLP 在小鼠大腦的遞送效率。
然而測試結果比較慘淡,於是他們繼續進行最佳化,最終讓第三代 PE-eVLP 在小鼠模型的大腦和眼睛上都得到了優秀效果。
不積跬步無以至千裏,經過一層又一層的最佳化後,透過一個又一個小進步的積累,她和同事收獲了十分可觀的成果,相比第一代 PE-eVLP 在一些套用中的效率,第三代 PE-eVLP 的效率最終得到了 170 倍的提高。
(來源:Nature Biotechnology)
也正是在這項研究之中,安美睿第一次成為專案主導人。為了表征 PE-eVLP 在生物體中的遞送效率,必須得做小鼠實驗。
她說:「在進入這個專案之前,從未想象過自己會去做動物實驗,之前我幾乎害怕所有的動物。師姐可以幾秒內靈活地抓住一只小鼠,我卻需要先做心理準備,等到最後完成動作,往往需要幾倍的時間。」
但是接觸多了,她發現只要規範操作,就沒有什麽做不到的事。同時,她還學會了麻醉、註射、解剖等技能。
最終,相關論文以【用於體內瞬時遞送引物編輯器核糖核蛋白復合物的工程病毒樣顆粒】(Engineered virus-like particles for transient delivery of prime editor ribonucleoprotein complexes in vivo)為題發在 Nature Biotechnology [2]。
安美睿是第一作者,哈佛大學 David R.Liu 教授擔任共同通訊作者。

圖 | 相關論文(來源:Nature Biotechnology)
論文發表之後,也有一些其他實驗室向他們提出合作邀請。因此,後續安美睿計劃專註於開拓 PE-eVLP 在不同情境中的套用,從而實作更多的功能。
參考資料:
1.Banskota, S., Raguram, A., Suh, S. et al. (2022) Engineered virus-like particles for efficient in vivo delivery of therapeutic proteins. Cell , 185(2), 250-265 e216. https://doi.org/10.1016/j. cell .2021.12.021
2.An, M., Raguram, A., Du, S.W.et al. Engineered virus-like particles for transient delivery of prime editor ribonucleoprotein complexes in vivo. Nat Biotechnol (2024). https://doi.org/10.1038/s41587-023-02078-y
營運/排版:何晨龍











