編譯:微科盟 月亮魚,編輯:微科盟 景行、江舜堯。
微科盟原創微文,歡迎轉發轉載,轉載請註明來源於【轉錄組】公眾號。
導讀
種子硬度是毛豆的重要品質性狀。 為了確定影響種子硬度的因素,研究者從中國26個省份的216份大豆材料中選擇了兩種種子硬度差異較大的地方品種牛毛黃(低)和邳縣四粒糙(高) 。 研究者測定了毛豆種子中水分、可溶性糖、澱粉、蛋白質和油脂等主要成分的含量,並對種子發育的五個階段進行了轉錄組分析 。 轉錄組分析表明,在種子發育中後期,大量參與澱粉、貯藏蛋白和脂肪酸合成或降解的基因差異表達,導致牛毛黃和邳縣四粒糙種子成熟過程中貯藏物質積累的差異。 種子發育中後期的細胞增殖活性和細胞壁形成也可能在一定程度上影響種子的硬度。此外, 研究者采用加權基因共表達網絡分析(WGCNA)鑒定了調控種子硬度的共表達基因模組和樞紐基因 。 過表達候選種子硬度調控樞紐基因 GmSWEET2 導致種子硬度增加 。 本研究驗證了 GmSWEET2 在調節毛豆種子硬度中的重要作用 , 並確定了許多調控種子硬度和種子成分比例的潛在關鍵調節因子 ,為改善毛豆的口感奠定了基礎。
論文ID
原名: Genome-wide transcriptome analysis reveals key regulatory networks and genes involved in the determination of seed hardness in vegetable soybean
譯名: 全基因組轉錄組分析揭示了參與毛豆種子硬度的關鍵調控網絡和基因
期刊: Horticulture Research
IF: 7.6
發表時間: 2024年4月
通訊作者: 邢邯,郭娜,趙晉銘
通訊作者單位: 南京農業大學農學院
DOI號: 10.1093/hr/uhae084
實驗設計
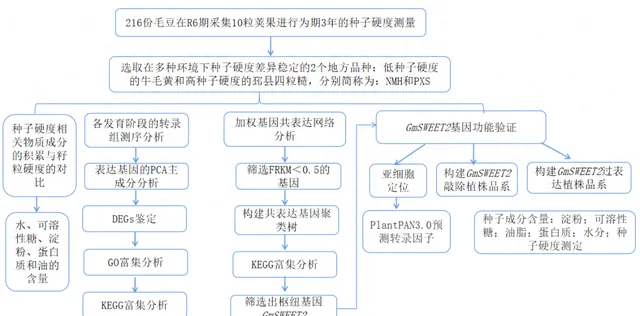
結果
1 216份大豆材料種子硬度評價
為了篩選滿足不同地區消費者偏好的不同種子硬度的毛豆品種,研究者在R6階段對中國26個省份的216個品種和地方品種的種子硬度進行了為期3年的測量。研究者用織構分析儀探針在穿刺過程中測量的機械功(W)來評價種子的硬度 ;2014年、2015年和2016年的W (g.mm)分別為581.3~1835.2、615.8~1647.0、549.0~1123.8(圖S1和表S1)。結果表明, 不同大豆品種在R6期種子硬度存在明顯差異。3年表型平均值顯示,46份種子硬度高(W>1000 g.mm), 36份種子硬度低(W<800 g.mm) ;其余為中等種子硬度(800 g.mm<W<1000 g.mm)。
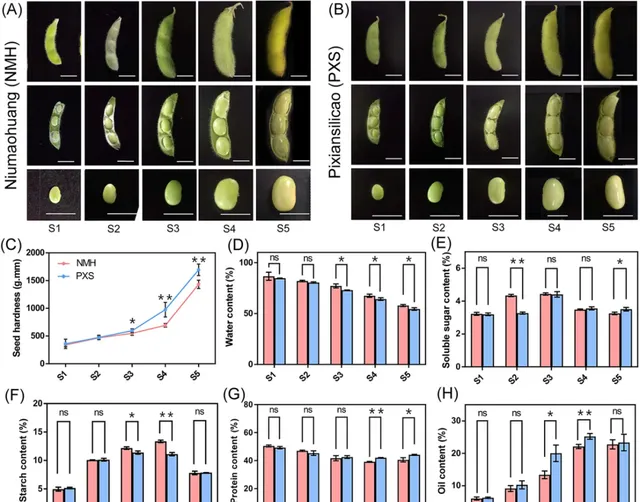
圖1.不同時期NMH和PXS種子硬度及組分含量。 (A, B) NMH和PXS不同發育階段(S1-S5)的豆莢和種子。(C) NMH和PXS在不同階段的種子硬度(以穿刺時測量的機械功表示)。數據以mean±SD表示(n=8個生物重復)。* P <0.05, ** P <0.01,Student’s t-test.。(D-H) S1-S5階段NMH和PXS中水、可溶性糖、澱粉、蛋白質和油的含量。數據以mean±SD表示(n=3個生物重復)。n,無顯著差異。* P <0.05,** P <0.01, Student’s t-test。
2 兩個地方毛豆品種種子硬度相關物質成分的積累與籽粒硬度的對比
研究者從216份大豆材料中選擇在多種環境下R6期種子硬度差異穩定的兩個地方品種,即:低種子硬度的牛毛黃和高種子硬度的邳縣四粒糙,分別簡稱為:NMH和PXS。研究者將種子發育分為S1-S5階段,其中S1-S3階段為始粒期後期(R5), S4階段為鼓粒期(R6),S5階段為成熟期的初期(R7,圖1A和B) 。在S1和S2階段,子葉正處於貯藏產物灌漿階段,但水分占種子重量的80%以上(圖1D),因此NMH和PXS在這兩個階段具有相同的柔軟質地。 NMH和PXS之間種子硬度的顯著差異首先出現在S3期,並在S4期變得更加顯著 (圖1C)。 為了評估種子硬度與種子成分積累之間的關系,研究人員測量了毛豆種子中主要成分的含量,包括水、可溶性糖、澱粉、蛋白質和油(圖1D-H)。隨著種子發育,NMH和PXS的含水量均呈下降趨勢,在後3個階段,NMH的含水量顯著高於PXS 。 NMH和PXS的可溶性糖含量均先上升後下降,在S3期達到峰值,然後下降,在S4和S5期基本趨於平穩 。在S2期,NMH的可溶性糖含量顯著高於PXS,而在S5期則相反。與可溶性糖相似, 澱粉含量也呈現先升高後降低的趨勢,在S3或S4期達到峰值,在S5期顯著降低 。在S3和S4期,NMH澱粉含量顯著高於PXS。在S4期之前,含油量隨著種子的發育逐漸增加。 2個品種在S3期和S4期的含油量差異顯著 。 蛋白質含量表現出先降低後增加的趨勢,在S4期達到最低,在S5期出現回升 ,這與前期對大豆種子發育過程中蛋白質含量變化的研究一致。後兩個階段,NMH的蛋白質含量顯著低於PXS。
3 兩個地方毛豆品種種子硬度差異的RNA-Seq分析
為了進一步研究不同地方品種種子發育差異的分子基礎,研究人員使用RNA-Seq技術生成轉錄組基因表現圖譜。在S1~S5期,研究者對NMH和PXS的大豆種子進行3個生物重復的取樣 。本研究共構建了30個文庫,獲得247.34 Gb的clean read。在不同的樣本中,Q30百分比超過90.85%,超過94.03%的clean reads被唯一比對到大豆基因組(表S2)。 研究者在NMH的S1、S2、S3、S4和S5期分別共鑒定出32716個、31360個、29000個、28450個和27726個轉錄本 。此外, 在所有五個階段均表達了23872個轉錄本 (圖2C)。同樣的, 研究者在PXS的S1、S2、S3、S4和S5期分別共鑒定出32475、30988、29372、28677和29100個轉錄本,在所有階段共表達25965個轉錄本 (圖2D)。 總的來說,隨著種子的發育,各階段表達的基因數量逐漸減少。 研究者將所有表達的基因基於FPKM分為三個表達水平。在不同的樣本中,至少60%的表達基因呈現低表達(0.5≤FPKM≤5)水平。約28.0%~37.5%和1.3%~2.0%的表達基因分別表現為中等(5≤FPKM≤100)和高(FPKM≥100)表達水平(圖S2)。
為了研究從轉錄組測序中獲得的大量資訊,研究人員對30個樣本的所有表達基因進行了主成分分析(PCA) (圖2)。從不同發育階段來看,NMH的S1、S2和S3階段聚集在一起,說明NMH在這三個發育階段的總體轉錄組基因表現譜相似。同樣,PXS的S2、S3和S4階段聚集在一起,表明它們的轉錄組基因表現譜高度相似。 從不同品種的角度看,在S1和S5階段,NMH與PXS呈高度相關。相反,NMH和PXS在S2、S3和S4階段表現出明顯差異,提示S2、S3和S4可能是導致表型差異的關鍵階段 。接下來, 研究人員根據30個組織樣本中所有表達基因的平均FPKM值進行了分層聚類和Spearman相關系數分析 ,如圖2B所示,與PCA結果基本一致。有趣的是,在NMH和PXS中,S2和S3樣本的總體轉錄組基因表現譜非常相似,相關系數分別為0.96和0.97。NMH的S2和S3期與S1期的相關性更強,而PXS的S2和S3期則傾向於種子發育的後期(S4)期。結果表明, 與NMH相比,PXS在種子發育的早期和中期表現出更快的發育。
研究者對每個發育階段的7個基因進行qRT-PCR分析,以驗證RNA-seq數據的質素。 qRT-PCR獲得的測試基因的表達模式與RNA-seq數據中觀察到的表達模式高度相似(圖S3),表明轉錄組和qRT-PCR分析之間的一致性。
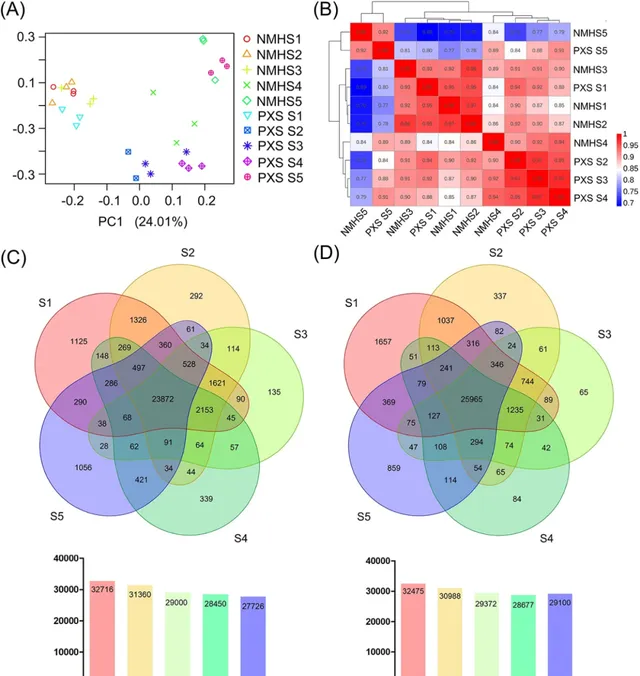
圖2. 種子發育過程中基因表現譜分析。 (A) NMH和PXS種子發育五個階段RNA-Seq數據的主成分分析。(B) RNA-seq數據的Spearman相關系數分析。(C和D) (C) NMH和(D) PXS五個階段檢測到的轉錄本的維因圖。
4 種子發育過程中差異表達基因的鑒定
研究人員對NMH和PXS在各發育階段的差異表達基因(DEGs)進行了兩兩比較。差異表達分析顯示,NMH與PXS之間在S1期有1519個基因、在S2期有4302個基因、在S3期有4553個基因、在S4期有2308個基因、在S5期有2663個基因存在差異表達 (|log2 (fold change)|≥1,FDR<0.05,圖3A)。 兩兩比較分析確定了各品種五個發育階段的DEGs 。不同發育階段的DEGs數量如圖3B所示。有趣的是, 研究者在PXS的S1期和S2期兩兩比較分析中發現,有3393個基因顯著差異表達,而在NMH中有175個 。相反, PXS的S3期和S4期鑒定出468個DEGs,而NMH的S3期和S4期鑒定出6171個DEGs 。大量的DEGs具有較強的代謝活性,加速了種子的發育行程。與其他相鄰階段相比,NMH和PXS在階段S2和S3之間鑒定出的DEGs較少。這些結果與PCA和相關分析結果一致,即: PXS在種子發育中前期的發育行程要快於NMH,且S2期和S3期的總體轉錄組基因表現譜高度一致。考慮到S2期和S3期的整體轉錄組基因表現譜具有較高的一致性,並且考慮到2個品種在S2期的種子硬度和種子成分含量幾乎沒有顯著的表型差異,研究人員在後續的研究中重點研究了S3期和S4期。
5 決定種子發育和種子硬度的基因差異表達
為了探究NMH和PXS在S3和S4階段(推測是決定種子硬度的關鍵階段)鑒定出的DEGs的功能,研究者進行了GO富集分析 ,顯著富集到多個GO條目(FDR<0.05)。圖3C和圖D分別顯示了S3和S4階段中最顯著的前20個GO條目。值得註意的是,在S3階段,「谷氨醯胺代謝過程」(GO:0006541)、「植物外膜發育」(GO:0080060)、「植物型細胞壁組織」(GO:0009664)和「轉運蛋白活性」(GO:0005478)顯著富集。「核小體」(GO:0000786)、「核小體組裝」(GO:0006334)、「核小體DNA結合」(GO:0031492)和「細胞增殖」(GO:0010456)等GO條目在S4期顯著富集,大部份相關基因在PXS中下調(圖S4),表明細胞有絲分裂和DNA復制在NMH S4期仍然相當活躍,這可能會減緩種子中儲存物質(如油和儲存蛋白)的積累,導致種子硬度降低。
研究者透過KEGG通路富集分析還發現了S3和S4階段的DEGs中顯著富集的代謝和訊息傳遞通路。 從S3和S4階段鑒定出的最重要的20個KEGG途徑如圖3E和f所示。「轉運體」(KO02000)、「甘油脂代謝」(KO00561)、「亞油酸代謝」(KO00591)、「糖解作用/葡萄糖新生」(KO00010)、「精胺酸和脯胺酸代謝」(KO00330)、「苯丙類生物合成」(KO00940)、「澱粉和蔗糖代謝」(KO00500)和「丙胺酸、天門冬胺酸和谷胺酸代謝」(KO00250)在S3階段顯著富集。「外泌體」(KO04147)、「亞油酸代謝」(KO00591)、「染色體及相關蛋白」(KO03036)、「糖解作用/葡萄糖新生」(KO00010)、「氮代謝」(KO00910)、「脂肪酸降解」(KO00071)和「賴胺酸降解」(KO00310)在S4階段富集。
研究發現,在S3和S4階段,顯著富集到一些影響種子硬度的合成和代謝途徑。研究人員分析了參與澱粉合成、澱粉降解、脂肪酸合成、儲存蛋白合成、木質素合成和DNA復制的關鍵基因的表達模式(圖S4) 。 在S4期,PXS中大部份澱粉合成酶基因的表達量低於NMH 。在S3期和S4期(尤其是S3期),PXS中參與澱粉降解的大多數基因包括編碼α-澱粉酶、β-澱粉酶和磷酸化酶的表達均上調。 與NMH相比,編碼種子貯藏蛋白的基因在PXS的S4和S5期表現出更高的轉錄活性。 其中編碼β-甘胺酸的2個基因 Glyma.20G146200 和 Glyma.20G148200 在PXS中的S1到S5階段上調振幅超過6倍。 在S4和S5階段,大部份與脂肪酸合成和延伸有關的 ,如編碼丙酮酸去氫酶、乙酰輔酶a羧化酶和乙酰基攜帶蛋白等蛋白質的基因在PXS中表達上調。PXS中編碼苯丙烷代謝和木質素合成相關蛋白的大部份基因,如CAD、4CL、HCT和CCoAOMT的表達量較高,尤其是在S3和S5期。在S2和S3階段,PXS中大多數與DNA復制和細胞增殖有關的基因的轉錄水平高於NMH,而S4階段則相反。

圖3. PXS和NMH在不同樣品中的差異表達基因。 (A) NMH和PXS在每個發育階段之間的DEGs數。(B) NMH(右上部份)和PXS(左下部份)各發育階段的DEGs數量。按FPKM >5, FDR<0.05,|log2(fold change)|≥1篩選DEGs。紅色或藍色的數碼分別表示行對應的樣本與列對應的樣本相比,上調或下調的基因數量。(C)和(D) S3 (C)和S4 (D)顯著性最高的前20個GO條目。(E)和(F) S3 (E)和S4 (F)顯著性最高的前20個KEGG通路。
6 加權基因共表達網絡構建及樞紐基因鑒定
研究者利用WGCNA對種子發育過程中的基因調控網絡進行了研究。 篩選低表達基因(FPKM<0.5)後, WGCNA保留31459個基因 。 研究者根據這些基因的共表達模式,構建了基因聚類樹狀圖,並鑒定出27個不同的模組(用不同的顏色標記) (圖4)。然後, 研究者基於模組特征值分析各個模組在不同樣本中的表達模式 (圖4B)。 2個品種在S3或S4期有7個模組的表達模式相反 (圖4D;圖S5A)。 antiquewhite1、darkolivegreen4、firebrick2和deepppink模組中的基因在NMH中高表達,而在S3或S4階段的PXS中表達水平較低。misyrose和skyblue2模組的基因在PXS中高表達,而在NMH中低表達 。此外, coral3模組具有品種特異性,僅在一個品種中高表達 。 研究人員構建了這7個模組的基因共表達網絡圖譜 (圖4C;圖S5B-G),其中每個網絡中心的基因為該模組的樞紐基因。表S3列出了屬於每個模組的所有樞紐基因。
為了明確這7個模組在大豆種子發育中的作用,研究人員進行了KEGG富集分析;從每個模組中辨識出的最顯著的10個KEGG通路 如圖S6所示。 透過KEGG富集分析,研究人員發現這7個模組可能在不同方面發揮作用,共同調節大豆主要貯藏物質含量和種子硬度 。 deeppink, mistyrose,darkolivegreen4,和coral3模組顯示出與蛋白質加工相關的KEGG通路的富集 ,如「內質網蛋白質加工」(KO04141)和「蛋白質加工」(KO99975)。 firebrick2模組富集「脂肪酸延伸」(KO00062)、「脂質生物合成蛋白」(KO01004)和「丙酮酸代謝」(KO00620) 。因此, 研究人員推測該模組主要參與大豆種子含油量的調節。Skyblue2模組參與澱粉和蔗糖代謝以及細胞壁合成 。澱粉和蔗糖代謝(KO00500)和苯丙素生物合成(KO00940)顯著富集在這個模組。該模組鑒定了編碼細胞壁合成相關蛋白的基因,如咖啡酸3-O-甲基轉移酶,纖維素合酶A催化亞基2 (CesA2)和shikimate O-羥基肉桂酰基轉移酶(HCT)。 值得註意的是,antiquewhite1模組在大豆發育的S4階段大量涉及澱粉、蛋白質和脂肪酸的合成和積累。 antiquewhite1模組包括45個基因,其中包括「丙酮酸代謝」(KO00620)、「糖解作用/葡萄糖新生」(KO00010)、「碳水化合物代謝」(KO09101)、「澱粉和蔗糖代謝」(KO00500)、「苯丙胺酸、酪胺酸和色胺酸生物合成」(KO00400)和「檸檬酸迴圈(TCA迴圈)」(KO00020)。1個糖外排轉運蛋白(SWEET)編碼基因( Glyma.03G209600 )和1個硝酸鹽轉運蛋白1/肽轉運蛋白家族(NPF)基因( Glyma.14G047200 )被確定為該模組的候選樞紐基因。此外,該模組還檢測到可溶性澱粉合成酶( Glyma.06G129400 )、丙酮酸激酶( Glyma.19G000700 )和果膠酯酶( Glyma.17G044700 )的編碼基因。
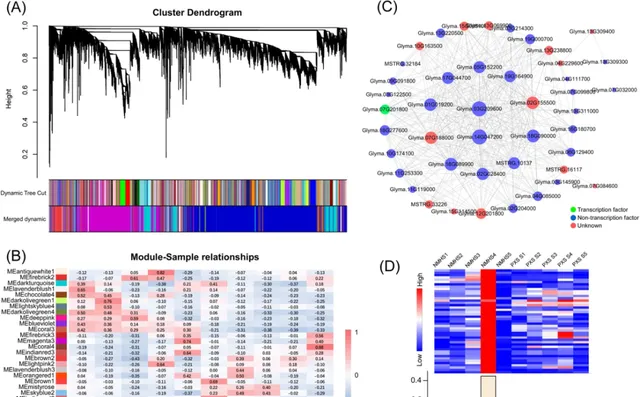
圖4. NMH和PXS表達基因的WGCNA。 (A)顯示WGCNA辨識的共表達模組的聚類樹狀圖。樹上的每一片葉子(短垂直線)代表一個基因。這些分支對應於高度關聯的基因模組。樹狀圖下方的顏色行表示根據聚類結果對模組進行劃分,並根據分層聚類對27個模組進行合並。(B)基於Pearson相關系數的模組-樣本關系。每一行對應一個用不同顏色表示的模組。每一列對應一個NMH或PXS不同階段的樣本。(C) antiquewhite1模組基因共表達網絡圖譜。節點大小表示基因環通度,節點顏色表示基因類別。候選樞紐基因位於每個模組的中心。(D)熱圖顯示了antiquewhite1模組中所有共表達基因的表達模式。直方圖顯示了不同樣本中表達的模組特征基因的變化。
7 GmSWEET2提高了R6期毛豆種子硬度
1個糖外排轉運蛋白(SWEET)基因Glyma.03G209600被鑒定為antiquewhite1模組的樞紐基因。在之前對大豆SWEET基因家族的研究中, Glyma.03G209600 被命名為 GmSWEET2 ,它被認為是AtSWEET9的同源物,並在質膜上運輸蔗糖。 研究人員比較了來自NMH和PXS的GmSWEET2的編碼DNA序列(CDS) 。如圖S7A所示, GmSWEET2 在NMH和PXS中的CDS是一致的。因此, 研究人員推測NMH和PXS之間種子硬度的差異可能是由GmSWEET2表達量的差異引起的 。研究者透過qRT-PCR驗證了 GmSWEET2 的組織表達模式(圖5A)。GmSWEET2幾乎只在花、豆莢和S4期種子等匯器官中表達,表明 GmSWEET2 在匯器官中解除安裝蔗糖,特別是在種子發育後期蔗糖從母體組織轉運到種子中發揮了重要作用。在S4期,與PXS相比,它在NMH種子中的表達量更高。
為了評估 GmSWEET2 在大豆種子硬度測定中的作用,研究人員在邳縣四粒糙(PXS)遺傳背景下培育了 GmSWEET2 -過表達轉基因品系( GmSWEET2 -OE) (圖5B)。R6期轉基因植株與野生植株的種子大小無顯著差異(圖S9)。然而, 與野生型(WT)植物相比, GmSWEET2 過表達導致R6期種子硬度顯著降低 (圖5C)。 為了進一步了解 GmSWEET2 誘導大豆種子硬度變化的機制,研究人員在R6期測定了野生型和 GmSWEET2 -OE品系的主要種子成分含量,包括澱粉、可溶性糖、油、蛋白質和水分含量 (圖5D-H)。 與野生型相比,GmSWEET2-OE植株的澱粉、可溶性糖、油脂和水分含量顯著增加,蛋白質含量顯著降低,這使得過表達植株在R6期的種子硬度較低。為了揭示GmSWEET2蛋白的亞細胞定位,研究人員將 GmSWEET2 與GFP融合在煙草葉片中表達 。如圖5I所示, GmSWEET2 -GFP融合蛋白定位在質膜上。
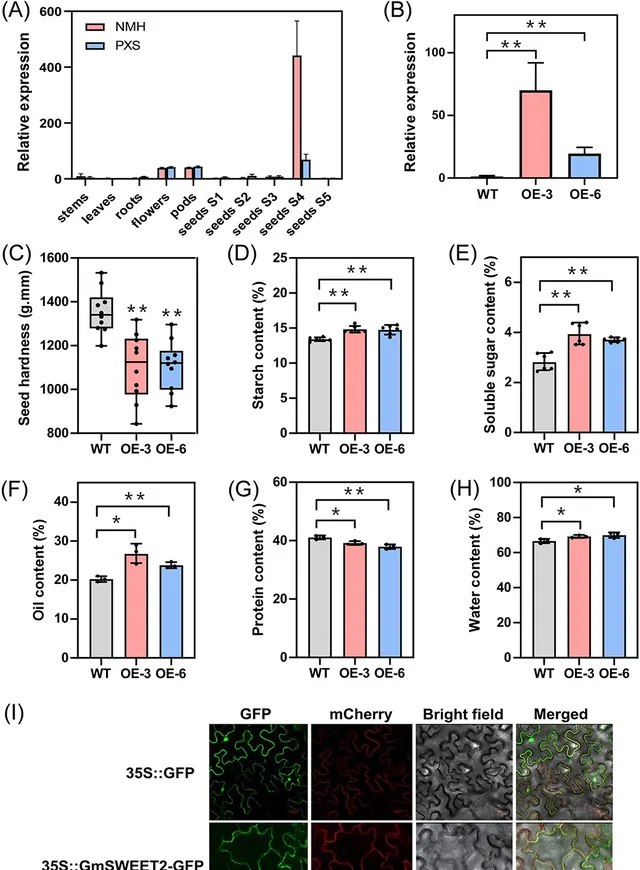
圖5. GmSWEET2改變了R6階段種子的硬度和成分含量。 (A) GmSWEET2 的組織特異性表達。采用qRT-PCR檢測 GmSWEET2 在大豆莖、葉、根、花、豆莢和種子中不同發育階段的相對表達量。(B) GmSWEET2 在WT (PXS)和 GmSWEET2 -OE系中的相對表達量。數據以mean±SD表示(n=3個生物重復)。* P <0.05, ** P <0.01,與WT比較,Student’s t-test。(C) WT (PXS)和 GmSWEET2 -OE系在R6階段的種子硬度。箱形圖顯示中位數(水平線)和個體值(黑點)(n=8個生物重復)。* P <0.05, ** P <0.01,與WT比較,Student’s t-test。(D-H) R6期WT (PXS)和 GmSWEET2 -OE系澱粉、可溶性糖、油脂、蛋白質和水分含量;數據以mean±SD表示[(D)和(E) n=6,(F)到(H) n=3]。n,無顯著差異。* P <0.05,** P <0.01,Student’s t-test。(I)35S::GmSWEET2-GFP表達融合蛋白在煙葉細胞中的熒光成像。Bars=20 μm。
討論
1 蛋白質和澱粉含量是決定毛豆硬度的關鍵因素
種子硬度是毛豆食用品質的主要指標之一。堅硬的質地通常會降低消費者對毛豆的接受度。因此,了解毛豆種子硬度的分子調控機制對提高毛豆的食用品質具有重要意義。 本研究從216份大豆材料中篩選出兩個毛豆地方品種NMH(穩定的低種子硬度)和PXS(穩定的高種子硬度) 。 NMH與PXS的硬度差異在代表R5(始粒期)期後期的S3期顯著,在S4期(對應大豆生殖生理階段的R6(鼓粒期)期,也是毛豆的收獲期)達到最大值。 作為種子的一種物理性質,硬度在很大程度上受種子化學成分的影響。可溶性糖,如蔗糖、葡萄糖和果糖有助於蔬菜大豆的甜味。以往對不同毛豆品種感官評價的研究表明,毛豆的咀嚼度與甜度呈負相關。然而, 在本研究中,2個品種在S4期的可溶性糖含量沒有顯著差異 。在水稻、玉米和鷹嘴豆的研究中也發現,種子硬度與蛋白質含量呈正相關,與澱粉含量負相關。 在S4期,與NMH相比,PXS的蛋白質含量較高,澱粉含量較低 。以往對小麥的研究發現,小麥籽粒的硬度似乎是由胚乳蛋白質基質和澱粉顆粒的物理結構決定的。硬質小麥有足夠的蛋白質形成連續的蛋白質基質來物理包裹澱粉粒,而軟質小麥不能形成連續的蛋白質基質來包裹澱粉粒,導致更軟、更開放的籽粒結構。 研究者對R6期毛豆種子微觀結構的觀察也發現,高硬度品種的種子蛋白質網狀結構更緊密,而低硬度品種的種子蛋白質含量更低,蛋白質結構更松散。蛋白質/澱粉比的降低導致種子結構更加開放,更多的水分填充澱粉粒與蛋白質基質之間的空隙,進一步降低了種子的硬度。在S3和S4期,高種子硬度地方品種PXS的含油量顯著高於低種子硬度地方品種NMH 。然而,一些研究表明成熟大豆的種子硬度與含油量呈顯著負相關,而對毛豆的研究表明含油量與種子硬度無顯著相關。毛豆種子的含油量與硬度之間的關系還有待進一步研究證實。
2 轉錄組分析揭示了毛豆種子硬度調控的關鍵途徑
與種子硬度表型相似,NMH和PXS之間的蛋白質、澱粉、油和水分含量在S3和S4期表現出顯著差異。 因此, 研究人員推測S3期和S4期是決定毛豆種子硬度的關鍵時期。PCA和DEG分析顯示,S1期PXS和S1、S2、S3期NMH的轉錄組基因表現譜比較相似,而S2、S3、S4期PXS和S4期NMH的基因表現譜比較相似,說明NMH在種子發育中前期比PXS發育緩慢 。鷹嘴豆和玉米的研究表明,早期快速發育可能與較小的顆粒大小有關,而大豆的種子大小與種子硬度呈負相關。
KEGG通路分析顯示,S3期NMH和PXS的DEGs在「精胺酸和脯胺酸代謝」和「丙胺酸、天門冬胺酸和谷胺酸代謝」等胺基酸代謝相關通路中顯著富集 。胺基酸是蛋白質的基本成分。有趣的是, 這些途徑的代謝物,如天門冬醯胺、谷氨醯胺和精胺酸,是蛋白質積累高峰階段(R5和R6階段)胺基酸濃度最高的 。作為灌漿期大豆氮素的重要來源,天門冬醯胺和谷氨醯胺含量與籽粒蛋白質含量呈正相關。此外, 「糖解作用/葡萄糖新生」在S3和S4階段的DEGs中都顯著富集,並且NMH中該途徑所含基因的表達水平高於PXS 。以往的研究發現,玉米和鷹嘴豆有絲分裂活性的延長伴隨著較高的葡萄糖新生。當種子獲得足夠的糖供應時,不會發生葡萄糖新生;然而,在大豆種子發育後期,隨著母體營養供給的減少,丙酮酸和甘油作為原料透過葡萄糖新生步驟不斷積累碳水化合物。因此, 研究人員觀察到,從S4期到S5期,由於母體營養供應的減少和葡萄糖新生的消耗,種子中油脂的積累速率顯著降低。然而,澱粉和可溶性糖含量沒有增加,這可能是由於澱粉在種子發育後期被降解為可溶性糖,然後轉化為脂肪酸、磷酸甘油和胺基酸, 這在其他物種中已經得到證實。 S3期DEGs中「苯丙烷生物合成」相關基因顯著富集,且PXS中大部份編碼苯丙烷代謝和木質素合成關鍵酶的基因如4CL、C4H和HCT的表達量較高 。苯丙烷代謝途徑是植物重要的次生代謝途徑之一,木質素是苯丙烷代謝的重要代謝物。早期的研究表明,木質素可以提高豆科作物如大豆和鷹嘴豆的種皮強度。 「澱粉和蔗糖代謝」在第S3期顯著增加。此外,與NMH相比,研究人員發現大多數澱粉降解基因在S3期的PXS中表現出較高的轉錄活性,而編碼澱粉合成酶的基因在S4期的PXS中表現出較低的轉錄活性。這就解釋了為什麽在S3期和S4期PXS的澱粉含量高於NMH。與脂肪酸合成和延伸有關的基因以及編碼儲存蛋白的基因在S4和S5期的PXS中表現出較高的轉錄活性,這與S4和S5期PXS中較高的蛋白質和油脂含量是一致的。
3 GmSWEET2在調節毛豆種子硬度中起重要作用
作為系統生物學的一個強大工具,在許多作物中,WGCNA已被用於辨識關鍵遺傳網絡。 在本研究中,研究人員發現NMH和PXS在S3或S4階段有7個模組表現出相反的表達模式。透過對這7個模組的KEGG通路富集分析,研究人員發現antiquewhite1模組主要與蛋白質、澱粉、脂肪酸等成分的代謝和積累有關。
antiquewhite1模組在NMH的S4期高表達。 該模組的樞紐基因為糖最終出口轉運蛋白編碼基因 GmSWEET2 和硝酸鹽轉運蛋白/肽轉運蛋白家族(NPF)編碼基因 GmNPF6.4 。蔗糖是透過韌皮部向發育中的種子輸送碳能量的主要來源。它依靠蔗糖載體和蔗糖外排轉運體來實作有效的運輸和分配。糖被認為在糖轉運到種子中起著重要作用,從而影響種子的發育和化學成分。 GmSWEET2 位於已報道的種子蛋白含量QTL中。NPF轉運體廣泛參與植物對氮的吸收利用過程,在提高作物氮素利用效率和產量方面發揮著重要作用。此前對水稻和玉米的研究表明,NPF轉運體影響籽粒發育和澱粉、蛋白質等貯藏物質的含量。
在本研究中, GmSWEET2 過表達導致R6期種子中澱粉、可溶性糖和油脂含量增加,蛋白質含量降低。 GmSWEET2 定位於質膜,在R6期種子中高表達,介導蔗糖向發育中的種子解除安裝。 在植物的貯藏器官中,澱粉合成的原料主要來自於葉片中合成的蔗糖,透過韌皮部遠距離運輸到貯藏器官。同時,蔗糖也是乙酰輔酶a的主要來源,乙酰輔酶a是脂質生物合成的前體。 當 GmSWEET2 表達水平升高時,會伴隨更多的蔗糖從母體組織轉移到發育中的種子中,導致種子中澱粉和油脂積累更多。 此外,蛋白質合成依賴於碳和氮的可用性。隨著SWEET糖轉運體活性的增加,氮的有效性可能成為一個限制因素,更多的糖解作用中間體轉向脂肪酸合成途徑,從而降低相對蛋白質含量。 蛋白質/澱粉比的降低導致種子無法形成更緊密的蛋白質網狀結構來包裹澱粉顆粒,導致種子結構更柔軟、更開放,從而降低了種子硬度。在本項研究中,研究人員還使用了CRISPR/Cas9敲除牛毛黃的 GmSWEET2 基因(NMH),獲得了兩個純合子 GmSWEET2 敲除系( GmSWEET2 -KO,圖S8A和B) 。然而, GmSWEET2 -KO植株與野生型植株在R6期的種子硬度沒有顯著差異 (圖S10),這可能是因為SWEET家族含有許多協同工作的基因,具有一定的冗余性,導致在敲除 GmSWEET2 後,SWEET家族的其他基因在一定程度上替代了 GmSWEET2 的作用。 雖然 GmSWEET2 的表達水平在NMH和PXS之間存在顯著差異,但GmSWEET2的啟動子序列在兩個地方品種中是一致的(圖S7B),這可能是由於NMH和PXS之間結合啟動子並調節GmSWEET2表達的轉錄因子存在差異。根據PlantPAN3.0的預測,905個轉錄因子有可能與 GmSWEET 2啟動子結合,其中35個轉錄因子在PXS和NMH中有差異表達,包括ERF、NAC、WRKY、bHLH等轉錄因子家族 (表S5)。這些轉錄因子在毛豆種子硬度調控中的具體作用有待進一步研究。
綜上所述, GmSWEET2 糖轉運蛋白透過提高澱粉含量和降低蛋白質含量來降低R6期大豆種子的硬度。 本研究的綜合轉錄組數據的分析為毛豆品質性狀的研究提供了有用的基因組資源,並為大豆種子發育的分子網絡提供了新的見解。











