機體的膽固醇穩態由各種組織相互協調,以保持外源膽固醇吸收、內源膽固醇從頭合成以及膽汁清除和外排之間的平衡。血液中膽固醇水平升高,尤其是低密度脂蛋白膽固醇(LDL-C)水平升高,是引發動脈粥樣硬化等心腦血管疾病的重要風險因素。他汀類藥物、PCSK9抑制劑等心腦血管疾病一線用藥也主要透過降低LDL-C發揮功能。外源膽固醇的吸收增加會抑制內源膽固醇的合成,而外源膽固醇攝入不足會啟用內源膽固醇的合成。
膽固醇自身作為訊號分子透過抑制SCAP-SREBP復合體活性負反饋調節細胞的膽固醇合成。小腸是外源膽固醇吸收的場所,肝臟是內源膽固醇合成的主要器官,腸道膽固醇吸收和肝臟膽固醇合成之間是否存在獨立於膽固醇的調節通路尚不清楚。
3月18日,清華大學生命科學學院王一國副教授團隊與南方醫科大學南方醫院張惠傑教授團隊在【細胞】( Cell )期刊線上發表了題為「一種腸源激素對膽固醇代謝的調控」(A gut-derived hormone regulates cholesterol metabolism)的研究論文,首次發現並命名了一種腸道激素Cholesin(腸抑脂素),揭示了Cholesin調控機體膽固醇穩態的作用和機制。
為了確定參與介導腸道膽固醇吸收和肝臟膽固醇合成的調節因子,研究者對禁食過夜後餵食普通飲食(Regular Diet,RD)或含有高膽固醇西方飲食(Western Diet,WD)1小時的小鼠血漿蛋白進行富集和銀染分析,發現餵食WD後在23kDa左右有明顯增強條帶。借助質譜技術確定該蛋白為未表征基因3110082I17Rik編碼的蛋白,是人源C7orf50的同源蛋白。
基於其對肝臟膽固醇合成的抑制作用,研究者將其命名為Cholesin(腸抑脂素)。透過分析Cholesin的組織分布,發現Cholesin在腸道中高表達,結合腸道是膽固醇吸收的主要器官,研究者推測Cholesin可能由腸道分泌,因此構建了腸道特異性敲除Cholesin的小鼠作為進一步研究的工具。後續結果表明腸道特異性敲除Cholesin的小鼠相比於野生型小鼠基本不再響應進食或膽固醇刺激下的Cholesin分泌,說明Cholesin是一種響應膽固醇刺激的腸道激素。此外,研究者發現Cholesin主要在吸收性腸細胞表達,其分泌依賴於NPC1L1介導的膽固醇吸收。
為了探究Cholesin的功能,研究者透過分析GWAS數據找到了Cholesin中與人體血漿總膽固醇水平顯著相關的SNPrs1007765。進一步對收集所得的600例人類臨床樣本進行檢測,研究者發現血漿Cholesin水平與血漿總膽固醇水平糊LDL-C水平呈較強負相關性,而攜帶rs1007765次要等位基因的人群血漿Cholesin水平顯著上升,但血漿總膽固醇水平糊LDL-C水平降低,驗證了此前的GWAS分析結果。機制上,rs1007765定位於強化子區域,促進Cholesin的表達。
同時研究者利用腸道特異敲除Cholesin的小鼠探究了腸道分泌Cholesin在膽固醇穩態中的作用機制。腸道特異敲除Cholesin的小鼠在餵食普通飲食或西方飲食的雄性和雌性小鼠中,血漿總膽固醇水平都高於對照組小鼠,血漿脂蛋白各組分的膽固醇含量均有升高,該表型產生的原因是肝臟膽固醇合成和VLDL的分泌增加,說明Cholesin本身的作用是抑制肝臟膽固醇合成。研究者利用全基因組CRISPR/Cas9篩選鑒定了Cholesin的受體是GPR146。GPR146是A類GPCR孤兒受體。武漢大學王琰教授實驗室與哈弗醫學院乍得·考恩(Chad A. Cowan)教授實驗室前期研究發現肝臟GPR146是調節膽固醇代謝的關鍵受體,人群中GPR146的基因突變導致高膽固醇血癥。該研究進一步發現Cholesin能夠透過與GPR146結合抑制PKA訊號,從而抑制肝臟中由SREBP2介導的膽固醇合成。
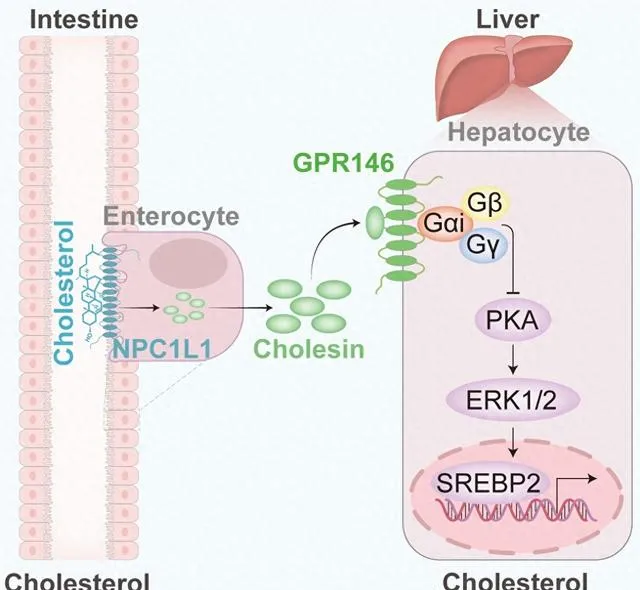
腸道來源的Cholesin抑制肝臟膽固醇合成
研究者發現外源註射Cholesin能抑制小鼠肝臟膽固醇的合成,對Ldlr基因剔除構建的高膽固醇血癥與動脈粥樣硬化的小鼠模型,外源註射Cholesin能降低小鼠血漿中的總膽固醇水平,並且對於動脈粥樣硬化也有較好的治療作用,而聯合瑞舒伐他汀效果更佳。綜上,該研究首次發現了腸道激素Cholesin,證明了Cholesin-GPR146軸介導腸道膽固醇吸收對肝臟膽固醇合成的抑制作用,闡明了Cholesin在調控膽固醇穩態中的重要作用,為動脈粥樣硬化等膽固醇代謝異常疾病提供了潛在靶點。
王一國、張惠傑為論文共同通訊作者,清華大學生命科學學院2018級博士生胡曉麗和2019級博士生陳豐藝為論文共同第一作者。此外,王一國實驗室已畢業的賈良傑博士、博士後隆艾君、博士後彭穎,2020級博士生房欣蕾和高梓華,南方醫院張惠傑教授團隊2021級碩士生李旭、黃俊鋒和魏雪雲醫師,清華大學陳曄光教授及團隊2017級博士生張孟賢,武漢大學王琰教授及團隊博士後劉笑也對該研究作出了重要貢獻。清華大學鄧海騰教授,海軍軍醫大學章衛平教授,武漢大學宋保亮教授,澳洲新南威爾士大學楊洪遠教授和北京大學陳曉偉教授對該研究提出了建議和幫助。研究得到科技部、國家自然科學基金委和清華-北大生命科學聯合中心的支持。
論文連結:
https://www.cell.com/cell/fulltext/S0092-8674(24)00226-5











