撰文:高銘凰
腦膜淋巴管位於硬腦膜內,沿硬腦膜中動脈繞行,最終與頸靜脈相伴,經顱底裂孔離開大腦( 圖1 )。目前研究發現,腦膜淋巴管是中樞神經系統與外周淋巴管溝通的關鍵通道,可將腦脊液中的大分子蛋白、免疫細胞和代謝產物以CCL21/C-C趨化因子受體7型依賴的方式引流至外周淋巴系統[1, 2]。大腦免疫系統主要由腦實質駐留的小膠質細胞和邊界免疫細胞(包括硬腦膜內的髓系細胞和淋巴細胞)組成,形成中樞神經系統嚴密的免疫網絡[3]。大腦邊界免疫細胞涵蓋了邊界相關巨噬細胞、樹狀細胞、T細胞、B細胞、單核球、嗜中性球、自然殺傷細胞和先天類淋巴細胞等多種免疫細胞群體[4-6],具有獨特的地理位置和細胞多樣性,從而構成一個動態的免疫生態席位( 圖2 )。這些免疫細胞群體分泌多種細胞因子到腦脊液,並擴散到腦實質,從而影響特定的神經元亞群而產生不同的行為反應及疾病應對方式。與此同時,這些免疫細胞群影響與中樞神經系統相關的免疫反應,並隨著年齡的增長而改變,導致一系列炎癥和神經退行性疾病。因此,探究腦膜淋巴管與中樞神經系統免疫細胞之間的交流對進一步探索腦膜淋巴管在在神經退行性疾病的組織生理學和病理學中的作用具有重要意義。
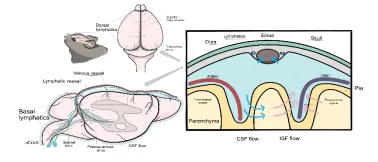
圖1腦膜淋巴囊泡及腦脊液和腦間質液引流途徑
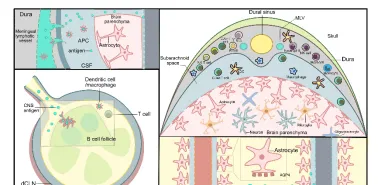
圖2腦膜內的免疫概況和中樞神經系統抗體遞送途徑
最近來自中國廣州中醫藥大學王奇團隊在【中國神經再生研究(英文版)】(Neural Regeneration Research)上發表了題為「 Meningeal lymphatic vessel crosstalk with central nervous system immune cells in aging and neurodegenerative diseases 」的綜述。該文概述了腦膜淋巴管在中樞神經系統免疫網絡中的多方面作用,探討了中樞神經系統穩態和神經退行性疾病病理中腦膜淋巴管與免疫細胞之間的串擾作用。該文提出了在衰老和神經退行性疾病中,腦膜淋巴管結構和功能的調控可能會影響淋巴引流、腦脊液中的免疫神經調節因子和免疫細胞群,從而在塑造腦膜和腦實質免疫中發揮關鍵作用的觀點。
最初人們認為腦膜淋巴管只是大腦一條「排泄垃圾」的通道,但現在人們已經清楚,腦膜淋巴管與中樞神經系統免疫細胞共同形成並維持了一個緊密交織的腦膜淋巴-免疫網絡,這是中樞神經系統免疫功能充分發揮的一個重要前提。透過腦膜淋巴管提供的通訊途徑,腦膜免疫細胞可以在腦脊液和外周免疫系統之間進行遷移,外周免疫系統可以從引流的腦脊液中采集到大腦代謝訊號進行免疫反應。與此同時,腦膜來源的細胞因子透過膠質淋巴系統的血管旁內流進入腦實質直接影響神經細胞,調控大腦內穩態和病理反應。因此,當腦膜淋巴管損傷時,經腦膜淋巴管聯通的細胞因子也會受到影響,這可能與細胞因子分泌失衡及腦內毒性分子堆積相關[1, 7]。
髓系細胞作為一類異質性的先天性免疫細胞,在中樞神經系統發育和成年過程中對維持中樞神經系統的平衡發揮著重要作用;這些髓系細胞包括實質小膠質細胞和非實質巨噬細胞,如軟腦膜巨噬細胞、血管周圍巨噬細胞和脈絡叢巨噬細胞,以及樹突細胞和單核球的各種亞群[8]。
腦淋巴內皮細胞和小膠質細胞之間的串擾關系在中樞神經系統定植早期就已初見苗頭並在中樞神經系統健康和疾病中發揮著重要作用。腦邊界淋巴管是MRC1/Mrc1小膠質細胞前體在胚胎斑馬魚大腦中早期定殖的中心位置,這與傳統的pu1陽性卵黃囊來源的小膠質細胞譜系定殖位置並不一致[9]。因此,最早的MRC1/Mrc1小膠質細胞前體可能起源於或依賴於大腦淋巴內皮細胞。但值得註意的是,這些腦淋巴內皮細胞僅來自斑馬魚淋早期淋巴內皮細胞的群體,而不是來自小鼠的淋巴管內皮細胞,這值得進一步研究討論。此外研究發現,在成熟的中樞神經系統中,小膠質細胞可與淋巴管內皮細胞協同清除腦代謝產物,淋巴管內皮細胞主要對可溶性大分子和較小顆粒具有內吞作用(包括蛋白質、多糖和較小的受質,如人類乳頭瘤病毒等),而小膠質細胞可能專門吸收較大的顆粒和病原體[10]。因此,雖然具體的交換機制和途徑尚未明確,但科學家們已經認識到小膠質細胞可透過調節旁分泌訊號在中樞神經系統功能和疾病行為中發揮重要作用。腦膜淋巴管作為一個重要的免疫引流途徑,可能可以透過改變分泌訊號的可及性及及時性,從而調控大腦細胞的反應[11]。與此同時,中樞神經系統中的巨噬細胞、樹突細胞等免疫細胞以及星形膠質細胞和血管內皮細胞等神經系統細胞也可透過分泌白細胞介素和血管內皮生長因子等可溶性介質重塑腦膜淋巴管的結構和功能[12, 13]。樹突細胞和巨噬細胞等中樞神經系統抗原呈遞細胞受淋巴管內皮細胞表達的蛋白調控,包括CCL21、CCL27、1-磷酸鞘磷脂、集落刺激因子1、血管細胞粘附分子1和細胞間粘附分子1等[14],這有助於中樞神經系統抗原的傳遞以啟用外周免疫細胞並進一步遷移到中樞。因此,腦膜淋巴管在呈遞中樞抗原到外周頸部淋巴結的過程中發揮了關鍵作用,這有助於中樞神經系統免疫與外周免疫中建立緊密聯系。
在穩態條件下,B細胞在中樞神經系統實質和腦脊液白細胞總數占比中不到 1%[15];在硬腦膜內占比約為 30%[16]。而病理狀態下時,硬腦膜中B細胞會形成淋巴濾泡樣結構,從而在中樞神經系統中產生持續的免疫病理反應[17, 18]。研究人員利用單細胞RNA測序技術,檢測到骨髓來源的不同時期B細胞(包括幼稚B細胞、過渡B細胞、成熟B細胞)同時存在於穩態的硬腦膜[19]。因此推測早期B系祖細胞可能在發育早期就已經遷移到中樞神經系統中定殖,並在局部發育與成熟。但目前關於腦膜B細胞是來源於顱內骨髓薄層中的祖細胞庫,還是直接來源於硬腦膜中獨立於骨髓的祖細胞的研究尚無定論[20]。這並不妨礙這是一個有趣的發現,因為這些發育中的B細胞在硬腦膜中這一特殊的起源與發育位置可能有助於它們辨識並建立針對中樞神經系統抗原的自身性免疫耐受。然而,隨著年齡的增長,從外周浸潤而來的累積的年齡相關 B 細胞和漿細胞占據了腦膜中發現的大多數族群[19],這導致了神經退行性疾病和神經系統自身免疫性疾病的高發病率,這與在老年小鼠發現的腦膜淋巴管出現的功能障礙的時間軸相一致。除了顱骨骨髓內的細胞庫外,淋巴細胞的另一個補充來源是外周免疫系統中的頸深淋巴結。頸部淋巴結已被驗證在維持T細胞亞群匯集及經腦膜淋巴管為中樞神經系統抗原與淋巴細胞相遇提供啟用空間的方面發揮著重要作用[19]。穩態情況下,腦膜淋巴管為腦源性抗原引流至頸深淋巴結提供了一個直接通道,進一步補充了機體對中樞神經系統抗原的自身免疫耐受[21]。因此,腦膜淋巴管為獨立於骨髓和胸腺之外的腦源性免疫抗原完善補充了自身免疫耐受途徑,這有助於維持中樞神經系統免疫豁免。而當衰老或神經系統疾病導致腦膜淋巴管功能失調時,這種免疫豁免就會被打破,引起中樞神經系統免疫功能失調。
除了在完善自身免疫耐受中發揮作用,腦膜淋巴管對促進淋巴T細胞與中樞神經細胞之間的溝通中也發揮著重要作用。研究發現,腦源性抗原經腦膜淋巴管引流至外周頸深淋巴結後會引起T細胞啟用,在CCL21趨化因子的作用下經腦膜淋巴管向大腦遷移[22],在腦實質病竈部位與同源性抗原再次相遇後進一步活化發揮效應作用[23]。因此,腦膜淋巴引流是腦源性T細胞形成與遷移的必要調減。此外,腦膜淋巴管為T細胞與小膠質細胞和神經元等實質膠質細胞連線和溝通的提供了重要途徑。一般來說,小膠質細胞和T細胞在中樞神經系統發育和內穩態中各自起著重要作用;而在病理情況下,啟用的小膠質細胞和/或巨噬細胞可能與經腦膜淋巴管出入腦實質中的腦源性T細胞的相遇,從而增強了它們加劇損傷的能力,導致神經炎癥和神經病理的惡化。因此,靶向調控腦膜淋巴管可能是調節大腦免疫反應的重要途徑。
在神經退行性疾病中,常常會出現血管炎癥、血腦屏障功能受損、蛋白質沈積異常和腦膜淋巴系統引流的病理變化。如研究發現在老齡人群中,膠狀淋巴系統和淋巴系統都出現了結構與功能損傷,伴隨腦內間質液和代謝產物堆積於擴張的血管旁間隙中,造成脈動的振幅減緩並引起神經毒性蛋白在腦實質中積累,從而引起或加重神經退行性疾病病理改變[24]。此外,在腦膜RNA測序分析中發現老齡化小鼠的淋巴管內皮細胞基因與幼齡小鼠淋巴管內皮細胞基因譜在免疫、炎癥、細胞粘附等方面具有明顯差異,說明了淋巴管功能隨著年齡遞增而出現了功能的減退[1]。腦膜淋巴管功能的損傷進一步引起神經遞質、趨化因子、抗原等大腦細胞分泌的不同訊號的紊亂,導致大腦內白細胞浸潤及神經系統功能紊亂[25]。因此,調控腦膜淋巴管在一定程度上可以促進或限制衰老和神經退行性疾病的發病機制,成為神經炎癥和神經退行性疾病的關鍵調節靶點。
阿爾茨海默病以澱粉樣蛋白β沈澱和神經纖維纏結為主要病理特征,伴隨突觸功能障礙和神經元死亡[26]。研究發現在衰老與阿爾茨海默病疾病模型中,腦膜淋巴管功能損傷加重了神經毒性蛋白沈積[27],引起腦脊液灌註損傷[28],加重學習和記憶障礙[29]。此外,先天性免疫反應中小膠質細胞的啟用、補體成分和趨化因子分泌紊亂在阿爾茨海默氏病早期就被發現[30],適應力免疫反應中T細胞在腦內的浸潤對老年斑負荷的加重[31]和加快神經變性[32]等均有研究報道。因此,腦膜淋巴管有助於清除病理性蛋白的沈積和改善免疫系統紊亂,為阿爾茨海默病提供了一種潛在的治療方法。自身免疫性腦脊髓炎是一種神經脫髓鞘退化性疾病,其特征是來自迴圈的單核球來源的巨噬細胞和T細胞的浸潤及小膠質細胞的啟用[33]。在疾病行程中,自身抗原反應性T淋巴細胞T細胞遷移到中樞神經系統從而引發炎癥級聯反應。此外脊髓炎患者硬腦膜中發現卵泡樣淋巴結構(含B細胞、漿細胞、T細胞和樹狀細胞)[34],提示了腦膜是疾病行程中一個重要免疫反應區域。考慮到腦膜淋巴管在連線中樞與外周免疫細胞遷移中的通道作用,研究人員在在自身免疫性腦脊髓炎小鼠模型中評估了腦膜淋巴功能障礙和免疫細胞失調之間的關系,發現腦膜淋巴管在疾病進展期間淋巴T細胞在硬腦膜中的聚集和向大腦中的遷移過程中發揮著重要作用[3],而阻斷腦膜淋巴管功能可以降低腦源性T細胞的數量,減輕炎癥反應,延緩疾病行程。帕金森病以運動異常和認知障礙為主要臨床特征,主要病理表現為細胞內α-突觸核蛋白(「路易小體」)聚集。研究發現帕金森患者腦膜淋巴管腦脊液灌註明顯減少,頸淋巴結淋巴液灌註出現延遲,這為帕金森患者腦膜淋巴管功能下降提供了臨床證據[35]。在轉基因小鼠中α-突觸核蛋白沈積程度與腦淋巴流量成反比,阻斷淋巴引流後病理程度加重[36],這支持了腦膜淋巴管在帕金森病中的重要引流作用。除了腦內常駐的小膠質細胞啟用外,患者腦脊液與腦實質中活化T細胞和B細胞水平也出現了增高[37]。這些啟用的T細胞或者免疫球蛋白在多巴胺能神經元和路易小體周圍的聚集,提示了免疫細胞的紊亂與神經元功能的喪失密切相關[38, 39]。因此大腦神經毒性蛋白沈積伴隨免疫細胞紊亂與腦膜淋巴管功能密切相關,腦膜淋巴管為帕金森靶向治療提供了一個潛在的途徑。
王奇等提出,腦膜淋巴管可將腦脊液中的代謝物、細胞碎片和大分子蛋白質排入外周淋巴系統,維持中樞神經系統的穩態及功能[40, 41];另一方面,腦膜淋巴管協助中樞神經系統的免疫反應,聯通外周免疫細胞和中樞神經系統免疫細胞進而在調控大腦的病理反應。文末作者提出了關於腦膜淋巴管進一步研究的4個具體方向:(1)腦膜淋巴管利用了哪些分子與中樞神經系統免疫細胞進行交流,串擾的具體機制是什麽?(2)如何以及在多大程度上調控腦膜淋巴管的可塑性可以達到治療目的?(3)中樞神經系統透過腦膜淋巴管誘導中樞神經系統邊界免疫細胞的遷移以及新鮮免疫細胞(如來自顱骨骨髓或外周淋巴結的免疫細胞)的生成和更新以補充減少的免疫細胞群的具體機制是什麽?(4)中樞神經系統免疫如何在穩態或各種神經系統疾病中間調節多核淋巴細胞的功能和形態,及硬腦膜中免疫細胞的動態變化是否會影響腦膜淋巴管的結構與功能?除此之外,遺傳、血管、環境和生活方式等因素如何在自然衰老和神經系統疾病中影響腦膜淋巴管的結構功能也是另一個非常值得研究的方向。因此,雖然作者在這篇綜述中只討論了腦膜淋巴管與中樞神經系統免疫系統之間的關系,但考慮到其復雜性和異質性,腦膜淋巴應與其他病理因素結合起來作為治療靶點,以期預防、阻止並嘗試逆轉神經退行性疾病的臨床過程。
原文連結:https://doi.org/10.4103/NRR.NRR-D-23-01595
參考文獻
[1] Da Mesquita S, Fu Z, Kipnis J. The meningeal lymphatic system: a new player in neurophysiology. Neuron. 2018;100(2):375-388.
[2] Eide PK, Vatnehol SaS, Emblem KE, et al. Magnetic resonance imaging provides evidence of glymphatic drainage from human brain to cervical lymph nodes. Sci Rep. 2018;8(1):7194.
[3] Louveau A, Herz J, Alme MN, et al. CNS lymphatic drainage and neuroinflammation are regulated by meningeal lymphatic vasculature. Nat Neurosci. 2018;21(10):1380-1391.
[4] Raper D, Louveau A, Kipnis J. How do meningeal lymphatic vessels drain the CNS? Trends Neurosci. 2016;39(9):581-586.
[5] Escobedo N, Oliver G. Lymphangiogenesis: origin, specification, and cell fate determination. Annu Rev Cell Dev Biol. 2016;32:677-691.
[6] Kim H, Kataru RP, Koh GY. Inflammation-associated lymphangiogenesis: a double-edged sword? J Clin Invest. 2014;124(3):936-942.
[7] Da Mesquita S, Louveau A, Vaccari A, et al. Functional aspects of meningeal lymphatics in ageing and Alzheimer's disease. Nature. 2018;560(7717):185-191.
[8] Kumaravelu P, Hook L, Morrison AM, et al. Quantitative developmental anatomy of definitive haematopoietic stem cells/long-term repopulating units (HSC/RUs): role of the aorta-gonad-mesonephros (AGM) region and the yolk sac in colonisation of the mouse embryonic liver. Development. 2002;129(21):4891-4899.
[9] Green LA, O'dea MR, Hoover CA, et al. The embryonic zebrafish brain is seeded by a lymphatic-dependent population of mrc1(+) microglia precursors. Nat Neurosci. 2022;25(7):849-864.
[10] Huisman Y, Uphoff K, Berger M, et al. Meningeal lymphatic endothelial cells fulfill scavenger endothelial cell function and cooperate with microglia in waste removal from the brain. Glia. 2022;70(1):35-49.
[11] Dantzer R. Neuroimmune interactions: from the brain to the immune system and vice versa. Physiol Rev. 2018;98(1):477-504.
[12] Laurenti E, Göttgens B. From haematopoietic stem cells to complex differentiation landscapes. Nature. 2018;553(7689):418-426.
[13] Bower NI, Koltowska K, Pichol-Thievend C, et al. Mural lymphatic endothelial cells regulate meningeal angiogenesis in the zebrafish. Nat Neurosci. 2017;20(6):774-783.
[14] Korin B, Ben-Shaanan TL, Schiller M, et al. High-dimensional, single-cell characterization of the brain's immune compartment. Nat Neurosci. 2017;20(9):1300-1309.
[15] Magliozzi R, Columba-Cabezas S, Serafini B, et al. Intracerebral expression of CXCL13 and BAFF is accompanied by formation of lymphoid follicle-like structures in the meninges of mice with relapsing experimental autoimmune encephalomyelitis. J Neuroimmunol. 2004;148(1-2):11-23.
[16] Serafini B, Rosicarelli B, Magliozzi R, et al. Detection of ectopic B-cell follicles with germinal centers in the meninges of patients with secondary progressive multiple sclerosis. Brain Pathol. 2004;14(2):164-174.
[17] Keren-Shaul H, Spinrad A, Weiner A, et al. A unique microglia type associated with restricting development of Alzheimer's disease. Cell. 2017;169:1276-1290.e17(7).
[18] Wang Y, Chen D, Xu D, et al. Early developing B cells undergo negative selection by central nervous system-specific antigens in the meninges. Immunity. 2021;54:2784-2794.e6(12).
[19] Schafflick D, Wolbert J, Heming M, et al. Single-cell profiling of CNS border compartment leukocytes reveals that B cells and their progenitors reside in non-diseased meninges. Nat Neurosci. 2021;24(9):1225-1234.
[20] Engelhardt B, Ransohoff RM. The ins and outs of T-lymphocyte trafficking to the CNS: anatomical sites and molecular mechanisms. Trends Immunol. 2005;26(9):485-495.
[21] Guldner IH, Wyss-Coray T. Activated immune cells drive neurodegeneration in an Alzheimer's model. Nature. 2023;615(7953):588-589.
[22] Förster R, Davalos-Misslitz AC, Rot A. CCR7 and its ligands: balancing immunity and tolerance. Nat Rev Immunol. 2008;8(5):362-371.
[23] Schläger C, Körner H, Krueger M, et al. Effector T-cell trafficking between the leptomeninges and the cerebrospinal fluid. Nature. 2016;530(7590):349-353.
[24] Zhou Y, Cai J, Zhang W, et al. Impairment of the glymphatic pathway and putative meningeal lymphatic vessels in the aging human. Ann Neurol. 2020;87(3):357-369.
[25] Chen X, Holtzman DM. Emerging roles of innate and adaptive immunity in Alzheimer's disease. Immunity. 2022;55(12):2236-2254.
[26] Butterfield DA, Halliwell B. Oxidative stress, dysfunctional glucose metabolism and Alzheimer disease. Nat Rev Neurosci. 2019;20(3):148-160.
[27] Antila S, Karaman S, Nurmi H, et al. Development and plasticity of meningeal lymphatic vessels. J Exp Med. 2017;214(12):3645-3667.
[28] Taoka T, Masutani Y, Kawai H, et al. Evaluation of glymphatic system activity with the diffusion MR technique: diffusion tensor image analysis along the perivascular space (DTI-ALPS) in Alzheimer's disease cases. Jpn J Radiol. 2017;35(4):172-178.
[29] Wang L, Zhang Y, Zhao Y, et al. Deep cervical lymph node ligation aggravates AD-like pathology of APP/PS1 mice. Brain Pathol. 2019;29(2):176-192.
[30] Prinz M, Priller J, Sisodia SS, et al. Heterogeneity of CNS myeloid cells and their roles in neurodegeneration. Nat Neurosci. 2011;14(10):1227-1235.
[31] Fisher Y, Strominger I, Biton S, et al. Tp polarization of T cells injected into the cerebrospinal fluid induces brain immunosurveillance. J Immunol. 2014;192(1):92-102.
[32] Zhang J, Ke KF, Liu Z, et al. Tp7 cell-mediated neuroinflammation is involved in neurodegeneration of aβ1-42-induced Alzheimer's disease model rats. PLoS One. 2013;8(10):e75786.
[33] Dong Y, Yong VW. When encephalitogenic T cells collaborate with microglia in multiple sclerosis. Nat Rev Neurol. 2019;15(12):704-717.
[34] Sabatino JJ, Jr., Pröbstel AK, Zamvil SS. B cells in autoimmune and neurodegenerative central nervous system diseases. Nat Rev Neurosci. 2019;20(12):728-745.
[35] Ding XB, Wang XX, Xia DH, et al. Impaired meningeal lymphatic drainage in patients with idiopathic Parkinson's disease. Nat Med. 2021;27(3):411-418.
[36] Zou W, Pu T, Feng W, et al. Blocking meningeal lymphatic drainage aggravates Parkinson's disease-like pathology in mice overexpressing mutated α-synuclein. Transl Neurodegener. 2019;8:7.
[37] Schröder JB, Pawlowski M, Meyer Zu Hörste G, et al. Immune cell activation in the cerebrospinal fluid of patients with Parkinson's disease. Front Neurol. 2018;9:1081.
[38] Sulzer D, Alcalay RN, Garretti F, et al. T cells from patients with Parkinson's disease recognize α-synuclein peptides. Nature. 2017;546(7660):656-661.
[39] Orr CF, Rowe DB, Mizuno Y, et al. A possible role for humoral immunity in the pathogenesis of Parkinson's disease. Brain. 2005;128(Pt 11):2665-2674.
[40] Sweeney MD, Zlokovic BV. A lymphatic waste-disposal system implicated in Alzheimer's disease. Nature. 2018;560(7717):172-174.
[41] Sweeney MD, Sagare AP, Zlokovic BV. Blood-brain barrier breakdown in Alzheimer disease and other neurodegenerative disorders. Nat Rev Neurol. 2018;14(3):133-150.
文章摘要: 在生理和病理條件下,腦膜淋巴管均能連線中樞神經系統與外周淋巴管。腦膜淋巴管不僅在腦代謝產物清除中發揮重要的作用,而且有助於抗原的遞送和免疫細胞的啟用。新型基因組技術的出現使得對骨髓和淋巴細胞的特征及其與中樞神經系統中腦膜淋巴管的相互作用的了解更為深入。此次綜述概述了腦膜淋巴管在中樞神經系統免疫網絡中的多方面作用,關註了腦膜淋巴管免疫生態席位的最新發現,探索了中樞神經系統穩態和神經退行性疾病病理中腦膜淋巴管與免疫細胞之間的串擾作用,並討論了這些相互作用如何影響病理結果。文章提出在衰老和神經退行性疾病中,腦膜淋巴管結構和功能的調控可能會影響淋巴引流、腦脊液中的免疫神經調節因子和免疫細胞群,從而在塑造腦膜和腦實質免疫中發揮關鍵作用的觀點。
文章關鍵詞: 中樞神經系統;腦膜淋巴管;免疫;髓細胞;淋巴細胞;神經退行性疾病
文章來源: Gao M, Wang X, Su S, Feng W, Lai Y, Huang K, Cao D, Wang Q (2025) Meningeal lymphatic vessel crosstalk with central nervous system immune cells in aging and neurodegenerative diseases. Neural Regen Res 20(3):763-778.











