炔烴是有機化學中的基本官能團,其獨特之處在於它兼具高勢能(熱力學不穩定性)和參與化學轉化相對較慢(動力學穩定性)的基本性質,因此它位於勢能面上能量高但很深的阱底(圖1a)。相比之下,盡管有機化學中的活性中間體(例如:大多數碳烯、自由基、氮賓和芳炔)也具有高勢能,但與炔烴相比,活性中間體固有的低活化能使其能快速發生化學轉化。事實上,炔烴的勢能一旦從其動力學「牢籠」中被釋放出來,便可在熱力學上驅動多種反應,包括:多種過渡金屬催化的環化反應以及熱環異構化反應以生成應變活性中間體(如:芳炔、環狀聯烯和α,3-去氫甲苯)。另一方面,碳烯是一類中性的二價缺電子物種,其碳原子含有兩個未成鍵電子且只有六個價電子,因此它們通常是反應性很強的中間體,其易與π鍵加成並形成張力環丙烷或環丙烯( 10 → 11 );也可以插入(強)σ鍵( 19 → 17 )。通常情況下,遊離碳烯( 3 )由重氮化物( 1 )或二嗪類( 2 )的熱活化或光活化產生(圖1b),其中伴隨釋放的高度穩定N2充當熱力學驅動力;而在過渡金屬配合物的存在下可從相同的前體生成金屬碳烯(即carbenoids, 4 )。或者,透過堿促進鹵代物( 5 )的α-消除以及脒鎓離子 7 的去質子化也可以生成遊離碳烯,即二鹵碳烯( 6 )和N-雜環碳烯(NHC, 8 )。原則上,具有高勢能的炔烴可用於生成高能、反應性碳烯中間體,例如:在乙炔二羧酸二甲酯(DMAD, 9 )的四聚化反應生成含環丙烯加合物 11 的過程中涉及碳烯 10 中間體(圖1c)。
近日,美國 明尼蘇達大學 化學系的 Thomas R. Hoye 教授(點選檢視介紹)課題組在 Nature Chemistry 上發表文章, 只需加熱2-炔基亞胺基雜環和親電炔烴的混合物即可直接從炔烴輕松生成不含金屬的碳烯。 許多室溫穩定的炔烴親電試劑與多種(2-炔基)雜環親核試劑相互作用都可生成碳烯中間體,它們會立即經歷多種類別的轉化,從而簡單、高效地獲得各種雜環產物。
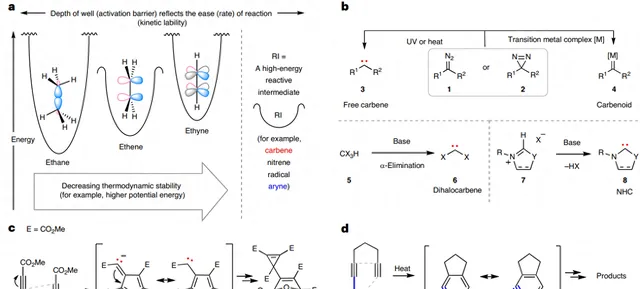
圖1. 炔烴的高勢能可以驅動活性中間體的形成。圖片來源: Nat. Chem.
如圖2a所示,當六去氫Diels-Alder(HDDA)反應衍生的苯炔( 16 )與共軛烯炔(即2-(1-炔基)吡啶 15 )進行反應時,能以82%的分離產率獲得氧雜矽環 17 ,這可能是由於吡啶 15 的氮原子親核進攻親電苯炔 16 並得到兩性離子中間體 18 ,經5-exo-dig環化轉化為碳烯物種 19 ,其透過分子內1,5-C-H鍵插入得到產物 17 。若其它室溫穩定的親電炔烴也能參與類似的過程,那麽將大大擴充套件從炔烴獲取遊離碳烯中間體的途徑並可能獲得結構多樣化的含氮雜環。事實上,當在110℃的1,2-二氯乙烷中加熱DMAD( 9 )和2-(2-異丙基乙炔基)吡啶( 20 )時很快就產生了吲嗪 22 (產率:61%,圖2b);若在室溫下進行也可以觀察到這一轉化,盡管速率較慢。為了更深入了解反應途徑,作者透過密度泛函理論(DFT)計算來構建勢能面(圖2c)。首先,吡啶 23 和炔二酮衍生物 24 經過渡態 TS-1 形成兩性離子加合物 25 ,經過渡態 TS-2 進行5-exo-dig環化反應並產生共振結構 26 ±和 26 :的混合物,接著 26 透過1,2-C-H鍵插入過程便可得到吲嗪產物 27 。此外,自然鍵軌域分析顯示 26 中紅色和綠色碳原子之間的Wiberg鍵級為1.43,這與極端情況下的嚴格兩性離子特征(鍵級基本上為2)和局部碳烯特征(鍵級基本上為1)的混合相一致。
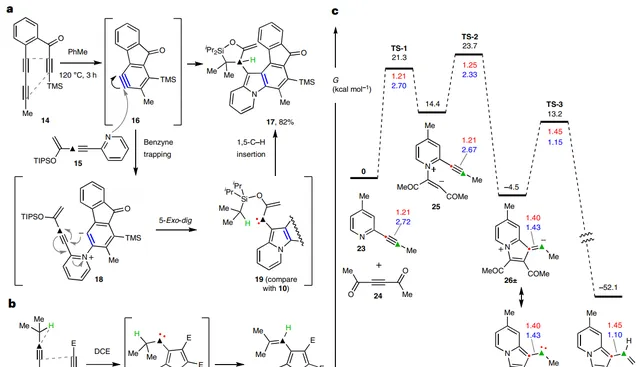
圖2. 在生成含吲嗪的過程中會形成碳烯中間體。圖片來源: Nat. Chem.
隨後,作者發展了五種插入反應(圖3a-d)和四種透過碳烯衍生的1,3-偶極環加成反應(圖3e-g),具體而言:1)帶有TIPS醚的叔醇受質 28 能夠有效地插入異丙基次甲基C-H鍵並獲得產物 29 (圖3a);2)2-乙炔基吡啶衍生物 30-O 或 30-S 與DMAD反應時,透過將碳烯1,5-插入甲基C-H鍵並生成二氫苯並呋喃 31-O 或二氫苯並噻吩 31-S (圖3b);3)沒有遠端取代基的2-乙炔基吡啶衍生物 32 也可以生成碳烯中間體(圖3c),插入到甲醇的O-H鍵並生成產物 33 ;4)受質 34 中的三甲基矽基不會妨礙碳烯的生成(圖3d),當DMAD過量(8 equiv)時獲得了應變5,5,6-三環雜環 35 (經1,5-C-H鍵插入)及其MeOH消除產物 36 的混合物(兩者比為3:1),而吡啶受質 34 過量(2.5 equiv)時則形成唯一的烯醇醚產物 36 ,這表明 36 是由 35 經堿促進MeOH消除而成;5)DMAD與吡啶衍生物 37 或 38 進行反應時僅形成了三環酮 39 (產率:74%)或 40 (產率:73%,圖3e),在此過程中DMAD加成了兩次;6)DMAD與炔烴末端含有TMS的吡啶衍生物 45 進行反應時獲得了可分離的多環橋連醚 46 (圖3f), 46 在較高溫度下會重排為酮 47 ( 39 的直接類似物),這些結果強有力地支持了涉及1,3-偶極環加成的機理;7)二炔 48 與DMAD發生反應時獲得了四環酮 50 (圖3g),其透過中間體 49 的分子內環加成產生。
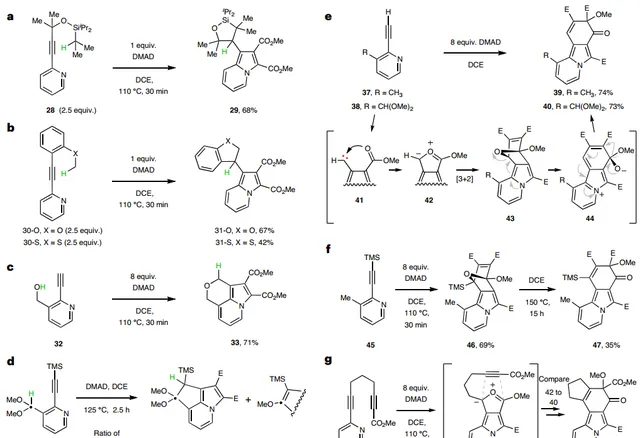
圖3. 碳烯中間體的插入反應和1,3-偶極環加成反應。圖片來源: Nat. Chem.
如圖4a所示,作者發現含有乙酸叔酯的吡啶 51a 和DMAD進行反應時有效地生成了烯醇乙酸酯 54a (圖4a),很顯然OAc基團發生了1,2-遷移。值得一提的是,單取代吡啶 51b 與稍過量DMAD(1.5 equiv)還能進行1 g級規模反應,並以82%的分離產率獲得吲嗪產物 54b 。在此基礎上,作者考察了缺電子炔烴的受質範圍(圖4b),結果顯示酯基( 56a- 56d、56i、56k )、酮羰基( 56e、56f、56j )和醛基( 56g )取代的炔烴均能相容該反應,以中等至較好的產率獲得相應產物,並且親電炔烴的β-碳可以耐受氫原子、溴原子、磺醯胺、炔基、三氟甲基、芳基或雜芳基。然而,還有幾種缺電子炔烴( 57a-57f )即使加熱至相當高的溫度也無法進行反應(圖4c),NMR和薄層色譜(TLC)分析表明發生了多次分解。其次,作者探索了多種含有亞胺基雜環類似物的受質適用性(圖5),結果顯示喹啉( 59a )、異喹啉( 59b )、噠嗪( 59c 和 59c′ )、嘧啶( 59d )、吡嗪( 59e )、苯並咪唑( 59f )、苯並惡唑( 59g )、苯並噻唑( 59h )、1-吡咯啉( 59i )、2-惡唑啉( 59j )、噻二唑( 59k )和嘌呤核苷( 59l )均能有效地與DMAD進行[3+2]環加成反應,並以良好至優異的產率形成結構多樣化的雜環骨架。
圖4. 親電炔烴的受質範圍。圖片來源: Nat. Chem.
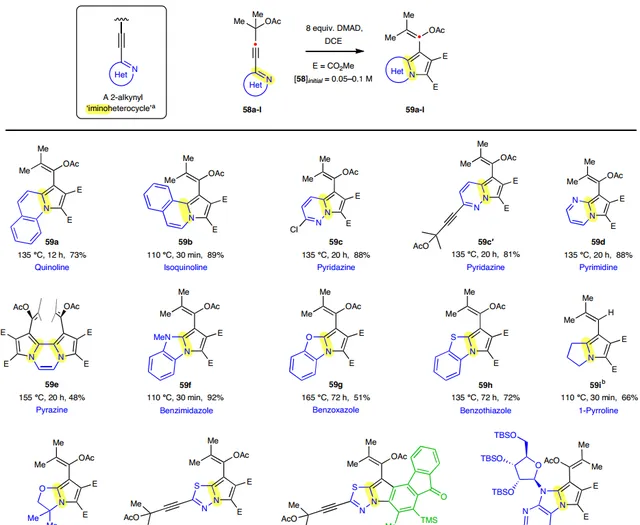
圖5. 12 種不同類別的2-炔基亞胺基雜環化合物與DMAD反應。圖片來源: Nat. Chem.
為了展示該過程的實用性,作者進行了一系列合成套用,具體而言:1)多種伯醇( 60a-60d )與炔酮 61 進行反應時(圖6a),以中等至良好的產率和完全的區域選擇性獲得一系列吲嗪產物 62a-62d ;2)當異喹啉 63 和噻唑 65 分別與DMAD進行反應時獲得物種 64 和 66 ,這進一步說明第二分子DMAD捕獲中間體羰基葉立德並形成2:1加合物,因此除吡啶之外的亞胺基雜環參與了1,3-偶極形成和環加成;3)不同亞胺基雜環(吡啶除外)和不同缺電子炔烴(DMAD除外)進行反應時則是發生了兩種不同類別的C-H鍵插入過程(圖6c),其中非芳香族五元1-吡咯啉衍生物 58i 與己二炔酸酯 56d 進行1,2-C-H鍵插入後生成雙環吡咯衍生物 67 ,而芳香族六元嘧啶 68 與不對稱炔酸酯 69 則是透過1,5-C-H鍵插入OMe基團後生成多環產物 70 。
圖6. 缺電子炔烴和炔基亞胺基雜環的各種碳烯捕獲過程。圖片來源: Nat. Chem.
最後,作者還進行了一系列實驗,結果表明這些N-雜環衍生的遊離碳烯具有不尋常的反應性。具體來說:1)當使用對稱二炔 71 與DMAD進行反應時形成了1:3加合物,從而僅產生呋喃衍生物 74 (圖7a),該反應可能始於透過第一個碳烯形成酮中間體 72 。隨後, 73 中的烯丙基碳烯被近端的酯羰基捕獲並得到呋喃產物 74 ;2)當設計的乙炔基礎類別似物 75 與DMAD反應時(圖7b),中間體 76a 的碳烯被近端的酯羰基捕獲並轉化為酮 77 (主要產物),而另一種碳烯共振中間體 76b 的碳烯則被插入到遠端TIPS醚的異丙基C-H鍵中,從而得到氧雜矽氧烷 78 (次要產物);3)當二炔 75 與三炔衍生的苯炔 14 進行反應時得到了唯一產物——氧雜矽氧烷 80 (圖7c),這些結果證實了propynylidene衍生物 79 中碳烯的離域性質,同時模型DFT計算進一步支持了這一結果;4)2-乙炔基吡啶衍生物 81 、DMAD和原甲酸三甲酯(溶劑)之間發生了非常有效的三組分反應並生成凈MeO-H鍵插入產物 84 (圖7d),該反應可能透過碳烯復分解途徑進行的;5) 85 、DMAD和偏二氯乙烯( 86 )之間的三組分反應形成了環丙烷化產物 87 (圖7e)。
圖7. 一系列不同尋常的轉化。圖片來源: Nat. Chem.
總結
Thomas R. Hoye教授課題組偶然觀察到瞬態苯炔和2-乙炔基吡啶衍生物之間的凈[3+2]環加成反應,並推測關鍵中間體是兩性離子和遊離碳烯,同時DFT計算為這種機理解釋提供了支持。此外,關鍵中間體的碳烯特性透過各種插入、環加成和重排過程得到證實,並且研究表明大量2-炔基亞胺基雜環都能有效參與反應。值得註意的是,作者不僅證明了無金屬propynylidene中間體的「碳烯接力」反應性,還發現了無金屬碳烯復分解反應,雙分子環丙烷化反應也值得進一步研究。這種在熱、無添加劑條件下輕松獲得碳烯的方法為進一步探索無金屬碳烯的新反應性提供了平台。
Free carbenes from complementarily paired alkynes
Qian Xu, Thomas R. Hoye
Nat. Chem ., 2024 , 16 , 1083-1092, DOI: 10.1038/s41557-024-01550-9
導師介紹
Thomas R. Hoye
https://www.x-mol.com/university/faculty/279











