分析高考把握方向:
1.(2022·河北,5)用中子轟擊 原子產生α粒子(即氦核 )的核反應為 。已知元素Y在化合物中呈+1價。下列說法正確的 是( )
A.p XO3 可用於中和濺在皮膚上的NaOH溶液
B.Y單質在空氣中燃燒的產物是Y2 O2
C.X和氫元素形成離子化合物
D. 互為同素異形體
答案:A。
分析:
結合資訊可推出,X是B元素,Y是Li元素。
p BO3 為硼酸,是很弱的酸,NaOH溶液具有腐蝕性,濺到皮膚上,則需用大量水沖洗,同時塗抹H 3 BO 3 以中和殘留的NaOH ,A正確。
Li在空氣中燃燒的產物只有Li2 O,B錯誤。
X為B,與H元素會形成化合物時,以共價鍵結合,屬於共價化合物 ,C錯誤。
兩者的質子數均為3,中子數不同,所以互為同位素 ,D錯誤。
2.(2022·廣東,7)甲~戊均為短周期元素,在元素周期表中的相對位置如圖所示。戊的最高價氧化物對應的水化物為強酸。下列說法不正確 的是( )

A.原子半徑:丁>戊>乙
B.非金內容:戊>丁>丙
C.甲的氫化物遇氯化氫一定有白煙產生
D.丙的最高價氧化物對應的水化物一定能與強堿反應
答案:C。
分析:
這些元素都是短周期元素,結合其位置可知,甲、乙屬於第二周期,丙、丁、戊屬於第三周期。第三周期中,最高價氧化物對應的水化物為強酸,只有硫酸或和高氯酸,所以戊是Cl或S元素。若戊為Cl,則甲為N、乙為F、丙為P、丁為S;若是S,則甲為C、乙為O、丙為Si、丁為P。
同周期從左往右,原子半徑逐漸變小;同主族從上往下,原子半徑逐漸變大 。所以原子半徑:丁>戊>乙,A正確。
同周期主族元素從左到右非金內容逐漸增強 ,B正確。
甲的氫化物可能為氨氣,也可能為甲烷、乙烷等烴,若是氨氣,則遇氯化氫有白煙產生,若是甲烷、乙烷等,則遇氯化氫沒有白煙生成,C錯誤。
丙的最高價氧化物對應的水化物可能是矽酸,也可能是磷酸,都能與強堿反應,D正確。
3.(2021·北京,4)下列性質的比較,不能用元素周期律解釋 的是( )
A.酸性:HClO4 >p SO3 >p SiO3
B.堿性:KOH>NaOH>LiOH
C.熱穩定性:p O>p S>Pp
D.非金內容:F>O>N
答案:A。
分析:
非金屬元素的非金內容越強,則其最高價氧化物 的水化物酸性越強,但p SO3 不是S元素的最高價氧化物的水化物,所以A不能用元素周期律解釋。
同主族金屬元素從上往下,金內容逐漸增強,其最高價氧化物的水化物的堿性逐漸增強 ,B可以解釋。
非金內容越強,氣態氫化物越穩定 ,C可以解釋。
同周期元素從左往右,非金內容逐漸增強 ,D可以解釋。
4.(2021·福建,8)某種食品膨松劑由原子序數依次增大的R、W、X、Y、Z五種主族元素組成。五種元素分別處於三個短周期,X、Z同主族,R、W、X的原子序數之和與Z的原子序數相等,Y原子的最外層電子數是Z原子的一半。下列說法正確 的是( )
A.簡單氫化物的穩定性:W>X>Z
B.Y的氧化物是兩性氧化物
C.R、W、X只能組成共價化合物
D.最高正價:Y<W<X
答案:B。
分析:
元素涉及三個周期,R的原子序數最小,則R為H元素。Y原子的最外層電子數是Z原子的一半,則Y和Z的最外層電子有1與2、2與4、3與6三種組合,結合另外兩條資訊,可推出W為N元素,X為O元素,Z為S元素,Y為Al元素。
元素非金內容強弱O>N>S,氫化物的穩定性p O>Np >p S,A錯誤。
Y的氧化物Al 2 O 3 是兩性氧化物 ,B正確。
H、N、O能組成離子化合物NH 4 NO 3 ,C錯誤。
Al的最高價為+3價,N的最高價為+5價,O的非金內容很強,一般沒有正價 ,D錯誤。
5.(1)[2022·浙江6月選考,26(2)]金屬氫化物是套用廣泛的還原劑。KH的還原性比NaH的強,原因是_______。
(2)[2020·浙江7月選考,26(2)]CaCN2 是離子化合物,各原子均滿足8電子穩定結構 ,CaCN2 的電子式是________________。
答案:
(1)半徑小於,與的離子鍵作用強,更難失電子,還原性更弱
(2)
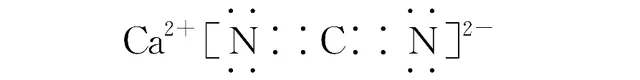
分析:
K的金內容更強,更容易失電子 ,Na的金內容相對較弱,失電子要難一些。
Ca的最外層是2個電子,可以失去兩個電子,成為8電子的穩定結構。C的最外層是4個電子,必須形成4個共用電子對,N的最外層5個電子,必須形成2個共用電子對,還得1個電子成為8電子穩定結構。
需要重點掌握的知識點:
1、元素周期表的結構要清楚
熟悉元素周期表的結構 ,掌握前20號元素的名稱、符號,在周期表中位置、原子結構及性質之間的關系 。
2、掌握元素周期律,並理解其豐富的內涵
同周期、同主族的原子結構、性質的遞變性 規律;
同周期、同主族的原子結構、性質的相似性 規律。
練習1、(2022·重慶)已知硒(34 Se)的最外層有6個電子,砷(33 As)最外層有5個電子,依據元素周期表和周期律的知識判斷,下列錯誤的是( )
A.非金內容:S>Se>As
B.酸性:p SO4 >p SeO4 >p AsO4
C.熱穩定性:HCl>p Se>HBr
D.還原性:p Se>HBr>HCl
答案:C。
練習2、(2023·山西運城高一)如圖為元素周期表的一部份,其中X、Y、Z、W為短周期元素,W元素原子的核電荷數為X元素的2倍。下列說法正確的是( )
|
X |
||
|
Y |
Z |
W |
|
T |
A.簡單氫化物的沸點:X<W
B.Y、Z、W元素的氧化物對應的水化物的酸性依次增強
C.簡單離子半徑:Z<W
D.根據元素周期律,推測T元素的單質具有半導體特性,T2 X3 具有氧化性和還原性
答案:D。
3、元素金內容、非金內容強弱的比較方法
金內容強弱的比較:
同主族元素,從上往下,電子層數越多,原子半徑越大,越易失電子,金內容越強。
同周期元素,從左往右,核電荷數越多,原子半徑越小,越難失電子,金內容越弱 。
在金屬活動性順序表中,一般,前面的金內容比後面的強。
金屬單質與水或酸反應越容易置換出氫氣,元素金內容越強 。
最高價氧化物對應水化物的堿性越強 ,元素金內容越強。
金內容強的可以置換出金內容弱的 (或離子的氧化性越強,則對應元素的金內容越弱)。
非金內容強弱的比較:
同主族元素,從上往下,電子層數越多,原子半徑越大,得電子能力減弱,非金內容減弱 。
同周期元素,從左往右,核電荷數越多,原子半徑越小,得電子能力增強,非金內容增強 。
單質越易跟H 2 化合,生成的氫化物越穩定 ,氫化物的還原性越弱,其非金內容越強。
最高價氧化物對應水化物的酸性越強 ,其非金內容越強。如p SO4 的酸性強於p PO4 ,說明S的非金內容比P強。
非金內容強的可以置換出非金內容弱的 ,例如:
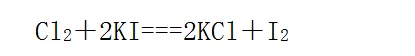
說明氯的非金內容比碘強。
元素的原子對應陰離子的還原性越強,元素的非金內容越弱,如的還原性比強,說明Cl的非金內容比S強。
練習3、下列關於銫及其化合物的說法不正確的是( )
A.氫氧化銫是一種強堿,比KOH的堿性強
B.銫與水或酸溶液反應劇烈,都生成氫氣
C.Cs的還原性比Na強,故的氧化性強於
D.Cs2 CO3 不易溶於水
答案:D。
4、元素「位—構—性」關系與元素推斷
元素的位、構、性三者之間的關系:
熟悉1~20號元素原子結構特點及其規律
①原子核中無中子的原子:氕。
②最外層有1個電子的元素:H、Li、Na、K。
③最外層有2個電子的元素:He、Be、Mg、Ca。
④最外層電子數等於次外層電子數的元素:Be、Ar。
⑤最外層電子數是次外層電子數2倍的元素:C;是次外層電子數3倍的元素:O;是次外層電子數4倍的元素:Ne。
⑥電子層數與最外層電子數相等的元素:H、Be、Al。
⑦電子總數為最外層電子數2倍的元素:Be。
⑧次外層電子數是最外層電子數2倍的元素:Li、Si。
⑨內層電子總數是最外層電子數2倍的元素:Li、P。
⑩電子層數是最外層電子數2倍的元素:Li、Ca。
⑪最外層電子數是電子層數2倍的元素:He、C、S。
⑫最外層電子數是電子層數3倍的元素:O。
元素推斷題的常見突破口:
最高正價與最低負價絕對值之差為2、4、6的短周期元素分別為N、P、S、Cl元素。
形成化合物種類最多的元素、單質是自然界硬度最大的物質。
空氣中含量最多的元素、簡單氣態氫化物水溶液呈堿性的元素、元素的簡單氣態氫化物與它的最高價氧化物對應的水化物能發生化合反應生成鹽的元素是N。
地殼中含量最多的元素、簡單氫化物沸點最高的元素、簡單氫化物在通常情況下呈液態的元素是O。
原子核內無中子的元素、陽離子核外無電子的元素、原子半徑最小的元素、常溫下單質氣體密度最小的元素是H。
地殼中含量最多的金屬元素、短周期且同周期的三種元素最高價氧化物對應水化物兩兩皆反應,則必定含有Al。
最高價氧化物對應水化物的酸性最強的元素是Cl。
只有負價不存在正價的元素、不存在含氧酸的非金屬元素、單質的氧化性最強的元素、非金內容最強的元素是F。
可以作半導體材料的短周期元素、其單質能與強堿溶液反應置換出氫氣的元素是Si。
其最高價氧化物或其最高價氧化物對應的水化物既能與強酸反應,又能與強堿反應的短周期元素是Be、Al。
兩種元素以原子個數比為2∶1和1∶1組成的化合物常溫下為液態的元素為H和O。
其單質常溫下為液態的非金屬元素為Br。
練習4、(2022·武漢高一期末)2022年5月,人類首次利用月球土壤成功種活了植物,未來的太空人們有可能在月球上種植食物,月壤中所含短周期主族元素X、Y、Z、W的原子序數依次增大,X、Y、W的原子核外最外層電子數為互不相等的偶數,X原子的最外層電子數是其內層電子總數的3倍,W元素在地殼中的含量位居第二,常見元素Z的單質是目前使用量最大的主族金屬元素,下列敘述正確的是( )
A.原子半徑大小順序:W>X>Y>Z
B.Y、Z、W的最高價氧化物的水化物均顯堿性,且堿性逐漸減弱
C.元素W和X的簡單氫化物的沸點:X<W
D.元素X與Y、Z、W形成的二元化合物的化學鍵依次為離子鍵、離子鍵、共價鍵
答案:D。











