2月1日,清华大学生命学院刘俊杰课题组在【科学】 (Science) 杂志在线发表了题为【可编程的水解型核酸内切核酶用于DNA靶向切割】(Hydrolytic endonucleolytic ribozyme(HYER)is programmable for sequence-specific DNA cleavage)的研究论文,报道了一种催化性RNA(核酶)—HYER(水解型内切核酶)。HYER可序列特异地切割RNA和DNA底物,并对哺乳动物细胞基因组产生位点特异的编辑。无需蛋白核酸酶的参与,HYER的底物识别和切割均由RNA分子实现,有望成为继CRISPR之后新一代的基因编辑底盘工具。

图1.历代基因编辑工具
基因承载着遗传信息,定义了生命的多样性和复杂性。基因编辑是理解和改造生命的关键技术,在生物学研究和生物产业发展中发挥着重要作用。历代基因编辑工具如巨核酸酶、ZFNs、TALENs,均以蛋白质为基础识别和切割DNA,编辑位点的重编程较为困难。目前被广泛使用的CRISPR-Cas工具,是RNA引导的蛋白核酸酶,通过引导RNA的间隔序列来识别DNA,具有很好的编辑位点重编程能力,但依然存在着PAM序列限制、分子量大、蛋白免疫原性等多种问题。
HYER源自细菌逆转座子(第二类内含子,GIIintron),一种可在宿主基因组上「拷贝和粘贴」(逆转座)的可移动元件。该元件通常编码一个兼具核酸酶和逆转录酶活性的蛋白质以及一个RNA分子,通过形成蛋白核酸复合物(RNP)来执行在宿主基因组中的逆转座扩增。有趣的是,通过广泛的生物信息学筛选,刘俊杰课题组发现了许多不编码蛋白的、紧凑的二类C型内含子(ORF-lessGII-Cintron)在细菌基因组中存在多拷贝的现象。这一现象暗示,这些内含子编码的唯一组份RNA分子,可能具有不依赖蛋白的扩增位点识别和切割能力,来实现内含子在宿主基因组内的拷贝扩增。
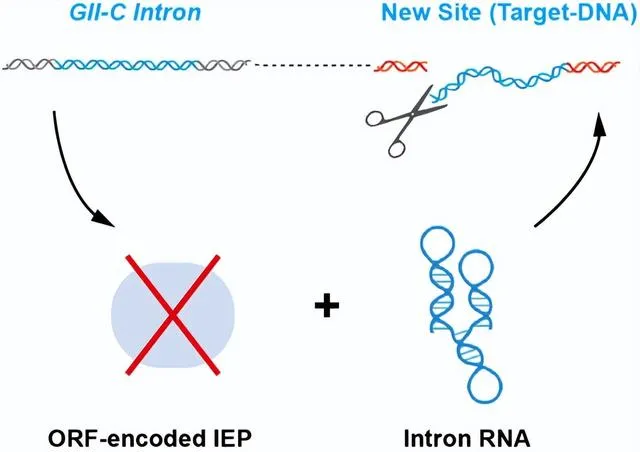
图2.不含蛋白组分的第二类内含子RNA在基因组中「拷贝和粘贴」的假设示意图
生化实验表明,这些长度约600nt的RNA分子在广谱的离子浓度和温度范围内,具有显著的RNA和DNA水解切割活性。因此,研究人员将这些RNA分子命名为水解型内切核酶(Hydrolytic Endonucleolytic Ribozymes, HYERs),这是科学界首次报道具有DNA水解切割能力的核酶(Ribozyme)。值得注意的是,HYER1和HYER2表现出了与紧凑型的CRISPR-Cas12e(CasX)和Cas12l(Casπ)相当的DNA体外切割效率。
为检验HYER在细胞内的DNA切割能力,研究人员在大肠杆菌中构建了ccdB毒蛋白报告系统,证明HYER1和HYER2可以对带有ccdB毒基因的质粒进行靶向切割。在HEK293T细胞内,研究人员构建了移码Puromycin抗性基因(puro*)报告系统。结果表明,HYER1可对puro*产生移码编辑,赋予细胞Puromycin抗性。在抗性筛选富集后的细胞里,三个靶位点中最高的编辑效率为9.18%。这表明,HYER可以在真核细胞基因组中引入双链断裂并产生编辑。然而,在未经Puromycin筛选富集的细胞中,编辑效率仅为0.09%到0.2%,表明HYER的真核基因编辑能力还有很大的进步和优化空间。
研究人员利用冷冻电镜获得了HYER1的高分辨三维结构(3.0Å),发现HYER1以同源二聚体的形式存在,并揭示HYER1水解切割DNA的机理。HYER1通过一段暴露的单链RNA(6nt)区域,TRS(Target Recognition Site),识别并招募DNA底物,将DNA捕获在结构域V所形成的催化核心中,通过经典的双镁离子机制催化DNA水解。
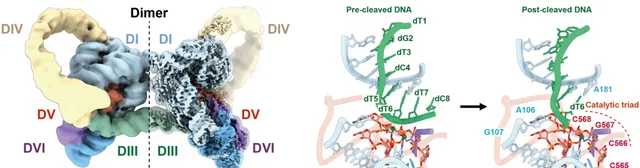
图3.HYER1的电子密度图和DNA水解切割机制
基于HYER的三维结构,研究人员进行了多种理性设计,证明HYER具有良好的可编程性,可根据底物序列灵活设计TRS的序列和长度;在TRS临近区域插入14nt的底物招募序列(Recruiting Sequence,RS),可明显提高HYER1的底物识别特异性和切割效率;对回文序列和TRS进行改造, HYER1则可形成带有两个不同TRS的异源二聚体,靶向双链DNA底物的不同区域,产生了具有5’突出、3’突出或平末端的定制化切割产物。
受「RNA世界」假说的启发,研究人员提出了第二类内含子中的「RNA的催化功能逐渐被蛋白质取代」的分子进化历程:在进化过程中,第二类内含子的结构域IV逐渐扩大,并产生了可编码短肽的开放阅读框(ORF),而这些短肽可作为顺式元件与内含子RNA相互作用,增强其结构稳定性和催化活性;随着ORF变得更长、更为成熟,其编码的蛋白质不仅起到稳定结构的作用,亦获得了DNA切割和逆转录活性,以替代RNA核酶行使催化功能。该成果不仅拓展了科学界对「RNA世界」假说和RNA催化功能的理解,也为创制具有我国完全自主知识产权的新型核酸操纵底盘工具,以及将其进一步用于基因编辑和RNA编辑等奠定了基础。
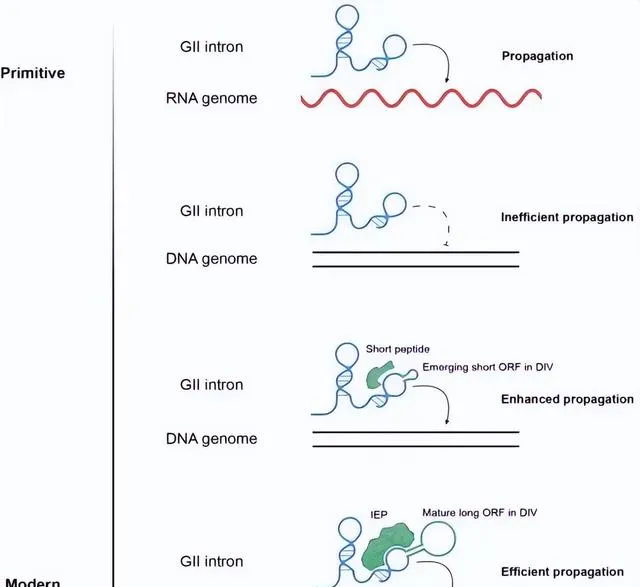
图4.第二类内含子的进化假想
清华大学生命学院刘俊杰副教授为本文通讯作者;清华大学生命学院2021级博士生刘子贤、高精尖结构中心卓越学者张寿悦博士、2020级博士生朱汉舟、博士后陈之航、2019级博士生杨韵和2022级博士生李隆骐为该文共同第一作者;清华大学生命学院2021级本科生刘云、2018级博士生李丹苑、2020级博士生孙奥、李承平、2021级博士生谭顺青、2023级博士生王高立、2023级博士生沈婕怡、水木学者靳帅博士,中国科学院遗传与发育生物学研究所高彩霞研究员和2020级博士生雷源为本研究作出了大力贡献。清华大学冷冻电镜平台为本研究提供了设备和技术支持。本研究得到了基金委原创项目(32150018)、农业部和清华大学的经费、资源支持。
论文链接:
Hydrolytic endonucleolytic ribozyme (HYER) is programmable for sequence-specific DNA cleavage | Science
供稿 | 生命学院
编辑 | 黄思南
审核 | 王晓霞











