

1997年,英国伦敦皇家自由医院医学院的Ling和 Harrison发表了一项题为「Production of hepatitis B virus covalently closed circular DNA in transfected cells is independent of surface antigen synthesis」的文章[1]。

在该研究中,他们首先构建了支持HBV DNA复制的construct质粒,随后又以此为基础构建了翻译起始密码子(ATG)突变(图中对应标记为ds1、ds2和ds)的分别缺失L-、M-和S-HBs蛋白的表达质粒,并转染HepG2细胞。采用类似hirt的技术流程选择性地提取制备细胞核DNA,然后用p32标记单链DNA探针做Southern Blot。结果见下图(有修改)。首先是这个结果再次支持了前期有关滞后合成的HBV rcDNA正链的不完整(信号弱);再就是间接地提示了核衣壳能够将rcDNA和dslDNA带入细胞核。此外,我们还可以额外地注意到:缺了L-、M-HBs蛋白表达的constructs相较于野生型及S-HBs蛋白表达缺失有更高的rcDNA、dslDNA和更多的以单链形式存在的(single strand,ss)复制中间体。考虑到该研究中作者的富集细胞核DNA步骤,这可能是最早提示rcDNA和dslDNA可以在感染细胞胞核富集的证据。
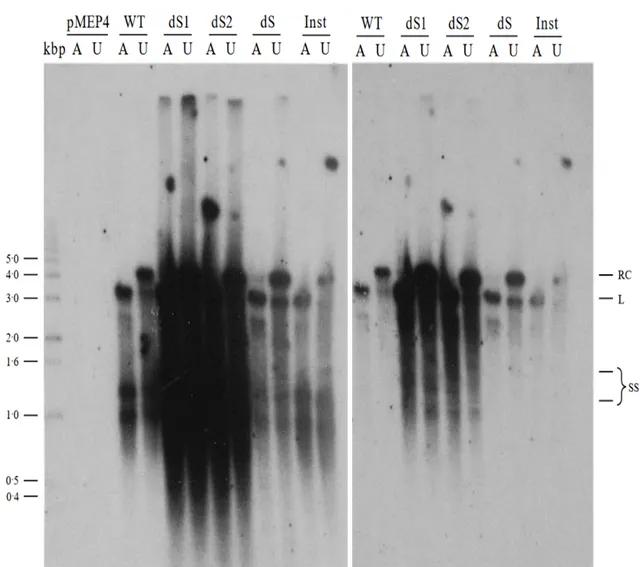
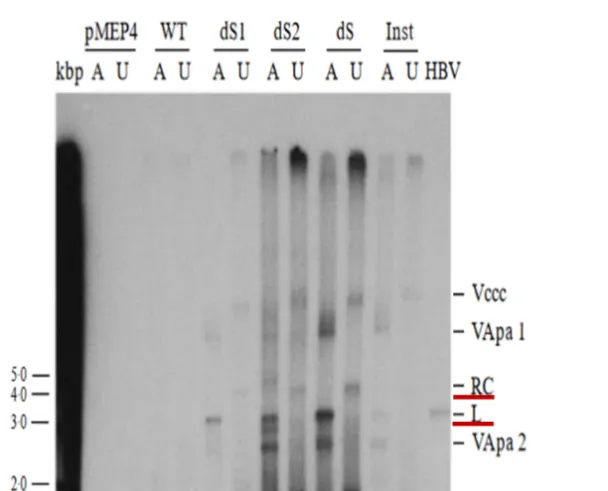
尽管作者仅是通过分别将L-、M-和S-HBs的翻译起始密码子(ATG)突变使之分别不表达,并利用Sourthern blot显示cccDNA量,然而作者在讨论中却声称「至少在我们的系统中,各种形式的HBV表面蛋白对细胞内来源的cccDNA积累的任何影响都可以忽略不计」似有不妥。因为我们在未经ApaI酶切的ds1、ds2和ds泳道看到了肉眼可见的cccDNA条带的增强、以及ApaI酶切后由环状cccDNA形成的线性的3.2kb DNA (L)同样增强。
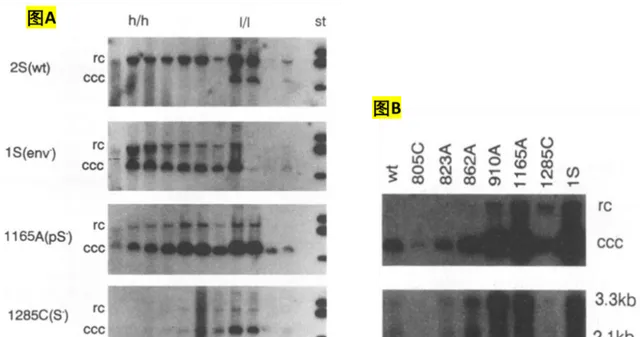
事后诸葛地以今天的知识再看这张图,这样的改变还是最好不要视而不见。实际上,就在该文发表前的1990年,新墨西哥州立大学MINSHU YU实验室的JESSE SUMMERS等利用DHBV感染模型发表的研究就显示:与野生型或仅S蛋白S/S蛋白缺失突变相比,前S缺失突变可使cccDNA显著积累,提示加速了rcDNA向cccDNA的转换(下图A)。并且,805C、862A、910A、1165A和1S等影响S/S蛋白功能的点突变也会导致有活性的cccDNA的积累(下图B,有修改)[2]。
实际上在此文发表前,人们已经确认了在core蛋白富含精氨酸的羧基端是带有核定位信号的[3] 。1994年,我国台湾地区廖运樊的实验室在BBRC发文,报导了在COS-7细胞中单独表达时主要为核定位的core蛋白在共表达病毒膜蛋白L-HBs,而非S-HBs时将与之共定位于细胞质中[4]。随后他们又进一步证实:HBV core蛋白羧基端第三个SPRRR基序上单个丝氨酸残基的取代都会显著增强该蛋白的核定位,并且这种突变使L-HBs对其核定位抑制作用的消失[5]。
写在最后
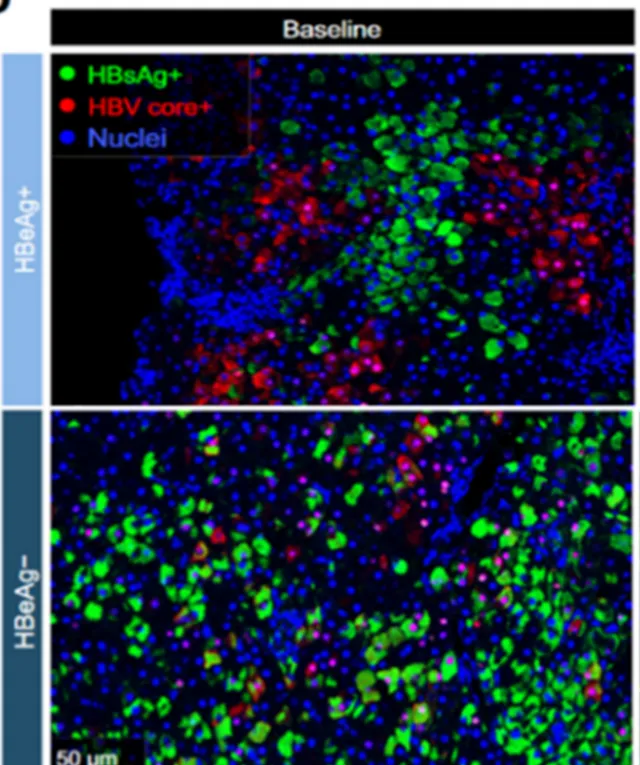
如此我们不禁要问,L-HBs如此强行把core蛋白拉入或滞留于细胞质中,由其构成的核衣壳如何入核释放rcDNA并随后转换为cccDNA呢? 如果我们回想一下前些日子西班牙吉利德Aggarwal等发在Hepatology Report上的多色组化结果(见下图,有修改)[6],特别是在HBeAg阴性患者肝组织中极少观察到HBsAg及core蛋白双染色阳性的感染肝细胞,或许我们真的可以认为:阻止了core蛋白入核的L-HBs的存在真的不利于rcDNA到cccDNA的内循环。但是,core蛋白染色阳性代表和反映了cccDNA的存在并具有转录活性。此情此景下,它是如何选择性地沉默HBsAg的表达?对此目前并无明晰的答案。由于这涉及到了慢性HBV感染的维持和隐匿性HBV感染(OBI)的发生机制,更与不同疾病阶段慢性乙肝的有效治疗靶点选择有关,这无疑将是一个值得探究的问题。
文献来源:
[1]Ling R, Harrison TJ. Production of hepatitis B virus covalently closed circular DNA in transfected cells is independent of surface antigen synthesis. J Gen Virol. 1997 Jun;78 ( Pt 6):1463-7. doi: 10.1099/0022-1317-78-6-1463. PMID: 9191944.
[2]Summers J, Smith PM, Huang MJ, Yu MS. Morphogenetic and regulatory effects of mutations in the envelope proteins of an avian hepadnavirus. J Virol. 1991 Mar;65(3):1310-7. doi: 10.1128/JVI.65.3.1310-1317.1991. PMID: 1995945; PMCID: PMC239906
[3]Eckhardt SG, Milich DR, McLachlan A. Hepatitis B virus core antigen has two nuclear localization sequences in the arginine-rich carboxyl terminus. J Virol. 1991 Feb;65(2):575-82. doi: 10.1128/JVI.65.2.575-582.1991. PMID: 1987370; PMCID: PMC239794
[4]Yeh CT, Ou JH, Chu CM, Liaw YF. Alteration of the subcellular localization of hepatitis B virus core protein by large but not small surface proteins. Biochem Biophys Res Commun. 1994 Sep 15;203(2):1348-54. doi: 10.1006/bbrc.1994.2330. PMID: 8093050.
[5]Yeh CT, Chu CM, Liaw YF. A single serine mutation on the nuclear localization signal of hepatitis B virus core protein abolishes the inhibition of nuclear transport by surface proteins. Biochem Biophys Res Commun. 1995 Aug 24;213(3):1068-74. doi: 10.1006/bbrc.1995.2236. PMID: 7654223
[6]Aggarwal A, Odorizzi PM, Brodbeck J, van Buuren N, Moon C, Chang S, Adona M, Suthram S, Suri V, Trowe T, Turner S, Marcellin P, Buti M, Gaggar A, Fletcher SP, Diehl L, Feierbach B, Balsitis S. Intrahepatic quantification of HBV antigens in chronic hepatitis B reveals heterogeneity and treatment-mediated reductions in HBV core-positive cells. JHEP Rep. 2022 Dec 26;5(4):100664. doi: 10.1016/j.jhepr.2022.100664. PMID: 36908748; PMCID: PMC9996321
来源:片警实验室











