点击上方蓝字·关注我们
文章标题:A specific phosphorylation- dependent conformational switch in SARS- CoV-2 nucleocapsid protein inhibits RNA binding
文章标题:SARS- CoV- 2核衣壳蛋白中特异性磷酸化依赖的构象开关抑制RNA结合
文章作者:Maiia Botova, Aldo R. Camacho- Zarco, Jacqueline Tognetti, Luiza Mamigonian Bessa, Serafima Guseva§, Emmi Mikkola, Nicola Salvi, Damien Maurin, Torsten Herrmann, Martin Blackledge
文章链接:Botova et al., Sci. Adv. 10, eaax2323 (2024) 2 August 2024
杂志期刊:Science AdvAnceS
实验背景
本文研究背景:研究了新冠病毒核衣壳蛋白的磷酸化对RNA结合的影响。
对相关研究工作的简述及评价(分点列出):使用核磁共振技术研究了磷酸化对蛋白结构的影响;发现磷酸化后蛋白与RNA结合被完全抑制;特定激酶的磷酸化模式具有特异性。
本文创新动机:探究特定宿主激酶的招募对调控病毒功能的机制。
实验方法
本文研究了SARS-CoV-2核衣壳蛋白的磷酸化对RNA结合的影响。通过核磁共振技术,研究了由丝氨酸精氨酸蛋白激酶1、糖原合成酶激酶3和酪蛋白激酶1引起的超磷酸化过程中发生的结构变化,导致与RNA的相互作用被抑制。当八个磷酸化位点均匀分布时,SR区域与单链RNA结合相同的界面,完全抑制了RNA结合。这些结果揭示了特定宿主激酶的招募对调控病毒功能的重要性。
实验结果
本文实验结果概括:
相关数据集、指标定义、实验结果:
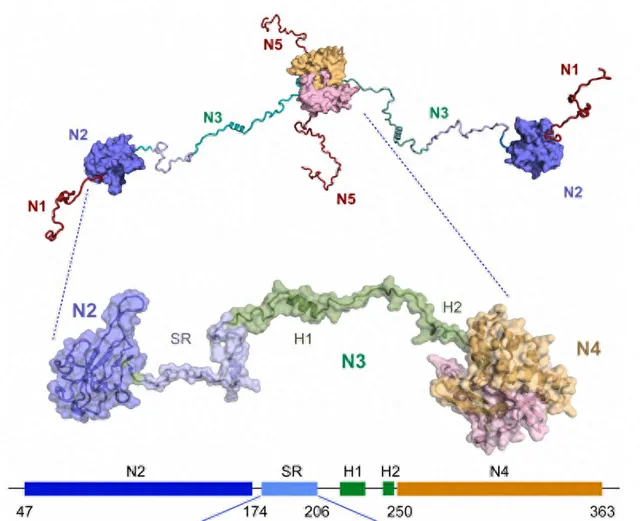
图示SARS- CoV- 2核衣壳蛋白(N)。SARS- CoV- 2核衣壳蛋白包括5个结构域(n1至n5,顶部)。放大图中显示的结构包括三个结构域,n2是RnA结合结构域;n3,包含两个螺旋p(219 - 231)和p(248 - 255)的无序中心结构域,以及在感染细胞中过度磷酸化的富含丝氨酸-精氨酸(SR)的区域;二聚化区域n4。这个构造称为n234。SR区序列用蓝色表示。

SRPK1、GSK- 3和CK1对N的磷酸化作用。
(A) SRPK1和磷酸化缓冲液[简称pn234(i)]孵育后15n- 1h未磷酸化(蓝色)和磷酸化(红色)n234的hSQc比较。两个共振似乎被分配给pS188和pS206。
(B) pn234(i)与GSK- 3和磷酸化缓冲液[简称pn234(ii)]孵育后15n- 1h未磷酸化(蓝色)和磷酸化(红色)n234的hSQc比较。另外出现了8个共振(此处显示了7个),它们被分配给pS176、pS180、pS184、pS186、pS190、pS194、pt198和pS202。
(C)将未磷酸化(蓝色)和磷酸化(红色)的n234(ii)与cK1和磷酸化缓冲液(简称pn234(iii))孵育15n- 1h后hSQc的比较。另外出现了四个共振(图中显示了三个),它们被分配给pS193、pS197和pS201。在记录这些光谱之前,将所有光谱缓冲交换到标准的核磁共振缓冲液中。
(D至F)在所选的共振中,峰强度随时间的变化,这些共振在整个动力学序列中保持足够的分辨,以准确测量每一步的峰强度(在磷酸化缓冲液中)。
(D) pn234(i), (E) pn234(ii), (F) pn234(iii)。(G)磷酸化改变了n的动力学行为。主图:n234在850 Mhz时的旋转框架弛豫(R1ρ)是磷酸化状态的函数[蓝色,未磷酸化;橙色,pn234 (ii);红色,pn234 (iii)]。由于低信噪比,n4的数据未显示。插图:950 Mhz下n123的旋转框架弛豫(R1ρ)[蓝色,非磷酸化的n123;橙色,pn123 (ii)]。螺旋p在n123中可见,可能是由于这种结构的分子量较低,可以比较n3的这个区域的动态行为。这一比较表明,过度磷酸化强烈影响SR区域的动态特性。

过度磷酸化模拟RNA与N2的结合。
(A)添加单链14- mer RnA (UcUAAAcGAAcUUU)(蓝色)后在n234的15n- 1h tROSY光谱中测量的cSPs,与未磷酸化和SRPK1/GSK- 3/cK1磷酸化的n234(红色)之间的化学位移差异进行比较(由于动态范围的原因,未显示由于感兴趣的残基的直接磷酸化而从pSR区域产生的极端位移)。为了与磷酸化cSPs进行最佳比较,将RnA结合的cSPs按因子1.5缩放。
(B)最大化学位移差异映射到n2和n3(黄色)上,以带状和表面表示。
(C) RnA结合指和基板β片在RnA结合域上的位置,n2。黄色表面如(B)所示。
(D)在14- mer RnA浓度增加的情况下,由150 μM n234的13c- 1h hMQc得到的化学位移滴定的例子。图中显示了RnA结合指(Met101)和基板β片(leu56)上的残基。这些滴定得到的关联常数为(230±10)μM。
(E) n234(浓度,150 μM) 15n- 1h tROSY光谱中的cSPs随14- mer单链RnA浓度(红色,0%;橙色,25%;浅蓝色,100%;深蓝色,200%)(全光谱见图S8)。
(F)与(e)相同残基的n234(浓度,150 μM)在15n- 1h的tROSY光谱中的cSPs与磷酸化状态的函数关系[红色,未磷酸化的n234;浅蓝色,pn234(i);橙色,pn234 (ii)]。
(G) n234(浓度,150 μM)的13c- 1h hMQc光谱中选定残基的cSPs随14- mer单链RnA浓度的变化(红色,0%;橙色,25%;浅蓝色,100%;深蓝色,200%)。(H) n234(浓度,150 μM)的13c- 1h hMQc光谱中与(e)相同残基的cSPs作为磷酸化状态的函数[红色,未磷酸化的n234;浅蓝色,pn234(i);橙色,pn234 (ii)]。

SRPK1、GSK- 3和CK1的过度磷酸化抑制RNA结合。
(A) n234(浓度为150 μM)的13c- 1h hMQc光谱,随着14- mer单链RnA(红色,0%;深蓝色,200%)。
(B) SRPK1/GSK- 3磷酸化的n234 [150 μM pn234(ii)]在13c- 1h hMQc光谱中,选定残基随14- mer单链RnA浓度的变化而发生的化学位移(红色,0%;深蓝色,200%)。没有观察到明显的变化[与(A)相比]。200%的光谱呈现为单一轮廓,以突出缺乏绑定。
(C)经PKA (150 μM)磷酸化的n234的13c- 1h hMQc光谱中选定残基的化学位移随14- mer单链RnA浓度的变化(红色,0%;深蓝色,200%)。位移与在未磷酸化的n234中测量的csp具有高度可比性[与(A)相比]。
(D)非磷酸化n123(浓度,200 μM)在存在和不存在等摩尔14- mer单链RnA(红色,0%;蓝色,100%)。
(E) SRPK1- GSK3磷酸化n123(浓度,200 μM)在存在和不存在等摩尔14- mer单链RnA(红色,0%;蓝色,100%)。100%的光谱呈现为单一轮廓,以突出缺乏结合。
(F) 15n- 1h被PKA磷酸化的n234的tROSY中的cSPs(蓝色)和(红色)pn234(ii)。
(G)未磷酸化的n234(灰色)的13c- 1h hMQc谱图,n234被PKA(蓝色)和pn234(ii)磷酸化(红色)。
(H)与PKA(灰色/黑色)、SRPK1(绿色)、GSK- 3(蓝色)和cK1(红色)孵育后SR区显示体外磷酸化位点(黑体)的序列。
(I) n2表面pSR n-末端(182 ~ 191)和c-末端(194 ~ 206)区域的推定差异结合位点示意图。n2上的红色阴影表示PKA和SRPK1/GSK- 3磷酸化同时诱导的cSPs,而橙色表示SRPK1/GSK- 3磷酸化仅移位的区域。
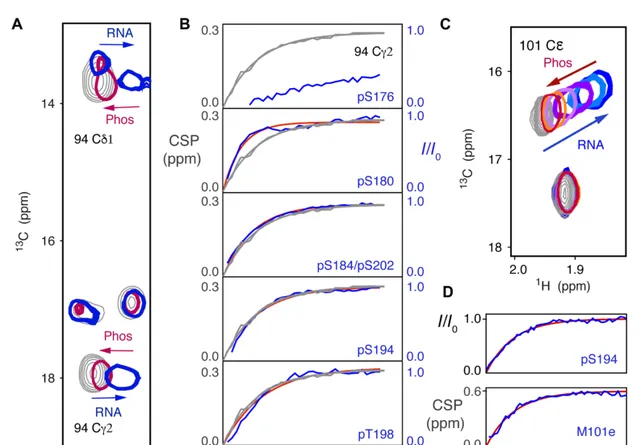
SR磷酸化抑制RNA结合的实时观察。
(A) pn234甲基13c-1h hMQc中的cSPs(i),特别是94cγ2,显示了14-mer RnA结合(灰色,0μM,蓝色200μM)的影响,以及随后在与GSK- 3孵育期间相同峰向未结合形式的偏移(红色)。
(B) 15n-1h hSQc磷酸化峰强度增加的时间过程对比(蓝色,实验;红色,单指数拟合)和94cγ2的cSP(灰色,实验和拟合)。94c-γ-2和94c-δ-1的相关时间常数分别为(0.50±0.07)h(pS180)、(0.30±0.04)h(pS184/pS202)、(0.26±0.07)h (pS194)和(0.24±0.05)h (pt198),而94c-γ-2和94c-δ-1的相关时间常数分别为(0.24±0.03)和(0.26±0.03)h。pS176和pS186(未显示)速度太慢,无法准确拟合。
(C) pn234的甲基13c- 1h hMQc中的cSPs (i) (M101cε)显示了30- mer polyA RnA结合的影响(灰色,0 μM,蓝色120 μM),以及随后在GSK- 3孵育期间不同磷酸化状态的分布向未结合的完全磷酸化形式转移(浅蓝色到红色)。
(D) 15n- 1h hSQc pS194峰强度增加的时间过程(蓝色,实验;红色,拟合单一指数)和(底部)在与GSK- 3孵育期间,101cε的甲基13c- 1h cSP从RnA结合形式转变为非结合形式,如图(c)所示(蓝色,实验;红色,单指数拟合)。相关时间常数:pS194为(0.10±0.04)小时,101cε为(0.099±0.030)小时。

过度磷酸化对顺磁弛豫增强的调节。
(A) 13c- 1h hMQc在teMPO-标记的n234 (G175c)的氧化(蓝色)和还原(红色)形式下的比较。(B) 13c- 1h hMQc在teMPO-标记的pn234(ii) (G175c)的氧化(蓝色)和还原(红色)形式下的比较。在(A)(282和336)中突出显示的强域间PRes由于磷酸化而明显减弱。
(C)表明n234中对长程顺序的选定影响的表面表示。红色:n4二聚体疏水表面上的残基(这两个单体分别是粉红色和米色),在teMPO标签存在下变宽(175),这种相互作用在磷酸化后减弱。黄色:n2上因过度磷酸化而移位的残基。teMPO标签的位置以洋红色显示。
(D和E)蛋白质的顺磁性和反磁性形式之间的强度比。蓝色,免费n234;红色,pn234 (ii)。虚线表示teMPO标签的位置(175和210)。
(F和G)在自由、非磷酸化形式(A)中,PRes揭示了n2和n4之间以及p和n2之间的长期相互作用。在过度磷酸化后,相互作用被削弱(B)或完全抑制。n2上的csp(黄色)[见(c)]。
实验结论
本文的贡献点在于揭示了SARS-CoV-2核衣壳蛋白的一种特定的磷酸化依赖性构象转换,该转换会抑制RNA结合。作者使用核磁共振技术研究了三种激酶对核衣壳蛋白的磷酸化作用,并发现当八个磷酸化位点被磷酸化后,核衣壳蛋白的SR区域会与单链RNA结合相同的界面,从而完全抑制RNA结合。此外,作者还发现RNA结合、连接和二聚化域之间的远程联系被取消,这可能与基因组的包装和解包装有关。本文的局限性在于研究仅限于体外实验,需要进一步的研究来验证这些发现在细胞内是否成立。总之,本文的研究为了解宿主激酶调节病毒功能提供了新的见解。











