2023年9月6日,埃默里大学/中国科学院深圳先进技术研究院叶克强、华中科技大学王小川及江汉大学舒细记以共同通讯作者身份在 Nature Communications 发表题为 「Bacteroides Fragilis in the gut microbiomes of Alzheimer’s disease activates microglia and triggers pathogenesis in neuronal C/EBPβ transgenic mice」 的研究论文。该研究表明脆弱拟杆菌及其代谢物12-HHTrE和PGE2在神经元C/EBPβ转基因小鼠中可激活小胶质细胞并诱导AD发病。

01研究背景
阿尔茨海默病(Alzheimer’s disease ,AD)的两个显著特征是不溶性淀粉样蛋白β(Aβ)沉积和磷酸化的富含Tau的神经原纤维缠结(NFT)。活化的小胶质细胞在大脑对神经元变性的免疫应答中起关键作用,小胶质细胞活化是AD发病机制的早期事件。肠道菌群失调是AD的发病机理之一,而在AD患者肠道微生物群中,拟杆菌菌株会选择性地升高。然而,目前仍不清楚哪些拟杆菌物种及其代谢物如何引发AD的病理变化。
02结果
首先,为了探究AD肠道微生态失调是否能够引发小鼠的AD样病理变化,作者对正常野生型小鼠和Thy1-C/EBPβ转基因小鼠持续两个月灌胃AD患者和正常人的粪便,发现与接受健康供体粪菌移植(FMT)的小鼠相比,抗生素预处理的Thy1-C/EBPβ转基因小鼠的AD患者粪便的再定植引起了AD病理(Fig. 1)。
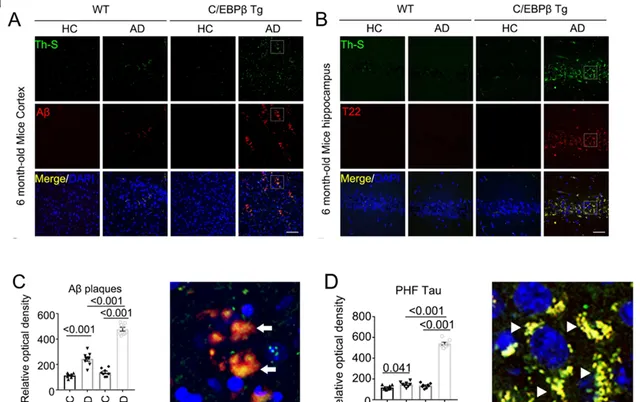
Fig.1 AD患者粪便移植在Thy1-C/EBPβ转基因小鼠中诱导Aβ和Tau聚集
其次,作者评估了AD肠道微生物群引起的AD样病理是否涉及C/EBPβ/AEP信号激活,发现AD肠道微生物引起C/EBPβ和其激活状态p-C/EBPβ均升高,然后引发AEP的上调,并造成小鼠认知功能障碍(Fig. 2)。
Fig.2 AD 患者的粪菌移植激活了 C/EBPβ/AEP通路和转基因小鼠的认知功能障碍
有研究表明C/EBPβ介导小胶质细胞调控炎症和神经元细胞死亡,本研究发现AD粪菌移植后,正常小鼠以及转基因小鼠海马中阳性小胶质细胞的C/EBPβ信号增强。包括IL-6和IL-1β在内的炎症因子被AD患者肠道内的菌群激活。AD的粪菌也上调了与多不饱和脂肪酸相关的代谢酶(Fig. 3)。
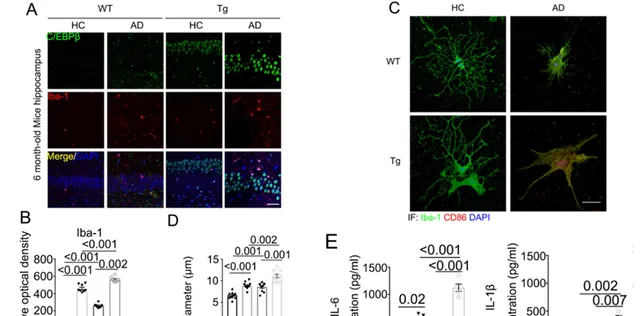
Fig.3 AD粪菌移植激活小胶质细胞并增加Thy1-C/EBPβ转基因小鼠的PUFA氧化酶
之前的研究通过微生物组和代谢组分析表明了脆弱拟杆菌可能在介导Thy1-C/EBPβ转基因小鼠大脑中小胶质细胞活化和神经炎症中发挥重要作用,为了验证上述猜想,作者灌胃给予转基因小鼠活的以及灭活的脆弱拟杆菌,发现活的脆弱拟杆菌引起Thy1-C/EBPβ转基因小鼠中广泛的病理性 Aβ 和 Tau 积累,同时还降低了小鼠的记忆认知功能(Fig. 4)。
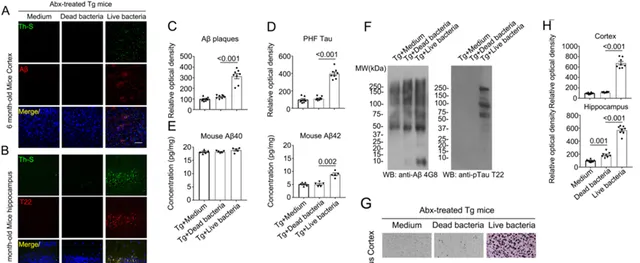
Fig.4 活的脆弱拟杆菌在Thy1-C/EBPβ转基因小鼠中诱导AD样病变
脆弱拟杆菌将花生四烯酸代谢为多种多不饱和脂肪酸衍生物,接下来作者为了探究这些代谢产物是否能够引起AD样病理变化,作者通过腹腔注射稀释的12-羟基-十七碳三烯酸(12-HHTrE)或前列腺素E2(PGE2)溶液以5 mg/kg 的剂量每周两次,持续4周。结果可以发现两种代谢物都能引发海马中Aβ蛋白和Tau蛋白的聚集并且诱发突触变性以及损害认知功能,并且前列腺素E2在引发 AD 样病理和认知缺陷方面表现出比 12-HHTrE 更强的作用(Fig. 5)。
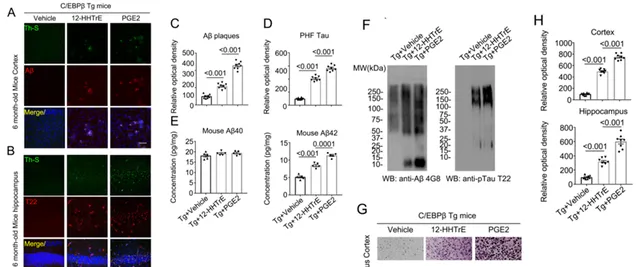
Fig.5 12-HHTrE或 PGE2 诱导Thy1-C/EBPβ转基因小鼠的AD 样病理和认知缺陷
03供稿者短评
在本研究中,脆弱拟杆菌及其代谢物12-羟基-十七碳三烯酸(12-HHTrE)和前列腺素E2(PGE2)在神经元C/EBPβ转基因小鼠中激活小胶质细胞并诱导AD发病。然而,该研究也存在着不足之处,给予AD患者粪便微生物的Thy1-C/EBPβ转基因小鼠AD病理变化比正常小鼠严重的具体原因还需要进一步探究;其次,脆弱拟杆菌是否还存在其他代谢产物的变化同样需进一步探究;再次,在寻找具体哪种代谢物质介导的AD病理变化以及小胶质细胞激活,结合小鼠粪便、血清以及脑组织代谢组学,该项研究的框架会更为完整;最后,本研究只探究了大脑中C/EBPβ信号的激活,基于肠道到大脑传播的「上行解剖理论」,可以进一步探讨肠道中C/EBPβ信号。
文献来源
https://doi.org/10.1038/s41467-023-41283-w.2023.09.06











